针刺次髎对大鼠自主神经系统相关神经元放电频率的影响*
潘彦宏,詹铮,姜劲峰
南京中医药大学,江苏 南京 210023
次髎位于足太阳膀胱经,临近胞宫,而任督二脉、冲脉皆起于胞宫,因上述经脉走行范围广泛及穴位的远治作用,次髎穴在临床上的应用范围随之增加。研究发现,针刺次髎穴不仅可以治疗腰骶部运动系统疾病和盆腔器官相关疾病[1],亦可治疗局灶性疾病[2]、全身性炎症疾病[3],并降低内脏高敏状态[4]。
骶神经刺激(sacral nerve stimulation,SNS)可通过“脊髓-中枢”环路激活胆碱能通路改善急性结肠炎症状[5],而电针次髎穴可作为SNS的临床转化方法。本课题组研究证明,电针“次髎”能够降低脂多糖所致全身重度炎症模型大鼠的血清炎症因子水平,提高致死性内毒素血症模型大鼠生存率[6]。从选择躯干部位的相似性到上述实验的结果,两种刺激方法存在高度的一致性,都需要颈迷走神经及中枢胆碱能受体参与。故而推测,电针次髎亦可通过胆碱能通路发挥全身性抗炎效应。针刺八髎区域穴位可不经过迷走传入途径,而是经由“脊髓-中枢”环路直接作用于脑部迷走神经复合体(dorsal vagal complex,DVC),从而引发相应的效应。迷走神经被认为是脑和免疫系统之间的双向连接器,其中枢端涉及脑干部位的DVC核团[7]。已有研究证明,骶神经刺激可增强孤束核c-fos阳性表达及外周迷走神经活性,本课题组实验亦证明迷走神经与盆神经参与次髎穴的抗炎效应,然而针刺次髎对孤束核与外周迷走神经的具体影响未见报道。
大量实验证明,交感环路在机体抗炎中发挥重要作用[8-10],内脏大神经介导躯体所调控的全身性炎症反应[11-12]。Martelli等[13]研究发现,交感神经在炎症反射中比迷走神经更强大,而针刺次髎对于交感神经系统的影响尚未见报道。基于此,本研究观察针刺次髎对于孤束核、迷走神经、蓝斑核放电的影响。
1 材料
1.1 动物健康成年雄性SD大鼠48只,30只体质量300~320 g,18只体质量230~250 g,由浙江省医学科学院提供,动物生产许可证编号:SCXK(浙)2019-0001。所有动物饲养于南京中医药大学动物实验中心,室温(22±2)℃,相对湿度40%~60%,12 h/12 h明暗周期交替饲养。本实验通过了南京中医药大学动物伦理委员会的伦理审查,伦理批号:012021001085。实验过程严格遵循“3R”原则,遵照科技部发布的《关于善待实验动物的指导性意见》规定,进行充分麻醉。
1.2 药物与试剂乌拉坦(又称氨基甲酸乙酯,化学纯,上海麦克林生化科技有限公司,批号:20201030);滂胺天蓝、脂多糖(lipopolysaccharide,LPS)(美国Sigma公司,批号:2610-05-1、L8880);无水乙酸钠、石蜡油(分析纯,南京化学试剂有限公司,批号:20200111、20200228);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6 ELISA测定试剂盒(上海茁彩生物科技有限公司,批号:LZ-T6870、LZ-H6036、LZ-H7216)。
1.3 仪器HANS-200型电针仪(南京济生医疗科技有限公司);(10)22100821型一次性无菌针灸针(规格:0.35 mm×25 mm,北京中研太合医疗器械有限公司);TDL4-T型低温离心机(德国Eppendorf公司,离心半径:8.0 cm);RT-6100型酶标仪(美国Rayto公司);JB-1028型脑立体定位仪(美国David Kopf Instruments公司);PC-100型微电极操作控制器(日本Narishige公司);1700型细胞外电生理记录放大器(美国A-M systmmes公司);Mi-cro3-1401型生理信号采集分析系统(英国CED公司);H-KWDY-Ⅲ型温控仪(南京市泉水教学实验器材厂);ALC-CED6型电动颅骨钻(上海奥尔科特生物科技有限公司);WD-1型玻璃微电极拉制仪(成都仪器厂);B120-90-10型玻璃微电极(规格:100 mm×1.2 mm,南京市泉水教学实验器材厂)。
2 方法
2.1 分组、造模与干预方法动物适应性饲养1周后,分为实验一组和实验二组,其中实验一组为体质量230~250 g的18只大鼠,随机分为正常组、模型组与次髎组,每组6只。术前动物禁食12 h,不禁水,大鼠腹腔注射体积分数20%乌拉坦(1.0 g·kg-1)进行麻醉后,正常组大鼠根据体质量以0.67 mL·kg-1的剂量腹腔注射9 ng·L-1氯化钠溶液,模型组与次髎组则以1 mL·kg-1的剂量腹腔注射LPS(6 mg·kg-1)制备全身重度炎症模型[14]。造模完成后,参照文献[15-16]对大鼠次髎穴进行定位,大鼠S2相当于人类的中髎和次髎穴,位于第2、第3骶骨棘突间隙正中旁开约5 mm。电针次髎时,电流强度以大鼠双下肢内收内旋、尾巴震动为准[17-18],频率 30 Hz,波宽(0.2±0.06)ms,于造模前后各电针 30 min。实验二组为体质量300~320 g的30只大鼠,随机分为孤束核组、蓝斑组与迷走神经组,每组10只,无需造模,直接进行左侧次髎穴直刺干预,进针深度为15 mm,施以手法(捻转120°、频率80次·min-1)刺激30 s。
2.2 神经元放电细胞外记录实验二组大鼠术前禁食12 h,自由饮水,以体积分数20%乌拉坦(1 g·kg-1)腹腔注射进行麻醉。孤束核组、蓝班组:大鼠俯卧位,用耳棒将大鼠双耳固定在脑立体定位仪上,于头正中线切开皮肤,分离皮下组织、骨膜,暴露颅骨,调整前后囟高度使其保持在同一条水平线上。实验过程中使用加热毯将动物体温维持在37~39 ℃。按照Paxinos G和Watson C图谱[19]定位左侧孤束核(坐标:AP=11.0~11.4 mm,RL=1.0 mm,H=5.6 mm)及左侧蓝斑(坐标:AP=11.6 mm,RL=1.0 mm,H=5.6 mm),牙科钻除去对应定点部位的颅顶骨,在显微镜下小心去除硬脑膜,用38 ℃石蜡油覆盖,保护脑组织。采用充置含1%滂胺天蓝的 0.5 mol·L-1醋酸钠电解液的玻璃微电极(尖端0.5~2 μm,阻抗:10~20 mΩ)通过微电极操作器控制到达目标核团,探查神经元放电,进行细胞外记录[20]。当神经元自发放电信号出现时,上下调整推进器位置至信噪比较大时停止推进,电极尖端停留在放电神经元处,观察其稳定放电后开始记录。所记录放电信号经前置放大器放大,输入生理信号采集系统进行数据采集,使用Spike 2软件进行数据记录与分析。根据上述大鼠脑立体定位图谱所定位置,孤束核组采用微电极垂直进入脑部,而记录蓝斑时,玻璃微电极针尖向大鼠头面方向沿矢状面倾斜15°(避开横窦)进入脑部,其余实验步骤与孤束核组一致。迷走神经组:从大鼠颈前胸锁乳突肌做切口,逐层剪开皮肤、肌肉,暴露颈动脉和迷走神经,迷走神经主干位于颈椎中段,用玻璃分针轻柔地分离颈动脉和迷走神经,充分暴露迷走神经后,滴入 34~38 ℃的温热石蜡油浸浴神经。将自制的引导电极从分离出的迷走神经穿过,参考电极置于切口处的皮下。神经放电产生的电信号经引导电极和参考电极传入前置放大器,放大后经过过滤被生物信号采集分析系统采集转变成图像显示在电脑上。放电信号稳定后,首先记录正常放电30 s作为基线对照,随后针刺穴位给予刺激30 s,同时观察并记录孤束核神经元、蓝斑神经元与迷走神经电活动30 s,记录结束后取针。完整记录一个循环(基线-针刺-取针)保存为该穴位组的样本数据。
2.3 组织学定位神经元放电细胞外记录结束后,采用数显直流稳压电源刺激器向玻璃微电极通 20 μA 负向直流电20~30 min,将玻璃微电极内的滂胺天蓝醋酸钠溶液导入脑组织以标记位置。随后取脑组织并固定于40 ng·L-1多聚甲醛溶液中 72 h,保存于 4 ℃ 冰箱中。取出后置于20%蔗糖溶液中4 ℃浸泡12 h,再置于30%蔗糖溶液中4 ℃浸泡12 h后进行梯度脱水。脱水后用冰冻切片机制备50~60 μm 厚的脑切片,观察染色,检查记录点位置。完整记录一个循环数据并且位置准确者,方可纳入最终统计分析数据。
2.4 ELISA检测血清炎性因子TNF-α、IL-1β、IL-6的水平ELISA法检测实验一组大鼠血清炎性因子含量。实验一组大鼠在造模3 h后经腹主动脉取血3mL,静置30 min,2 000 r·min-1离心 20 min 后取上清液存于-80 ℃冰箱。按照试剂盒说明书检测标准品与待测样品的浓度,据不同浓度标准品吸光度值绘制标准曲线,再根据标准曲线计算各组样本的实际含量。

3 结果
3.1 针刺次髎穴对全身重度炎症模型大鼠血清炎性因子的影响与正常组比较,模型组大鼠血清TNF-α、IL-1β、IL-6水平增加;与模型组比较,次髎组大鼠血清TNF-α、IL-1β、IL-6水平降低,差异均具有统计学意义(P<0.000 1)。见图1。

注:与正常组比较,***P<0.000 1;与模型组比较,###P<0.000 1
3.2 针刺次髎穴对孤束核神经元放电频率的影响实验共观察记录到20个神经元,与本组针刺前比较,针刺后大鼠孤束核神经元放电频率增高,差异有统计学意义(P<0.001),结果表明,针刺次髎穴可提高孤束核神经元自发放电的频率。见图2、图3。
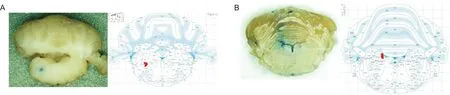
注:A:左图为脑组织切片图(前囟Bregma-11 mm),蓝染处为NTS记录点,右图红色区域为组织图示冠状切面NTS所在位置(前囟Bregma-11.04 mm);B:左图为脑组织切片图(Bregma-9.8 mm),蓝染处为LC记录点,右图红色区域为组织图示冠状切面LC所在位置(Bregma-9.84 mm)
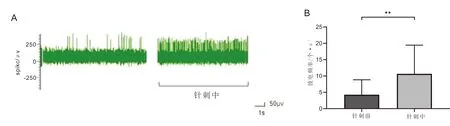
注:A:针刺次髎穴后孤束核神经元放电示意图;B:神经元放电频率量化图,与针刺前比较,**P<0.001
3.3 针刺次髎穴对蓝斑神经元放电频率的影响实验共观察记录到14个神经元,与本组针刺前比较,针刺后大鼠蓝斑神经元放电频率增高,差异有统计学意义(P<0.01),结果表明,针刺次髎穴可提高蓝斑神经元自发放电频率。见图4。
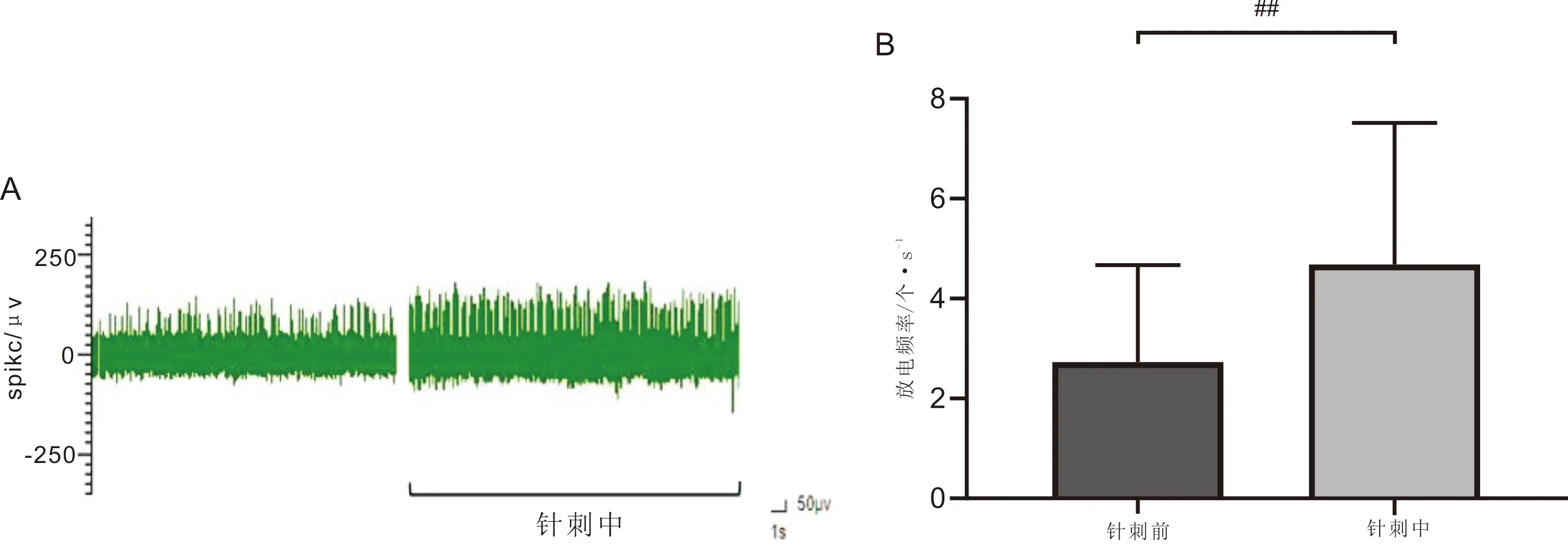
注:A:针刺次髎穴后蓝斑神经元放电示意图;B:神经元放电频率量化图,与针刺前比较,##P<0.01
3.4 针刺次髎穴对迷走神经放电频率的影响与本组针刺前比较,针刺后大鼠迷走神经放电频率增高,差异有统计学意义(P<0.05),结果表明,针刺次髎穴可提高迷走神经自发放电的频率。见图5。
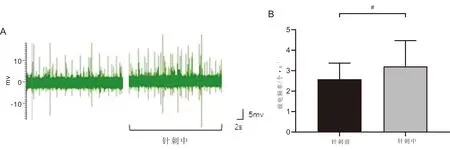
注:A:针刺次髎穴后迷走神经放电示意图;B:神经元放电频率量化图,与针刺前比较,#P<0.05
4 讨论
课题组前期研究已证明颈迷走神经可参与电针次髎的抗炎效应[6]。本次研究结果指示,针刺次髎可明显激活NTS,促进外周迷走神经放电,与前期研究结果一致。另外,已证实SNS可显著提高心率变异性中HF的比值、外周迷走神经活性及肠壁中ChAT+阳性表达,故本次研究为针刺次髎作为SNS的临床转化方法增添了基础证据。此外,本研究还发现针刺次髎穴可激活蓝斑神经元,此前未见有文章报道。
针刺次髎穴或可激活脊髓上中枢、启动自主神经通路,实现次髎的抗炎效应。颈迷走神经刺激、经耳迷走神经刺激与电针足三里分别通过直接激活迷走神经与躯体-自主神经反射启动迷走环路,将信息传达脑干部位的DVC核团,发挥胆碱能抗炎效应[21-23],降低脂多糖致全身重度炎症模型大鼠的死亡率与致炎因子。不同的是,电针次髎降低脂多糖致全身重度炎症模型大鼠死亡率的效果不仅仅是颈迷走神经与盆神经的参与作用,或仍存在交感神经系统的参与作用。在电针深刺次髎治疗膀胱过度活动中,不仅激活了副交感属性的盆神经,也激活了胸腰髓交感神经中枢发出的腹下神经(交感属性)[24]。临床实验发现,针刺次髎穴或可通过抑制外周和中央伤害部位中的环氧化酶合成,产生抗炎作用[25-26]。针刺次髎穴还可降低慢性前列腺炎/慢性盆腔疼痛综合征患者中前列腺素E2的高表达,前列腺素E2可介导炎症和疼痛感知,与交感神经兴奋性成反馈性调节[27]。因此,针刺次髎穴不仅可提高外周迷走神经活性,还可增强交感神经兴奋性从而促进躯体全身性抗炎效应。
针刺次髎穴可调节机体的排尿、排便和性功能,证明针刺次髎穴的副交感调节属性[28]。另一方面,由于骶丛副交感中枢是交感属性[29-31]的讨论引发了关于其自主神经功能方向的争议。有研究提示,传入迷走兴奋可引发交感属性的内脏大神经抗炎通路的激活[32-33],由此推测,针刺次髎穴对交感神经系统的影响存在副交感神经纤维的参与。对高位中枢损伤模型小鼠进行盆腔轻刺激,如膀胱充盈,传入腰骶脊髓可导致交感神经节前纤维的高度兴奋及病变水平以下的大量交感神经放电,引发肌肉、内脏和皮肤血管的收缩,致躯体炎症过度而出现免疫抑制[34-35],揭示了传入膀胱充盈感觉的盆神经纤维的激活可引发延髓水平的交感节前纤维兴奋。针刺次髎可激活盆神经与腹下神经,腹下神经(交感神经属性)主要传导膀胱痛觉,而高位中枢损伤模型小鼠多因尿潴留与便秘而非盆腔疼痛引发免疫抑制与高血压性自主神经反射障碍,故推测针刺次髎是以副交感传入纤维为入口引发躯体的副交感传出与交感激活效应。
次髎穴是体表刺激调节副交感神经途径的方式之一[36],针刺通过躯体-自主神经反射激活迷走神经从而发挥全身性的抗炎作用。在此之前,电针治疗脂多糖致全身重度炎症模型大鼠多采用内关、足三里与天枢等穴[37],次髎穴的研究为其添加了新的内容。结合本课题组的实验结果可知,次髎穴的全身性抗炎效应或为增加副交感传入,提高脊髓上自主神经中枢兴奋性而实现。针刺次髎穴后,孤束核神经元与蓝斑神经元放电频率的改变存在差异。因实验条件有限,实验数据多在傍晚或夜间获取。大鼠脑干部位的孤束核与蓝斑分别代表脑部的副交感中枢与交感中枢,二者在麻醉状态下存在生理性差异。根据经典的“flip-flop switch”模型[38],认为促觉醒的单胺能细胞群可向下丘脑的睡眠调控中枢-腹外侧视前区(ventrolateral preoptic area,VLPO)发送抑制性输出,从而产生觉醒促进作用,蓝斑分泌的去甲肾上腺素参与其中的调节唤醒,且在麻醉状态下蓝斑神经元的自发放电频率迅速降低。
实验二组大鼠因电刺激次髎时的电磁干扰,影响了仪器对神经元放电的实时检测,故而采用手针的刺激方式。手针的刺激在明显弱于电针刺激(实验一所用参数)的情况下,依旧得出明显的实验成果,足以说明次髎穴对于自主神经系统的特异性调节作用。
综上,次髎穴的中枢整合端位于脑干部位的自主神经系统相关核团,针刺次髎穴可通过促进核团神经元放电频率干预躯体自主神经功能调节。

