m6A识别蛋白HuR调控lncRNA TRG-AS1抑制结直肠癌生长的机制研究
柴小兵,张利,褚菲菲,吴慧丽
结直肠癌(CRC)是一种侵袭性癌症,发生在结肠或直肠,是全球第三大常见恶性肿瘤[1]。尽管治疗CRC可采取手术、化学疗法、放射疗法和分子疗法,但CRC患者的存活率仍然较低[2-3]。因此,深入了解CRC的发病机制对于制定新的治疗策略和改善CRC患者的预后具有重要意义。近年来,RNA甲基化修饰尤其是N6-甲基腺苷(N6-methyladenosine,m6A)甲基化修饰被证实在肿瘤的进展中发挥重要作用。m6A甲基化修饰是一个动态过程,主要受甲基化转移酶复合物、去甲基化酶、结合蛋白的调控[4]。人类抗原R(HuR)是m6A甲基化修饰的识别蛋白。HuR在CRC中高表达,沉默HuR可抑制CRC细胞转移[5]。但其具体调控机制尚不完全明确。生物信息分析显示,长链非编码RNA(lncRNA)T细胞受体γ位点反义RNA1(T cell receptor gamma locus antisense RNA1,TRG-AS1)上存在m6A位点,且TRG-AS1能与HuR蛋白相互作用。相关研究显示,沉默TRG-AS1可明显抑制肝癌细胞增殖、迁移、侵袭[6]。但HuR能否通过调控TRG-AS1影响CRC细胞恶性生物学行为尚不明确。因此,本研究旨在探究HuR对CRC细胞增殖、凋亡、迁移、侵袭的影响及其作用机制。
1 材料与方法
1.1 材料 收集2019年5月—2021年5月在郑州大学附属郑州中心医院首次确诊为CRC患者的癌组织以及距离癌组织3 cm处的癌旁组织,共19对。所有组织收集后立即冻存于液氮中。患者均签署知情同意书,本研究得到郑州大学附属郑州中心医院伦理委员会的批准(伦理号:201901)。人正常结肠上皮细胞NCM460及CRC细胞HCT116、SW480、LO⁃VO均购自上海佰晔生物科技中心。35只5周龄的雌性BALB/c裸鼠购自广州锐格生物科技有限公司[生产许可证号:SCXK(粤)2021-0059]。HuR小干扰RNA(si-HuR,序列:5′-UCAAAGACGCCAACUUGUA-3′)及其阴性对照(si-NC,序列:5′-UAAGGCUAUGAAGAGAUAC-3′)、HuR过表达物(OE-HuR)及其阴性对照(OE-NC)、TRG-AS1过表达物(pcDNA-TRG-AS1)及其阴性对照(pcDNA)均购自河南睿英生物公司;DMEM培养基、胎牛血清购自武汉益普生物公司;EpiQuik M6A RNA甲基化定量检测试剂盒(比色法)购自厦门慧嘉生物公司;CCK-8试剂盒购自杭州昊鑫生物公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自翌圣生物科技公司;兔源一抗HuR、m6A、IgG、GAPDH及羊抗兔IgG二抗均购自英国Abcam公司。ABI-7500实时荧光定量PCR仪购自北京赛百奥科技有限公司;蛋白电泳仪购自北京六一生物科技有限公司;FK-SY96A酶标仪购自山东方科仪器有限公司;流式细胞仪购自上海睿钰生物公司;XDS-100D型倒置光学显微镜购自上海蔡康光学仪器有限公司。
1.2 方法
1.2.1 细胞培养 将NCM460、HCT116、SW480、LOVO细胞置于含有10%胎牛血清的DMEM培养基中,并在37℃、5%CO2条件下培养。
1.2.2 比色法检测m6A含量 按照EpiQuik m6A RNA甲基化定量检测试剂盒(比色法)说明书检测组织和细胞中的m6A含量。
1.2.3 实时荧光定量PCR(qPCR)检测组织和细胞中TRGAS1表达 使用TRIzol提取组织和细胞中RNA,将RNA逆转录为cDNA。以cDNA为模板在ABI-7500实时荧光定量PCR仪上进行实时荧光定量PCR。反应体系:上、下游引物各1μL,cDNA模板1μL,SYBR premix 10μL,补无菌水至总体积为20μL。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火30 s,共45个循环。以GAPDH为内参,通过2-ΔΔCt法计算TRG-AS1的表达水平。引物及序列见表1。
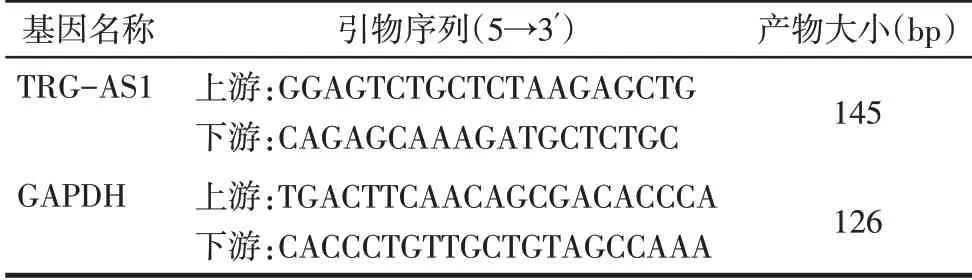
Tab.1 qPCR primer sequences表1 qPCR引物序列
1.2.4 Western blot检测组织和细胞中HuR蛋白的表达 在冰上用RIPA裂解缓冲液裂解组织匀浆和细胞30 min,10 000 r/min离心20 min,收集上清液,通过BCA试剂盒检测蛋白质浓度,将30μg蛋白质进行10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳。电泳分离后将蛋白质转移到PVDF膜上,再用5%脱脂奶粉封闭1 h,经TBST洗涤后,将PVDF膜与一抗HuR(1∶2 000)、GAPDH(1∶1 000)在4℃下孵育过夜,再加入二抗(1∶1 000)在常温下孵育1.5 h。加入ECL试剂观察蛋白条带,以GAPDH为内参,通过Quantity One软件计算蛋白灰度值。
1.2.5 细胞分组 OE-NC、OE-HuR、si-NC、si-HuR、si-HuR+pcDNA、si-HuR+pcDNA-TRG-AS1分别转染于对数生长期的HCT116细胞,命名为OE-NC组、OE-HuR组、si-NC组、si-HuR组、si-HuR+pcDNA组、si-HuR+pcDNA-TRG-AS1组,另取正常培养的HCT116细胞作为Ct组,转染48 h后,用于后续实验。
1.2.6 CCK-8法检测细胞增殖 将各组细胞以1×104个/孔接种在96孔板中培养48 h后,加入10μL CCK-8试剂。孵育2 h后,使用酶标仪测量450 nm处的光密度(OD)。
1.2.7 平板克隆实验检测细胞克隆形成能力 将350个HCT116细胞接种于6 cm细胞培养板中,在含有10%FBS的DMEM培养基中培养15 d。弃培养液,将细胞用甲醇固定、0.1%结晶紫染色,并观察克隆形成情况。克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.2.8 流式细胞术检测细胞凋亡率 将1×105个细胞重悬于100μL结合缓冲液中。用5μL Annexin V-FITC和5μL碘化丙啶溶液对细胞进行双重染色。使用流式细胞仪测定细胞凋亡率。将第二、三象限的细胞定为凋亡细胞,细胞凋亡率=(凋亡细胞数/总细胞数)×100%。
1.2.9 划痕愈合实验检测细胞迁移 将各组细胞以1×106个/孔接种于6孔板中,当细胞汇合度达到100%时,使用100μL移液器吸头刮擦细胞层以制造划痕,并将含10%FBS的DMEM培养基替换为无FBS的DMEM培养基,观察细胞在0、48 h时的划痕愈合情况。划痕愈合率(%)=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.10 Transwell检测细胞侵袭 Transwell小室上室预涂有Matrigel,将含有5×104个细胞的细胞悬浮液添加到孔径为8μm的Transwell上室中。下室填充有600μL含有10%FBS的DMEM培养基。孵育48 h后,去除上表面残留的细胞,侵袭的细胞用4%多聚甲醛固定,0.5%结晶紫染色。在倒置光学显微镜下对染色的细胞进行拍照和计数。
1.2.11 裸鼠体内移植瘤实验 将1.2.5中的各组细胞以5×105个悬浮在100μL PBS中,然后通过右侧腋窝皮下接种于小鼠体内,并命名为裸鼠Ct组、裸鼠OE-NC组、裸鼠OEHuR组、裸鼠si-NC组、裸鼠si-HuR组、裸鼠si-HuR+pcDNA组、裸鼠si-HuR+pcDNA-TRG-AS1组,每组5只。注射40 d后,处死裸鼠并分离出肿瘤,称量肿瘤质量。
1.2.12 甲基化RNA免疫共沉淀(MeRIP)检测TRG-AS1上是否存在m6A位点 分离HCT116细胞的RNA,磁珠在室温下用5μg抗m6A抗体或抗IgG抗体包被30 min。然后,将抗体包被的珠子与50μg总RNA在4℃下孵育过夜。经蛋白酶K消化后,通过苯酚/氯仿/异戊醇法提取沉淀m6A结合的RNA,通过qPCR检测TRG-AS1的表达量,方法同1.2.3。
1.2.13 RNA pull-down实验检测HuR与TRG-AS1结合 将生物素化的TRG-AS1阴性对照(NC)和TRG-AS1分别转染到HCT116中。48 h后,将细胞裂解液与链酶亲和素标记的磁珠混合形成蛋白质-生物/RNA-磁珠复合物,用高盐洗脱得到蛋白质-生物/RNA复合物,分别命名为bio-NC组、bio-TRG-AS1组,以Input作为阳性对照。Western blot检测HuR蛋白在蛋白质-生物/RNA混合物中的表达,方法同1.2.4。
1.2.14 RIP检测TRG-AS1与HuR蛋白结合 在RIP裂解缓冲液中裂解细胞,利用蛋白A/G磁珠对HuR抗体进行免疫沉淀,用磁铁固定与复合物结合的磁珠并洗掉未结合的部分,提取RNA,通过qPCR分析TRG-AS1的相对表达量,IgG蛋白作为对照参考。
1.3 统计学方法 使用GraphPad Prism 5.0进行数据分析,所有数据均采用均数±标准差()表示。2组间比较采用t检验,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 m6A含量、TRG-AS1和HuR蛋白在组织中的表达 与癌旁组织比较,癌组织中HuR蛋白、TRGAS1表达升高,m6A含量降低(P<0.05),见图1、表2。

Fig.1 Western blot detection of HuR protein expression in tissue图1 Western blot检测组织中HuR蛋白表达
Tab.2 Comparison of HuR protein,m6A content and TRG-AS1 expression in cancer and adjacent tissues表2癌组织和癌旁组织HuR蛋白、m6A含量和TRG-AS1表达比较 (n=19)
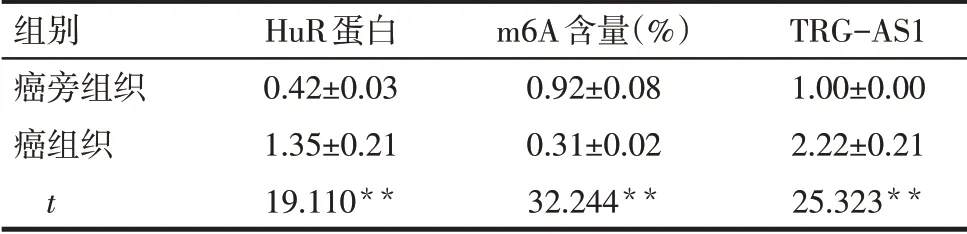
Tab.2 Comparison of HuR protein,m6A content and TRG-AS1 expression in cancer and adjacent tissues表2癌组织和癌旁组织HuR蛋白、m6A含量和TRG-AS1表达比较 (n=19)
**P<0.01。
组别癌旁组织癌组织t HuR蛋白0.42±0.03 1.35±0.21 19.110**m6A含量(%)0.92±0.08 0.31±0.02 32.244**TRG-AS1 1.00±0.00 2.22±0.21 25.323**
2.2 m6A含量、TRG-AS1和HuR蛋白在细胞中的表达 与NCM460细胞比较,HCT116、SW480、LOVO细胞中HuR蛋白、TRG-AS1表达升高,m6A含量减少(P<0.05),且HCT116细胞中HuR蛋白、TRG-AS1表达高于SW480、LOVO细胞,m6A含量低于SW480、LOVO细胞(P<0.05),选择HCT116细胞为后续实验研究对象,见图2、表3。
2.3 m6A含量、HuR蛋白、TRG-AS1在各组HCT116细胞中的表达 与Ct组、OE-NC组比较,OE-HuR组的HCT116细胞中HuR蛋白、TRG-AS1表达升高,m6A含量降低(P<0.05);与Ct组、si-NC组比较,si-HuR组HCT116细胞中HuR蛋白、TRG-AS1表达降低,m6A含量升高(P<0.05);与si-HuR组、si-HuR+pcDNA组比较,si-HuR+pcDNA-TRG-AS1组HCT116细胞中HuR蛋白、m6A含量差异无统计学意义,TRG-AS1表达升高(P<0.05),见图3、表4。

Fig.2 Western blot detection of HuR protein expression in cells图2 Western blot检测细胞中HuR蛋白表达
Tab.3 Comparison of m6A content,HuR protein and TRG-AS1 expression between normal colonic epithelial cells and CRC cells表3正常结肠上皮细胞及CRC细胞m6A含量、HuR蛋白、TRG-AS1表达比较 (n=6,s)

Tab.3 Comparison of m6A content,HuR protein and TRG-AS1 expression between normal colonic epithelial cells and CRC cells表3正常结肠上皮细胞及CRC细胞m6A含量、HuR蛋白、TRG-AS1表达比较 (n=6,s)
**P<0.01;a与NCM460细胞比较,b与HCT116细胞比较,P<0.05。
组别NCM460 HCT116 SW480 LOVO F TRG-AS1 1.00±0.00 2.58±0.24a 2.27±0.22ab 2.04±0.23ab 70.881**HuR 0.36±0.03 1.48±0.23a 1.21±0.20ab 1.01±0.09ab 53.645**m6A含量(%)1.23±0.11 0.27±0.02a 0.38±0.03ab 0.46±0.04ab 305.547**
2.4 过表达或沉默HuR对HCT116细胞增殖、凋亡的影响 与Ct组、OE-NC组比较,OE-HuR组HCT116细胞OD450值、克隆形成率升高,细胞凋亡率降低(P<0.05);与Ct组、si-NC组比较,si-HuR组HCT116细胞OD450值、克隆形成率降低,细胞凋亡率升高(P<0.05);与si-HuR组、si-HuR+pcDNA组比较,si-HuR+pcDNA-TRG-AS1组HCT116细胞OD450值、克隆形成率升高,细胞凋亡率降低(P<0.05),见图4、5,表5。

Fig.3 Western blot detection of HuR protein expression in HCT116 cells图3 Western blot检测HCT116细胞中HuR蛋白表达
Tab.4 Comparison of HuRprotein,m6Acontent and TRGAS1 expression in HCT116 cells between the seven groups表4各组HCT116细胞中的HuR蛋白、m6A含量、TRG-AS1表达比较 (n=6)
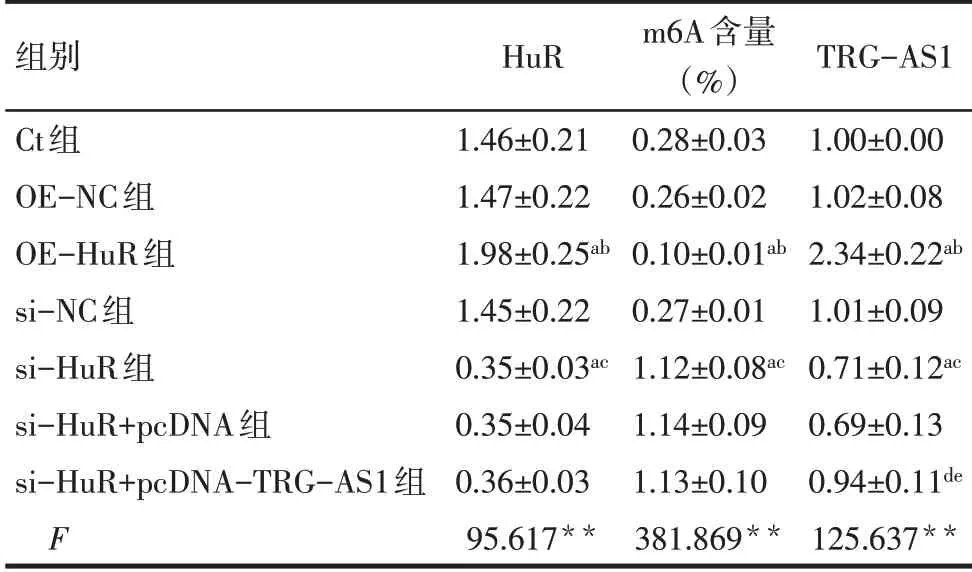
Tab.4 Comparison of HuRprotein,m6Acontent and TRGAS1 expression in HCT116 cells between the seven groups表4各组HCT116细胞中的HuR蛋白、m6A含量、TRG-AS1表达比较 (n=6)
**P<0.01;a与Ct组比较,b与OE-NC组比较,c与si-NC组比较,d与si-HuR组比较,e与si-HuR+pcDNA组比较,P<0.05;表5、6同。
组别Ct组OE-NC组OE-HuR组si-NC组si-HuR组si-HuR+pcDNA组si-HuR+pcDNA-TRG-AS1组F HuR 1.46±0.21 1.47±0.22 1.98±0.25ab 1.45±0.22 0.35±0.03ac 0.35±0.04 0.36±0.03 95.617**m6A含量(%)0.28±0.03 0.26±0.02 0.10±0.01ab 0.27±0.01 1.12±0.08ac 1.14±0.09 1.13±0.10 381.869**TRG-AS1 1.00±0.00 1.02±0.08 2.34±0.22ab 1.01±0.09 0.71±0.12ac 0.69±0.13 0.94±0.11de 125.637**
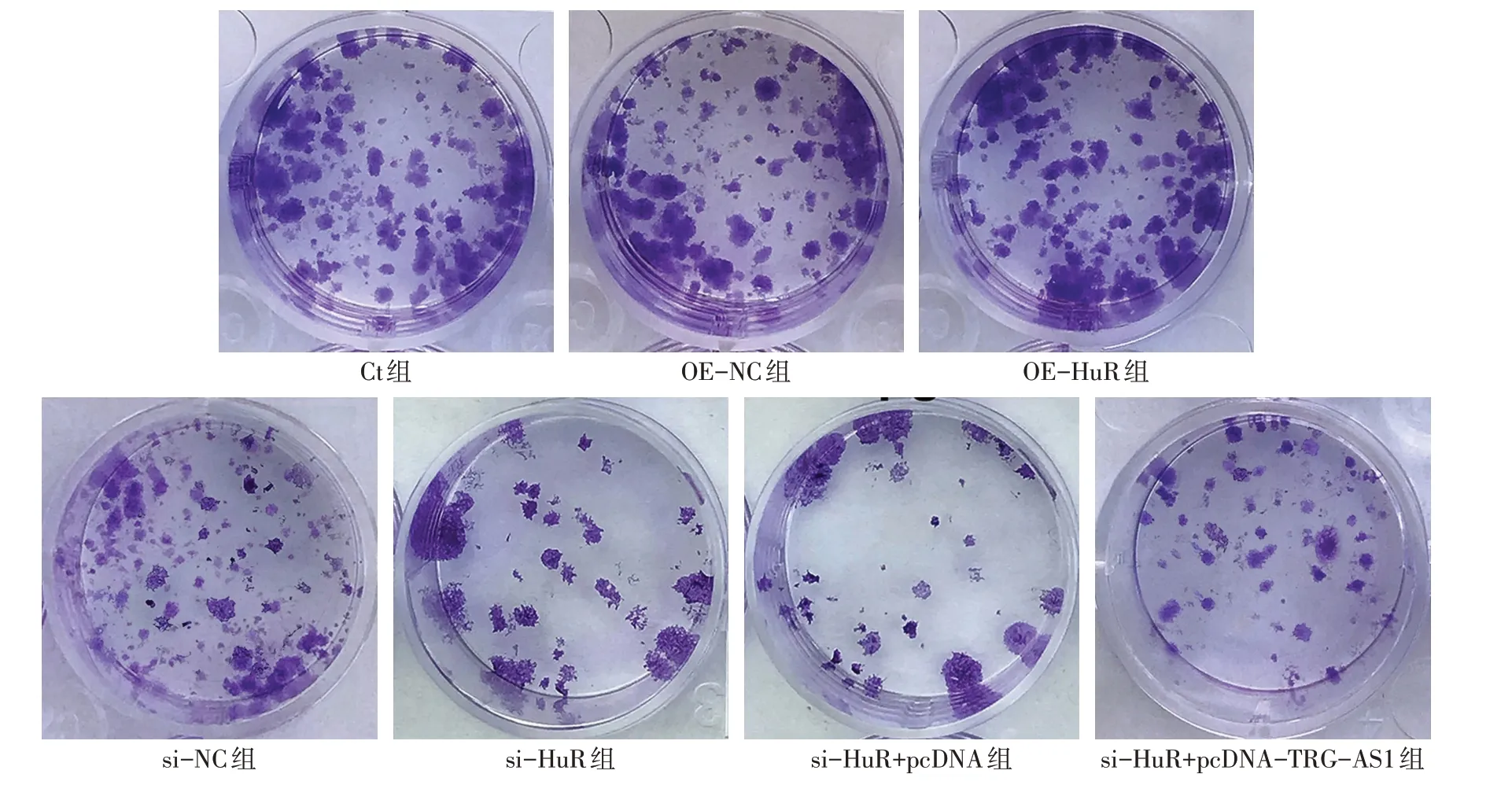
Fig.4 Effects of silencing or overexpression of HuR on HCT116 cell clone formation图4 沉默或过表达HuR对HCT116细胞克隆形成的影响

Fig.5 Effects of silencing or overexpression of HuR on apoptosis of HCT116 cells detected by Annexin V-FITC/PI double staining图5 Annexin V-FITC/PI双重染色检测沉默或过表达HuR对HCT116细胞凋亡的影响
Tab.5 Comparison of OD450 value,clone formation rate and apoptosis rate between different groups of HCT116 cells表5 各组HCT116细胞OD450值、克隆形成率、细胞凋亡率比较 (n=6)

Tab.5 Comparison of OD450 value,clone formation rate and apoptosis rate between different groups of HCT116 cells表5 各组HCT116细胞OD450值、克隆形成率、细胞凋亡率比较 (n=6)
组别Ct组OE-NC组OE-HuR组si-NC组si-HuR组si-HuR+pcDNA组si-HuR+pcDNA-TRG-AS1组F OD450值0.82±0.08 0.83±0.09 1.25±0.12ab 0.84±0.08 0.32±0.02ac 0.33±0.03 0.69±0.05de 112.818**克隆形成率(%)62.23±5.14 63.15±5.09 83.36±6.05ab 62.78±5.16 26.69±2.44ac 26.75±2.38 48.87±4.12de 126.394**细胞凋亡率(%)41.27±3.68 42.26±3.71 24.48±2.39ab 42.33±5.08 65.54±5.62ac 64.57±5.41 46.67±3.08de 67.001**
2.5 过表达或沉默HuR对HCT116细胞迁移、侵袭的影响 与Ct组、OE-NC组比较,OE-HuR组HCT116细胞划痕愈合率、侵袭细胞数目升高(P<0.05);与Ct组、si-NC组比较,si-HuR组HCT116细胞划痕愈合率、侵袭细胞数目降低(P<0.05);与si-HuR组、si-HuR+pcDNA组比较,si-HuR+pcDNATRG-AS1组HCT116细胞划痕愈合率、侵袭细胞数目升高(P<0.05),见表6,图6、7。
2.6 过表达或沉默HuR对裸鼠体内移植瘤生长的影响 各组间移植瘤质量差异有统计学意义(F=210.787,P<0.01)。与Ct组(0.28 g±0.02 g)、OE-NC组(0.29 g±0.01 g)比较,OE-HuR组(0.56 g±0.04 g)裸鼠体内移植瘤质量升高(P<0.05);与Ct组、si-NC组(0.30 g±0.03 g)比较,si-HuR组(0.12 g±0.01 g)裸鼠体内移植瘤质量降低(P<0.05);与si-HuR组、si-HuR+pcDNA组(0.13 g±0.01 g)比 较,si-HuR+pcDNA-TRG-AS1组(0.22 g±0.02 g)裸鼠体内移植瘤质量升高(P<0.05),见图8。
Tab.6 Comparison of wound healing rate and the number of invasive cells between different groups of HCT116 cells表6 各组HCT116细胞划痕愈合率、侵袭细胞数目比较(n=6)
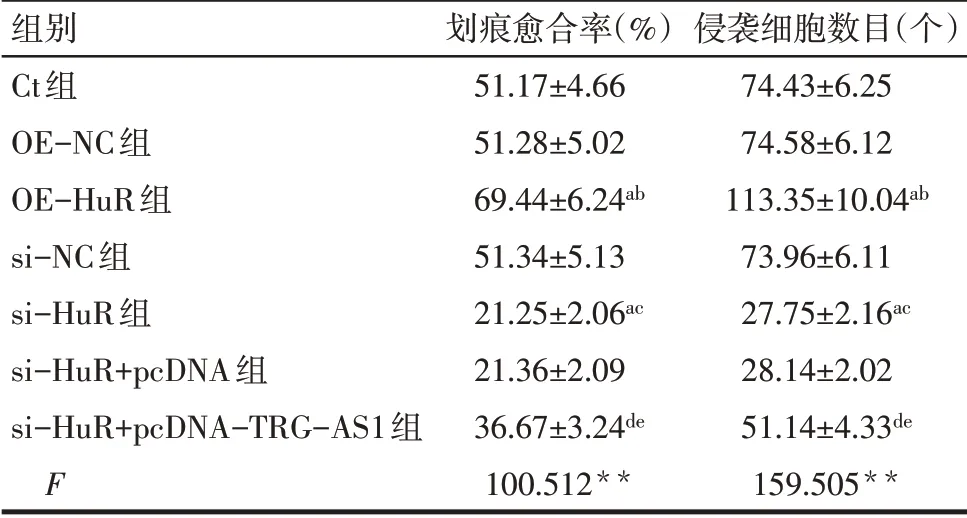
Tab.6 Comparison of wound healing rate and the number of invasive cells between different groups of HCT116 cells表6 各组HCT116细胞划痕愈合率、侵袭细胞数目比较(n=6)
组别Ct组OE-NC组OE-HuR组si-NC组si-HuR组si-HuR+pcDNA组si-HuR+pcDNA-TRG-AS1组F划痕愈合率(%)51.17±4.66 51.28±5.02 69.44±6.24ab 51.34±5.13 21.25±2.06ac 21.36±2.09 36.67±3.24de 100.512**侵袭细胞数目(个)74.43±6.25 74.58±6.12 113.35±10.04ab 73.96±6.11 27.75±2.16ac 28.14±2.02 51.14±4.33de 159.505**
2.7 HuR识别并结合TRG-AS1上的m6A修饰位点 RMVar数据库(https://rmvar.renlab.org/)提示TRG-AS1上存在潜在的m6A位点,见图9。MeRIP结果表明,存在m6A抗体时能够富集到大量TRGAS1(18.62±1.03),而对照IgG富集到极少量TRGAS1(0.25±0.02),差异有统计学意义(t=43.678,P<0.01),表明TRG-AS1上存在m6A位点。RNA下拉实验结果表明,TRG-AS1能与HuR蛋白相互作用,见图10。RIP实验结果表明IgG蛋白(4.15±0.32)富集到的TRG-AS1明显低于HuR抗体(23.68±2.11)(t=22.416,P<0.01)。

Fig.6 The effect of silencing or overexpressing HuR on the migration of HCT116 cells图6 沉默或过表达HuR对HCT116细胞迁移的影响
3 讨论

Fig.7 The effect of silencing or overexpressing HuR on the invasion of HCT116 cells(crystal violet dyeing,×200)图7 沉默或过表达HuR对HCT116细胞侵袭的影响(结晶紫染色,×200)

Fig.8 Comparison of tumor quality in each group图8 各组移植瘤质量比较

Fig.9 RMVar database showing potential m6A sites on TRG-AS1图9 RMVar数据库显示TRG-AS1上存在潜在的m6A位点

Fig.10 RNA pull-down experiments showing HuR binds to TRG-AS1图10 RNA下拉实验表明HuR与TRG-AS1结合
m6A修饰是最常见的RNA甲基化事件之一,主要参与mRNA和非编码RNA的剪接、运输、稳定和降解过程[7]。越来越多的证据表明,m6A修饰在人类不同的癌症中发挥着关键作用。如肝癌组织中m6A含量低于癌旁组织[8];白血病耐药细胞株中m6A含量低于白血病细胞株[9],表明m6A修饰在肝癌、白血病等肿瘤中能够影响肿瘤发生和病理进程。m6A甲基化修饰的识别蛋白HuR在胶质瘤组织中呈高表达状态,上调HuR可促进胶质瘤细胞增殖,抑制细胞凋亡[10];下调HuR抑制了肝癌细胞的增殖、迁移与侵袭[11];低表达HuR可以抑制胃癌MGC-803细胞的侵袭、迁移[12];敲低HuR可以抑制CRC细胞转移[13]。由此表明HuR在多种肿瘤中具有致癌的作用。本研究结果与既往研究一致,在CRC组织和细胞中HuR蛋白高表达,m6A含量降低,且HCT116细胞中HuR蛋白表达量最高,m6A含量最低,因此选择HCT116细胞为研究对象进行转染实验。此外,本研究还发现,过表达HuR可促进HCT116细胞增殖、迁移、侵袭及体内移植瘤的生长,抑制细胞凋亡,降低m6A含量;而沉默HuR则呈相反趋势,证实HuR可通过调节m6A含量影响HCT116细胞恶性生物学行为。
HuR通过识别靶基因的m6A位点发挥其功能[14]。为确认HuR下游靶基因,本研究通过生物信息分析显示TRG-AS1上存在m6A位点。TRG-AS1是一种lncRNA,下调TRG-AS1抑制舌鳞状细胞癌细胞增殖、迁移和侵袭,促进细胞凋亡[15];过表达TRG-AS1可促进胶质母细胞瘤细胞增殖[16];上调TRG-AS1可促进肺癌细胞增殖和侵袭[17]。以上研究表明TRG-AS1在舌鳞状细胞癌、胶质母细胞瘤、肺癌等肿瘤中发挥癌基因的作用。而关于TRGAS1在CRC中的研究鲜有报道。本研究显示,TRGAS1在CRC组织和细胞中高表达,过表达HuR后,HCT116细胞中TRG-AS1表达升高,m6A含量降低;沉默HuR后,HCT116细胞中TRG-AS1表达降低,m6A含量升高;且MeRIP结果表明TRG-AS1上存在m6A位点,RNA pull-down和RIP实验结果表明TRG-AS1能与HuR蛋白相互作用,推测沉默HuR可能通过识别TRG-AS1上的m6A位点来抑制TRGAS1表达进而抑制HCT116细胞增殖、迁移、侵袭及体内移植瘤的生长,促进细胞凋亡。为验证该推测,本研究在沉默HuR的基础上增加pcDNA-TRG-AS1来干预HCT116细胞,结果显示,pcDNA-TRG-AS1减弱了沉默HuR对HCT116细胞增殖、迁移、侵袭及体内移植瘤生长的抑制作用,以及对细胞凋亡的促进作用。
综上所述,沉默HuR可通过抑制TRG-AS1表达进而抑制HCT116细胞增殖、迁移与侵袭,促进细胞凋亡。本研究将TRG-AS1鉴定为HuR介导的m6A修饰的新型下游效应子,证实了m6A修饰在调节lncRNA的生物过程发生中的关键作用,并表明TRG-AS1可能成为治疗CRC的潜在靶点,为CRC进展的潜在机制提供了新线索。

