雷公藤多苷对高糖诱导人肾小管上皮细胞凋亡及CXCL10/CXCR3轴的影响
李明霞,乔海霞,王晓玲,贾丽媛,胡利梅,任卫东△
糖尿病肾病(diabetic nephropathy,DN)属于糖尿病常见的微血管并发症,是引起终末期肾脏病的主要原因,与代谢紊乱、氧化应激、免疫异常、遗传等多种因素有关[1]。高糖环境引起的氧化损伤和肾小管上皮细胞的异常凋亡是DN发展的重要因素[2]。CXC趋化因子配体10(CXC chemokine ligand 10,CXCL10),是一种由多种细胞分泌的促炎性趋化因子,主要与其配体CXC趋化因子受体3(CXC chemokine receptor 3,CXCR3)结合发挥生物学功能,参与糖尿病等多种自身免疫性疾病的发生[3-4]。雷公藤多苷(tripterygium glycosides,TG)是从雷公藤根茎中提取的一种脂溶性混合物,可抑制趋化因子、炎性介质的产生与释放,临床上TG可用于治疗类风湿性关节炎、原发性肾小球肾病、肾病综合征、银屑病等多种免疫性疾病[5-6]。研究表明TG能够降低DN患者尿蛋白,减轻足细胞损伤,保护肾功能[7]。目前,有关TG在DN中的作用机制尚不清楚。本研究通过体外高糖诱导肾小管上皮细胞,并进行不同剂量的TG处理,探讨TG对高糖诱导的肾小管上皮细胞凋亡及CXCL10/CXCR3轴的影响。
1 材料与方法
1.1 材料(1)细胞。人肾小管上皮细胞HK-2(批号SCSP-511)购自上海素尔生物科技有限公司。(2)药品与试剂。雷公藤多苷片(规格10 mg,批号20210611)购自浙江得恩德制药有限公司;DMEM培养基(批号SH30021.01)、胎牛血清(批号SH30072.03)购自美国Hyclone公司;青霉素-链霉素(批号15070063)、胰蛋白酶(批号15050057)购自美国Gibco公司;四甲基偶氮唑盐比色(methyl thiazolyl tetrazolium,MTT)法微量酶反应试剂盒(批号C0009)、Annexin V-Alexa Fluor 488/PI细胞凋亡检测试剂盒(批号CA1040)、活性氧(reactive oxygen species,ROS)检测试剂盒(批号CA1410)、蛋白提取试剂盒(批号P0025)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号S0103)购自上海碧云天生物技术公司;肿瘤 坏 死 因 子(tumor necrosis factor,TNF)-α(批 号SEA133Hu)、转化生长因子(transforming growth factor,TGF)-β1(批号SEA124Hu)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉云克隆科技股份有限公司;兔源胱天蛋白酶(Caspase)-3(批号ab184787)、Caspase-9(批号ab32539)、CXCL10(批号ab14969)、CXCR3(批号ab133420)、GAPDH(批号ab234437)一抗、羊抗兔二抗(ab205718)购自英国Abcam公司。(3)仪器。CP-ST100A型CO2培养箱、SpectraMaxiD5型酶标仪购自长沙长锦科技有限公司;Accuri C6型流式细胞仪购自北京科誉兴业科技发展有限公司;FCK-40C型荧光显微镜购自上海光学仪器厂;WD-9413C型凝胶成像系统购自北京精信达生物科技有限公司。
1.2 研究方法
1.2.1 细胞培养 将HK-2细胞复苏,接种至含有10%胎牛血清、100 U/mL青霉素和100 mg/L链霉素的DMEM培养基中,于37℃、5%CO2培养箱中培养,细胞融合度达到80%左右时进行传代。
1.2.2 细胞分组与处理 以少量DMEM培养基将TG充分溶解,0.45μm滤膜过滤,用DMEM培养基将TG稀释至12.5、25、50 mg/L[8]。收集1.2.1中传至第3代的HK-2细胞,弃原培养基,更换为含5.5 mmol/L葡萄糖的无血清DMEM培养基。培养24 h后,将细胞分为对照组(含5.5 mmol/L葡萄糖培养基)、高糖组(含25 mmol/L葡萄糖培养基)[9]及12.5、25、50 mg/L TG组(分别用12.5、25、50 mg/L的TG和25 mmol/L葡萄糖培养基)[8]。37℃、5%CO2培养箱中继续培养48 h。每组重复6次。
1.2.3 MTT法检测HK-2细胞活性 收集1.2.2中各组HK-2细胞,调整细胞数目为1×106个/孔加至96孔板中,每孔加入20μL MTT溶液,继续培养4 h,每孔加入100μL二甲基亚砜,充分振荡,酶标仪检测各孔570 nm波长处光密度(OD)值,计算细胞活力(%)=(实验组OD值/对照组OD值)×100%。
1.2.4 流式细胞仪检测HK-2细胞凋亡 收集1.2.2中各组HK-2细胞,以不含乙二胺四乙酸的胰蛋白酶消化,1 000 r/min离心10 min,弃原培养液,磷酸盐缓冲液(PBS)重悬细胞,1 000 r/min离心10 min,吸除上清液;用稀释好的缓冲液重悬细胞,调整细胞浓度为1×106个/mL,吸取100μL细胞悬液至流式管中,加入5μL Annexin V-Alexa Fluor 488,混匀,遮光孵育5 min,加入10μL碘化丙锭(PI)溶液,混匀,流式细胞仪观察细胞凋亡。
1.2.5 2’,7’-二氯二氢荧光素二乙酸酯(DCFH-DA)法检测HK-2细胞ROS水平 收集1.2.2中各组HK-2细胞,调整细胞数目为1×105个/mL,按照ROS检测试剂盒说明书,弃去细胞原培养基,更换浓度为5μmol/L的DCFH-DA稀释液,37℃孵育30 min。PBS洗涤细胞3次,流式细胞仪495 nm激发波长和515 nm发射波长评估ROS荧光强度,荧光显微镜观察细胞内ROS荧光图像。
1.2.6 黄嘌呤氧化酶法检测HK-2细胞SOD水平 收集
1.2.2 中各组HK-2细胞,4℃、1 500 r/min离心10 min,弃上清液,超声匀浆,SOD试剂盒检测细胞中SOD水平。
1.2.7 ELISA检测HK-2细胞中炎性因子TNF-α、TGF-β1水平 收集1.2.2中各组HK-2细胞,1 000 r/min离心10 min,收集细胞上清液,ELISA试剂盒检测各组细胞中炎性因子TNFα、TGF-β1水平。
1.2.8 蛋白免疫印迹法检测HK-2细胞中凋亡蛋白(Caspase-3、Caspase-9)和CXCL10/CXCR3轴蛋白表达 收集1.2.2中各组HK-2细胞,调整细胞数目为1×105个/孔加至24孔板中,蛋白提取试剂盒提取细胞总蛋白,定量蛋白浓度后,上样蛋白样品进行电泳,转膜,封闭,分别加入Caspase-3(1∶800)、Caspase-9(1∶800)、CXCL10(1∶800)、CXCR3(1∶800)、GAPDH(1∶1 000)一抗稀释液,4℃孵育过夜,TBST洗膜3次,加入二抗稀释液(1∶2 000),室温孵育1 h,TBST洗膜3次,蛋白凝胶成像系统成像,Image Pro Plus 6.0图像软件分析蛋白条带灰度值,以目的蛋白与内参蛋白灰度值比值作为蛋白相对表达量。
1.3 统计学方法 采用SPSS 25.0进行数据分析,计量资料采用均数±标准差()描述,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组HK-2细胞活力比较 与对照组比较,高糖组HK-2细胞活力降低(P<0.05);与高糖组比较,12.5、25、50 mg/L TG组HK-2细胞活力升高,且随着TG剂量的升高,HK-2细胞活力逐渐升高(P<0.05),见表1。
Tab.1 Comparison of HK-2 cell viability and apoptosis rate between the five groups表1 各组HK-2细胞活力、凋亡率比较(n=6,%)
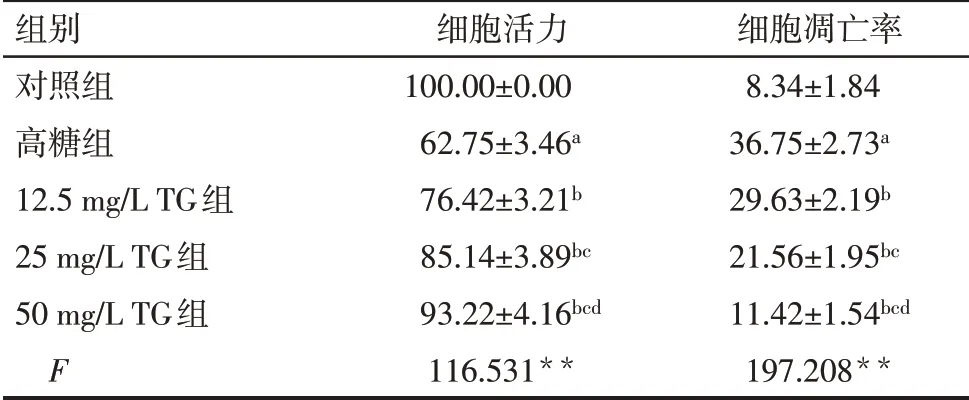
Tab.1 Comparison of HK-2 cell viability and apoptosis rate between the five groups表1 各组HK-2细胞活力、凋亡率比较(n=6,%)
**P<0.01;a与对照组比较,b与高糖组比较,c与12.5 mg/L TG组比较,d与25 mg/L TG组比较,P<0.05。
组别对照组高糖组12.5 mg/L TG组25 mg/L TG组50 mg/L TG组F细胞活力100.00±0.00 62.75±3.46a 76.42±3.21b 85.14±3.89bc 93.22±4.16bcd 116.531**细胞凋亡率8.34±1.84 36.75±2.73a 29.63±2.19b 21.56±1.95bc 11.42±1.54bcd 197.208**
2.2 各组HK-2细胞凋亡率比较 与对照组比较,高糖组HK-2细胞凋亡率升高(P<0.05);与高糖组比较,12.5、25、50 mg/L TG组HK-2细胞凋亡率降低,且随着TG剂量的升高,HK-2细胞凋亡率逐渐降低(P<0.05),见表1、图1。
2.3 各组HK-2细胞ROS、SOD水平比较 与对照组比较,高糖组HK-2细胞ROS水平升高,SOD水平降低(P<0.05);与高糖组比较,12.5、25、50 mg/L TG组HK-2细胞ROS水平降低,SOD水平升高,且随着TG剂量的升高,HK-2细胞ROS水平逐渐降低,SOD水平逐渐升高(P<0.05),见表2、图2。
Tab.2 Comparison of ROS and SOD levels of HK-2 cells between the five groups表2各组HK-2细胞ROS、SOD水平比较(n=6)
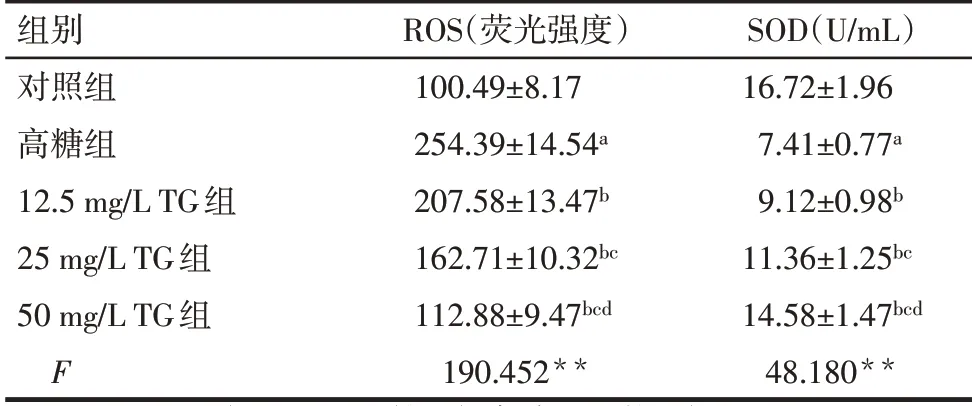
Tab.2 Comparison of ROS and SOD levels of HK-2 cells between the five groups表2各组HK-2细胞ROS、SOD水平比较(n=6)
**P<0.01;a与对照组比较,b与高糖组比较,c与12.5 mg/L TG组比较,d与25 mg/L TG组比较,P<0.05。
组别对照组高糖组12.5 mg/L TG组25 mg/L TG组50 mg/L TG组F ROS(荧光强度)100.49±8.17 254.39±14.54a 207.58±13.47b 162.71±10.32bc 112.88±9.47bcd 190.452**SOD(U/mL)16.72±1.96 7.41±0.77a 9.12±0.98b 11.36±1.25bc 14.58±1.47bcd 48.180**
2.4 各组HK-2细胞炎性因子TNF-α、TGF-β1水平比较 与对照组比较,高糖组HK-2细胞TNF-α、TGF-β1水平升高(P<0.05);与高糖组比较,12.5、25、50 mg/L TG组HK-2细胞TNF-α、TGF-β1水平降低,且随着TG剂量的升高,HK-2细胞TNF-α、TGF-β1水平逐渐降低(P<0.05),见表3。
2.5 各组HK-2细胞凋亡蛋白、CXCL10、CXCR3蛋白表达比较 与对照组比较,高糖组HK-2细胞Caspase-3、Caspase-9、CXCL10、CXCR3蛋白表达升高(P<0.05);与高糖组比较,12.5、25、50 mg/L TG组HK-2细胞Caspase-3、Caspase-9、CXCL10、CXCR3蛋白表达降低,且随着TG剂量的升高,HK-2细胞4种蛋白表达逐渐降低(P<0.05),见表4、图3。
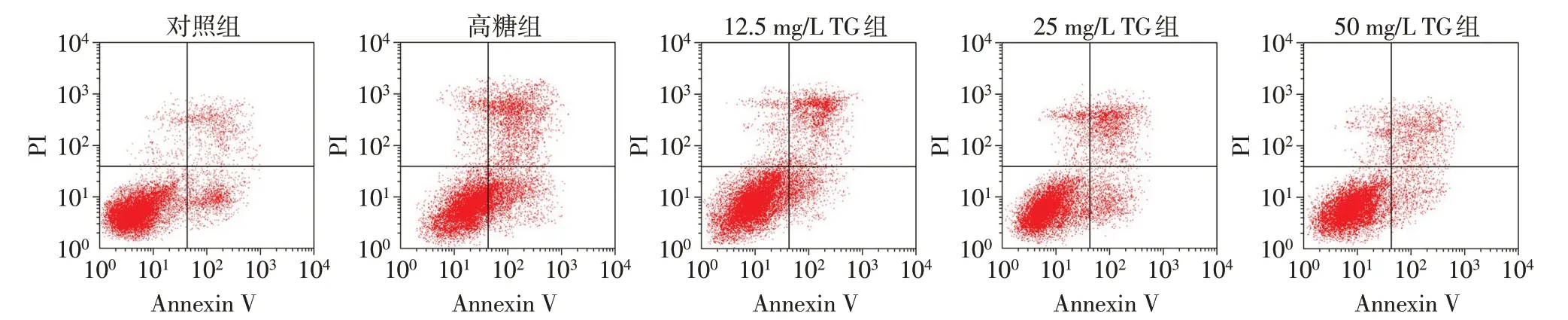
Fig.1 The apoptosis of HK-2 cells in each group detected by flow cytometry图1 流式细胞术检测各组HK-2细胞凋亡
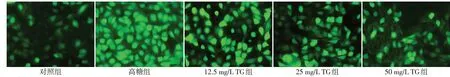
Fig.2 ROS fluorescence image of HK-2 cells observed by fluorescence microscope(×200)图2 荧光显微镜观察HK-2细胞ROS荧光图像(×200)
Tab.3 Comparison of inflammatory factors TNF-αand TGF-β1 levels of HK-2 cells between five groups表3 各组HK-2细胞炎症因子TNF-α、TGF-β1水平比较(n=6,ng/L,)
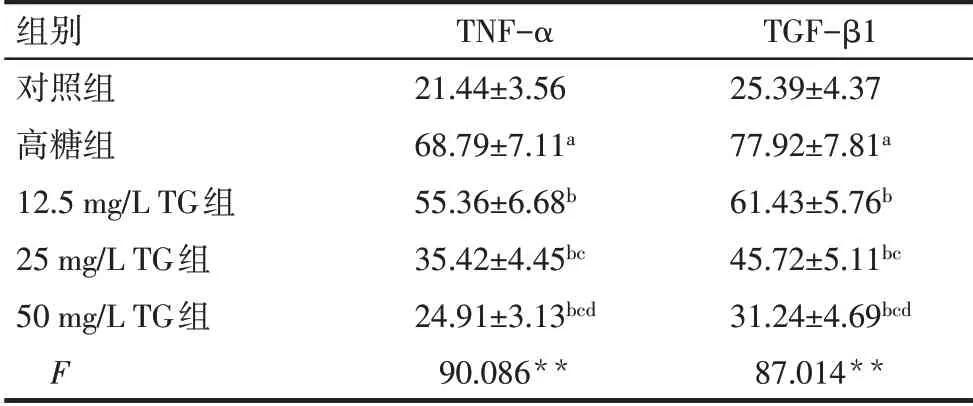
Tab.3 Comparison of inflammatory factors TNF-αand TGF-β1 levels of HK-2 cells between five groups表3 各组HK-2细胞炎症因子TNF-α、TGF-β1水平比较(n=6,ng/L,)
**P<0.01;a与对照组比较,b与高糖组比较,c与12.5 mg/L TG组比较,d与25 mg/L TG组比较,P<0.05。
组别对照组高糖组12.5 mg/L TG组25 mg/L TG组50 mg/L TG组F TNF-α 21.44±3.56 68.79±7.11a 55.36±6.68b 35.42±4.45bc 24.91±3.13bcd 90.086**TGF-β1 25.39±4.37 77.92±7.81a 61.43±5.76b 45.72±5.11bc 31.24±4.69bcd 87.014**
Tab.4 Comparison of protein expressions of Caspase-3,Caspase-9,CXCL10 and CXCR3 in HK-2 cells between the five groups表4 各组HK-2细胞Caspase-3、Caspase-9、CXCL10、CXCR3蛋白表达比较 (n=6)

Tab.4 Comparison of protein expressions of Caspase-3,Caspase-9,CXCL10 and CXCR3 in HK-2 cells between the five groups表4 各组HK-2细胞Caspase-3、Caspase-9、CXCL10、CXCR3蛋白表达比较 (n=6)
**P<0.01;a与对照组比较,b与高糖组比较,c与12.5 mg/L TG组比较,d与25 mg/L TG组比较,P<0.05。
CXCR3 0.19±0.03 0.83±0.11a 0.62±0.09b 0.41±0.07bc 0.24±0.04bcd 77.794**组别对照组高糖组12.5 mg/L TG组25 mg/L TG组50 mg/L TG组F Caspase-3 0.21±0.03 0.73±0.09a 0.58±0.07b 0.39±0.04bc 0.28±0.03bcd 84.457**Caspase-9 0.31±0.04 0.84±0.10a 0.72±0.08b 0.56±0.06bc 0.41±0.05bcd 58.718**CXCL10 0.26±0.03 0.77±0.08a 0.61±0.07b 0.49±0.04bc 0.31±0.03bcd 90.857**
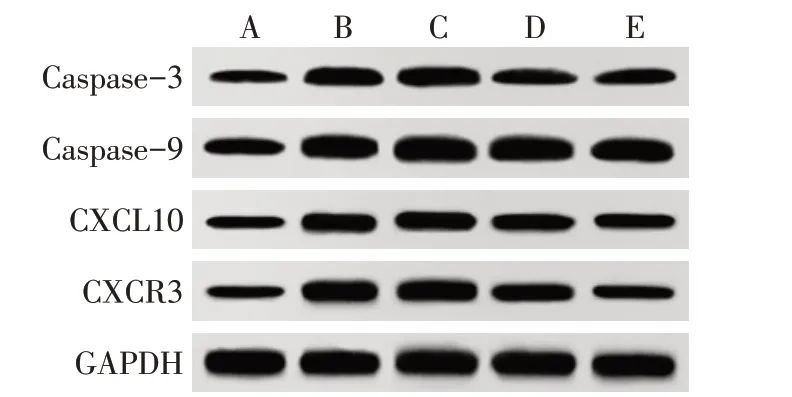
Fig.3 Western blot assay of Caspase-3,Caspase-9,CXCL10 and CXCR3 of HK-2 cells in each group图3 各组HK-2细胞Caspase-3、Caspase-9、CXCL10、CXCR3蛋白印迹图
3 讨论
DN早期主要表现为尿蛋白增多、肾小球病变,弥漫性和结节性系膜扩张和肾小球基底膜增厚是DN患者最显著的病理改变[10]。肾小管上皮细胞是肾小管间质的主要细胞,能够过滤对肾小球有用的物质,肾小管上皮细胞凋亡和损伤会导致肾小球滤过膜功能障碍,从而诱导慢性肾脏病的发生[11]。肾小管细胞损伤过程中涉及氧化应激、炎症和细胞凋亡等过程,高糖环境导致肾脏组织中过量ROS的产生,诱发氧化应激反应,造成线粒体功能障碍,能量代谢不足,引起肾小管细胞凋亡和损伤[12]。本研究结果表明,高糖诱导促进HK-2细胞的凋亡,ROS及炎性因子TNF-α、TGF-β1的产生,抑制SOD水平,与Xie等[13]研究结果相似,提示DN发生与氧化应激、肾小管上皮细胞凋亡以及炎症反应有关,具体机制有待进一步研究。
趋化因子由多种细胞分泌,具有炎症趋化特性,在免疫应答过程中,趋化因子能够趋化活化的T淋巴细胞、单核细胞等,通过G蛋白偶联受体进入炎症损伤区发挥促炎作用[14]。CXCL10由干扰素-γ(IFN-γ)诱导产生,又被称为干扰素-γ-可诱导蛋白10,为1型糖尿病自身免疫破坏的驱动因子。有文献报道,CXCL10的高表达可加速糖尿病发展,CXCR3是CXCL9、CXCL10、CXCL11的共同受体,分布于活化的T细胞、树突状细胞、自然杀伤细胞等多种免疫细胞的表面[15]。Du等[16]研究表明,CXCR3可通过诱导线粒体功能障碍促进非酒精性脂肪性肝病的发生。Li等[17]研究发现,高糖诱导的足细胞中CXCR3表达显著上调,而沉默CXCR3能够抑制高糖诱导的足细胞凋亡以及炎性因子TNF-α和白细胞介素-6(IL-6)的释放。本研究发现,与对照组比较,高糖组CXCL10、CXCR3蛋白表达升高,提示CXCL10/CXCR3轴可能与DN发生有关。
TG是一种植物免疫抑制剂,对DN、免疫球蛋白(Ig)A肾病具有一定的疗效[6]。杨忠民等[18]研究表明,TG能够改善IgA肾病大鼠肾功能,减轻大鼠肾组织病理损伤。Wu等[19]研究表明,TG能够抑制DN大鼠肾小球巨噬细胞浸润,抑制TNF-α、TGF-β1等炎性因子的过表达,改善大鼠肾小球硬化。本研究结果表明,TG能够抑制高糖诱导的HK-12细胞的凋亡及凋亡蛋白Caspase-3、Caspase-9的表达,并抑制细胞内ROS、TNF-α和TGF-β1的产生,增加细胞中SOD水平,提示TG可能通过抑制肾小管上皮细胞凋亡在DN治疗中发挥作用,推测可能是TG抑制了高糖诱导的氧化应激和炎症反应,进而抑制HK-12细胞的凋亡,具体机制有待进一步研究。杜颖等[20]研究表明,TG联合异甘草酸镁治疗能够降低自身免疫性肝炎患儿血清CXCL10的水平,减轻机体炎症反应。本研究进一步发现TG组HK-2细胞CXCL10、CXCR3蛋白表达低于高糖组,提示TG尤其是高剂量TG能够抑制高糖诱导的HK-2细胞中CXCL10/CXCR3轴的活性,这可能是TG抑制HK-2细胞凋亡及治疗DN的机制。
综上所述,TG可抑制高糖诱导的HK-2细胞凋亡、氧化应激和炎症反应,其机制可能与抑制CXCL10/CXCR3轴有关,这可能是TG治疗DN的机制。然而,本研究仅从体外水平分析了TG对CXCL10/CXCR3轴和HK-2细胞的影响,下一步需结合体内实验进一步分析TG与DN发生过程中CXCL10/CXCR3轴和肾小管上皮细胞凋亡的关系。

