LncRNA OIP5-AS1调节miR-25-3p/SOX4轴对高糖诱导的人肾小管上皮细胞生物学过程的影响
杨娟,张厚芬,吴松,陈莹,罗华荣
糖尿病肾病(DKD)是一种严重的慢性糖尿病并发症[1]。肾小管细胞损伤是DKD的主要特征之一[2]。研究表明,高血糖可产生过量活性氧(ROS),促进肾细胞氧化应激,导致肾小管上皮细胞凋亡增加,肾小管损伤[3-4]。长链非编码RNA(lncRNA)Opa相互作用蛋白5-反义转录物1(OIP5-AS1)是肿瘤生长和进展的关键调节因子[5-6]。研究显示,lncRNA OIP5-AS1与糖尿病相关疾病如妊娠期糖尿病[7]、糖尿病心肌病[8]、糖尿病性视网膜病变[9]的发生和发展相关。在DKD小鼠肾组织和高糖刺激的人肾皮质近曲小管上皮HK-2细胞中,lncRNA OIP5-AS1表达增加,可诱导上皮间质转化和肾纤维化[10]。然而,其在DKD中的作用机制仍未阐明。lncRNA可作为miRNA的竞争性内源性RNA充当miRNA海绵来调节基因表达。研究证实lncRNA OIP5-AS1可靶向调节miR-25-3p[11]。miR-25-3p在DKD中下调,可作为DKD的生物标志物和治疗靶点[12]。性别决定区Y框蛋白4(SOX4)是一种糖尿病易感基因,也是miR-25-3p的下游靶标[13],其高表达与糖尿病风险呈正相关[14-15]。然而,lncRNA OIP5-AS1、miR-25-3p和SOX4在DKD进展中的关系尚不明确。本研究旨在探讨lncRNA OIP5-AS1能否通过miR-25-3p/SOX4轴调节高糖诱导的肾小管上皮细胞损伤。
1 材料与方法
1.1 材料 HK-2细胞购自武汉普诺赛生命科技有限公司。Lipofectamine 3000转染试剂购自Sigma-Aldrich;miR-25-3p模拟物(miR-25-3p mimic)、miR-25-3p抑制剂(miR-25-3p inhibitor)、阴性对照(miR-NC、inhibitor-NC),lncRNA OIP5-AS1小干扰RNA(si-OIP5-AS1)及其阴性对照(si-NC)均由上海GenePharma合成;胎牛血清(FBS)、CCK-8试剂盒、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒、乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;Trizol、PrimeScript RT试剂盒、SYBR®Premix Ex TaqTM试剂盒均购自日本TaKaRa公司;ROS检测试剂盒(DCFH-DA荧光探针法)购自北京索莱宝科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)试剂盒购自南京建成生物工程研究所;兔源胱天蛋白酶-3(Caspase-3)、裂解的Caspase-3(Cleaved-Caspase-3)一抗购自美国Cell Signaling Technology公司;兔源B细胞淋巴瘤因子2(Bcl-2)、Bcl-2相关X蛋白(Bax)、SOX4和GAPDH一抗购自美国Thermo Fisher Scientific公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自英国Abcam公司。HERAcell 240i CO2细胞培养箱(美国Thermo Fisher Scientific公司);IX73倒置荧光显微镜(日本Olympus公司);iMark680多功能酶标仪(美国Bio-Rad公司);DeNovix DS-11分光光度计(美国DeNovix公司);Mx3005P实时荧光定量PCR(qPCR)仪(美国Stratagene公司)。
1.2 方法
1.2.1 细胞培养及转染 HK-2细胞用含10%FBS和1%青霉素-链霉素的DMEM培养基在37℃、5%CO2培养箱中培养。当细胞达到80%融合后,将HK-2细胞暴露于含有5.5 mmol/L葡萄糖(正常葡萄糖组,NG组)或30 mmol/L葡萄糖(高糖组,HG组)的无血清DMEM培养基中处理48 h[16]。预实验采用绿色荧光蛋白标记的转染试剂对HK-2细胞进行转染,转染48 h后在荧光显微镜下观察转染效率,结果显示各组转染效率为70%~80%。将HK-2细胞以1×105个/孔的密度接种到6孔板中,并在含30 mmol/L葡萄糖的DMEM培养基中培养。分为NG组、HG组、HG+si-NC组(转染si-NC)、HG+si-OIP5-AS1组(转染si-OIP5-AS1)、HG+miR-NC组(用miR-NC转染)、HG+miR-25-3p组(用miR-25-3p mimic转染)、HG+si-OIP5-AS1+inhibitor-NC组(转染si-OIP5-AS1和inhibitor-NC)、HG+si-OIP5-AS1+miR-25-3p inhibitor组(转染si-OIP5-AS1和miR-25-3p inhibitor)。使用Lipofectamine 3000试剂进行转染,48 h后评估转染效率,收集细胞并进行相关检测。
1.2.2 qPCR检测细胞中lncRNA OIP5-AS1、miR-25-3p和SOX4 mRNA 使用Trizol试剂提取细胞总RNA,逆转录试剂盒将RNA反转录为cDNA,并通过SYBR®Premix Ex TaqTM试剂盒在Mx3005P RT-qPCR仪上进行qPCR反应。反应体系(20μL):cDNA 2μL,SYBR®Premix Ex TaqTM(2×)10μL,上、下游引物各0.4μL,ddH2O 7.2μL。反应条件:95℃预变性5 min;95℃变性10 s,60℃退火20 s,72℃延伸10 s,40个循环。使用GAPDH(lncRNA OIP5-AS1和SOX4)和U6(miR-25-3p)作为内部参考,2-ΔΔCt法计算目的基因的相对表达水平。引物及序列见表1。
1.2.3 CCK-8法检测细胞活力 将各组HK-2细胞以2×104个/mL的密度接种在96孔板中,每孔100μL。将细胞在新鲜培养基中培养48 h后,每孔加入CCK-8溶液10μL,并在37℃、5%CO2培养箱中孵育2 h。使用酶标仪测量450 nm处的光密度(OD)值,计算细胞活力。
1.2.4 LDH活性测定 收集10μL细胞培养上清液,通过LDH细胞毒性测定试剂盒检测LDH释放,使用酶标仪在490 nm处测量吸光度,计算LDH活性。

Tab.1 Primer sequences for qPCR表1 qPCR的引物序列
1.2.5 流式细胞术分析细胞凋亡情况 将HK-2细胞用胰蛋白酶消化,收集细胞,用冷PBS洗涤2次,并与200μL 1×binding buffer(包含5μL Annexin V-FITC和5μL PI)在黑暗中孵育15 min,使用流式细胞仪分析细胞凋亡情况。
1.2.6 MDA水平和SOD、CAT活性检测 使用细胞裂解液裂解HK-2细胞,提取蛋白质用于硫代巴比妥酸法检测MDA水平,水溶性四唑盐-1(WST-1)法检测SOD,紫外吸收法检测CAT活性。MDA、SOD和CAT分别用酶标仪在532、520和240 nm波长下测定。
1.2.7 DCFH-DA荧光探针检测细胞内ROS 将HK-2细胞用含有终浓度为10μmol/L DCFH-DA荧光探针的培养基,在37℃、5%CO2培养箱中避光孵育30 min。将细胞在4℃下用4%多聚甲醛固定10 min,荧光显微镜下观察染色细胞,并于485 nm激发和538 nm发射波长测量荧光强度。每组平均荧光强度与对照组的比值代表ROS水平。
1.2.8 Western blot检测细胞中SOX4、Bcl-2、Bax、Cleaved-Caspase-3和Caspase-3蛋白表达 用RIPA裂解液裂解细胞以提取蛋白质,然后通过二辛可宁酸测定法测定蛋白质浓度。将总蛋白(每泳道50μg)加载到10%SDS-PAGE中进行电泳分析,然后将蛋白转移到PVDF膜上。将膜用5%脱脂奶粉封闭1 h,然后与兔抗人SOX4(1∶1 000)、Bcl-2(1∶500)、Caspase-3(1∶500)、Cleaved-Caspase-3(1∶500)、Bax(1∶500)和GAPDH(1∶2 000)在4℃下孵育过夜。随后,将膜与HRP偶联的山羊抗兔lgG二抗(1∶2 000)在室温下孵育1 h。通过增强化学发光(ECL)系统观察膜上的蛋白质条带,并使用Image J软件进行分析。以GAPDH为内参蛋白,通过与内参的灰度比,得出目的蛋白的相对表达水平。
1.2.9 双荧光素酶报告基因实验 使用StarBase v2.0数据库(https://starbase.sysu.edu.cn/index.php)预测miR-25-3p与lncRNA OIP5-AS1和SOX4的结合位点;进行双荧光素酶报告基因测定确认lncRNA OIP5-AS1和miR-25-3p之间的结合,以及miR-25-3p和SOX4之间的结合。将含有miR-25-3p结合序列的lncRNA OIP5-AS1或SOX4的野生型(WT)和突变型(MUT)片段扩增并亚克隆到pGL4.10荧光素酶报告载体中,以构建新的荧光素酶载体(WT-OIP5-AS1、MUTOIP5-AS1、WT-SOX4和MUT-SOX4)。取HK-2细胞接种于24孔板(1×105个/孔)中,并在转染前培养至80%汇合。使用Lipofectamine 3000将miR-25-3p mimic或miR-NC和上述重组荧光素酶载体共转染到HK-2细胞中。转染48 h后,使用双荧光素酶报告基因检测系统测量转染细胞裂解物中的萤火虫和海肾荧光素酶活性。萤火虫荧光素酶活性被标准化为海肾荧光素酶活性。
1.3 统计学方法 采用GraphPad Prism 8.0软件进行数据分析。计量数据均符合正态分布,以均数±标准差()表示。多组间比较采用单因素方差分析,组间多重比较用SNK-q法。所有实验重复3次。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞中lncRNA OIP5-AS1、miR-25-3p和SOX4 mRNA水平比较 与NG组相比,HG组lncRNA OIP5-AS1和SOX4 mRNA水平升高,miR-25-3p水平降低(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组lncRNA OIP5-AS1和SOX4 mRNA水平降低,miR-25-3p水平升高(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组miR-25-3p水平升高,SOX4 mRNA水平降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组miR-25-3p水平降低,SOX4 mRNA水平升高(P<0.05),见表2。
Tab.2 Comparison of lncRNA OIP5-AS1,miR-25-3p and SOX4 mRNA levels between the eight groups表2各组lncRNA OIP5-AS1、miR-25-3p和SOX4 mRNA水平比较 (n=3,)
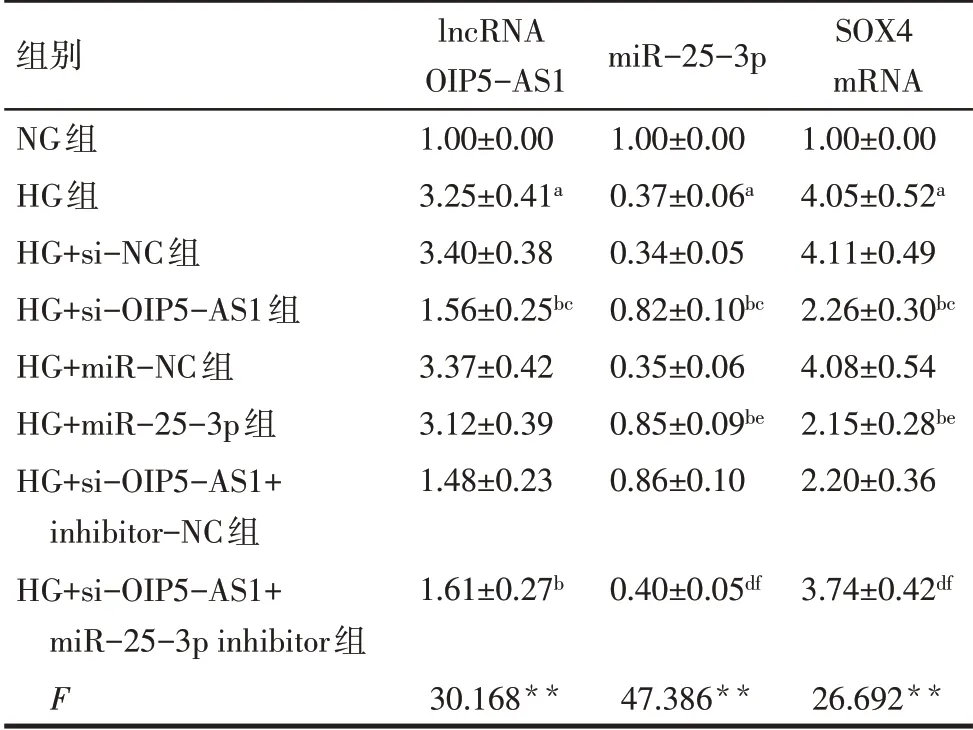
Tab.2 Comparison of lncRNA OIP5-AS1,miR-25-3p and SOX4 mRNA levels between the eight groups表2各组lncRNA OIP5-AS1、miR-25-3p和SOX4 mRNA水平比较 (n=3,)
**P<0.01;a与NG组相比,b与HG组相比,c与HG+si-NC组相比,d与HG+si-OIP5-AS1组相比,e与HG+miR-NC组相比,f与HG+si-OIP5-AS1+inhibitor-NC组相比,P<0.05;表3~6同。
组别NG组HG组HG+si-NC组HG+si-OIP5-AS1组HG+miR-NC组HG+miR-25-3p组HG+si-OIP5-AS1+inhibitor-NC组HG+si-OIP5-AS1+miR-25-3p inhibitor组F lncRNA OIP5-AS1 1.00±0.00 3.25±0.41a 3.40±0.38 1.56±0.25bc 3.37±0.42 3.12±0.39 1.48±0.23 miR-25-3p 1.00±0.00 0.37±0.06a 0.34±0.05 0.82±0.10bc 0.35±0.06 0.85±0.09be 0.86±0.10 SOX4 mRNA 1.00±0.00 4.05±0.52a 4.11±0.49 2.26±0.30bc 4.08±0.54 2.15±0.28be 2.20±0.36 1.61±0.27b 0.40±0.05df 3.74±0.42df 30.168**47.386**26.692**
2.2 各组细胞活力和LDH活性比较 与NG组相比,HG组细胞活力降低,LDH活性升高(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组细胞活力升高,LDH活性降低(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组细胞活力升高,LDH活性降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组细胞活力降低,LDH活性升高(P<0.05),见表3。
Tab.3 Comparison of cell viability,LDH activity and apoptosis rate between the eight groups表3 各组细胞活力、LDH活性和凋亡率比较(n=3
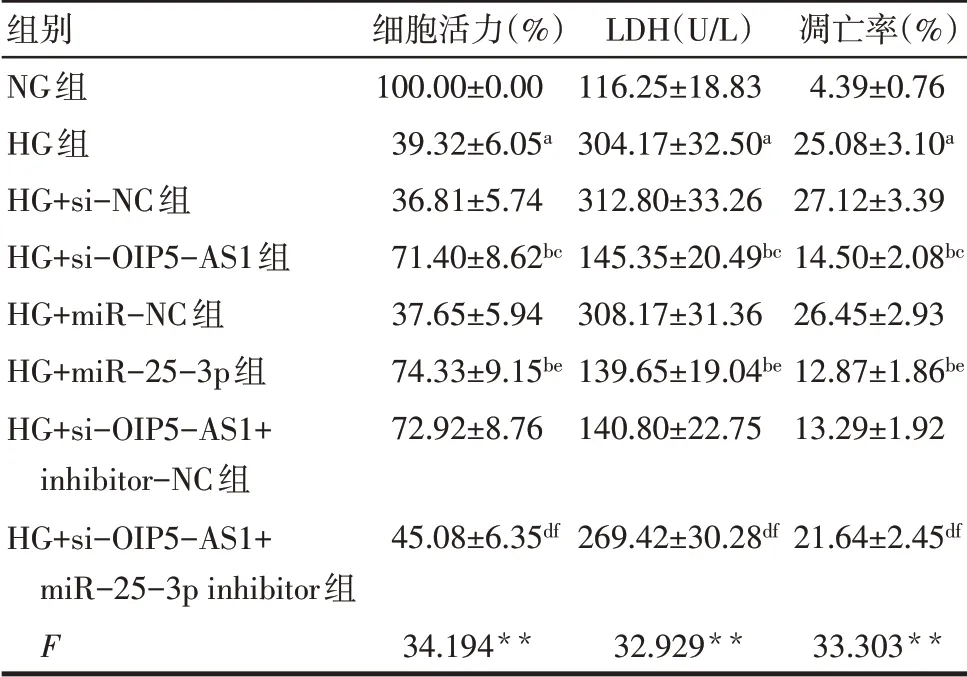
Tab.3 Comparison of cell viability,LDH activity and apoptosis rate between the eight groups表3 各组细胞活力、LDH活性和凋亡率比较(n=3
组别NG组HG组HG+si-NC组HG+si-OIP5-AS1组HG+miR-NC组HG+miR-25-3p组HG+si-OIP5-AS1+inhibitor-NC组HG+si-OIP5-AS1+miR-25-3p inhibitor组F细胞活力(%)100.00±0.00 39.32±6.05a 36.81±5.74 71.40±8.62bc 37.65±5.94 74.33±9.15be 72.92±8.76 LDH(U/L)116.25±18.83 304.17±32.50a 312.80±33.26 145.35±20.49bc 308.17±31.36 139.65±19.04be 140.80±22.75凋亡率(%)4.39±0.76 25.08±3.10a 27.12±3.39 14.50±2.08bc 26.45±2.93 12.87±1.86be 13.29±1.92 45.08±6.35df 269.42±30.28df 21.64±2.45df 34.194**32.929**33.303**
2.3 各组细胞凋亡率比较 与NG组相比,HG组细胞凋亡率升高(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组细胞凋亡率降低(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组细胞凋亡率降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组细胞凋亡率升高(P<0.05),见表3、图1。
2.4 各组MDA水平和SOD、CAT活性比较 与NG组相比,HG组SOD和CAT活性降低,MDA水平升高(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组SOD和CAT活性显著升高,MDA水平降低(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组SOD和CAT活性显著升高,MDA水平降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组SOD和CAT活性显著降低,MDA水平升高(P<0.05),见表4。
2.5 各组细胞中ROS水平比较 与NG组相比,HG组细胞内ROS水平升高(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组细胞内ROS水平降低(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组细胞内ROS水平降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组细胞内ROS水平升高(P<0.05),见表4、图2。

Fig.1 Flow cytometry detection of apoptosis levels in each group图1 流式细胞术检测各组细胞凋亡水平
Tab.4 Comparison of MDA,ROS,SOD and CAT activities between the eight groups of cells表4各组细胞中MDA、ROS水平和SOD、CAT活性比较 (n=3
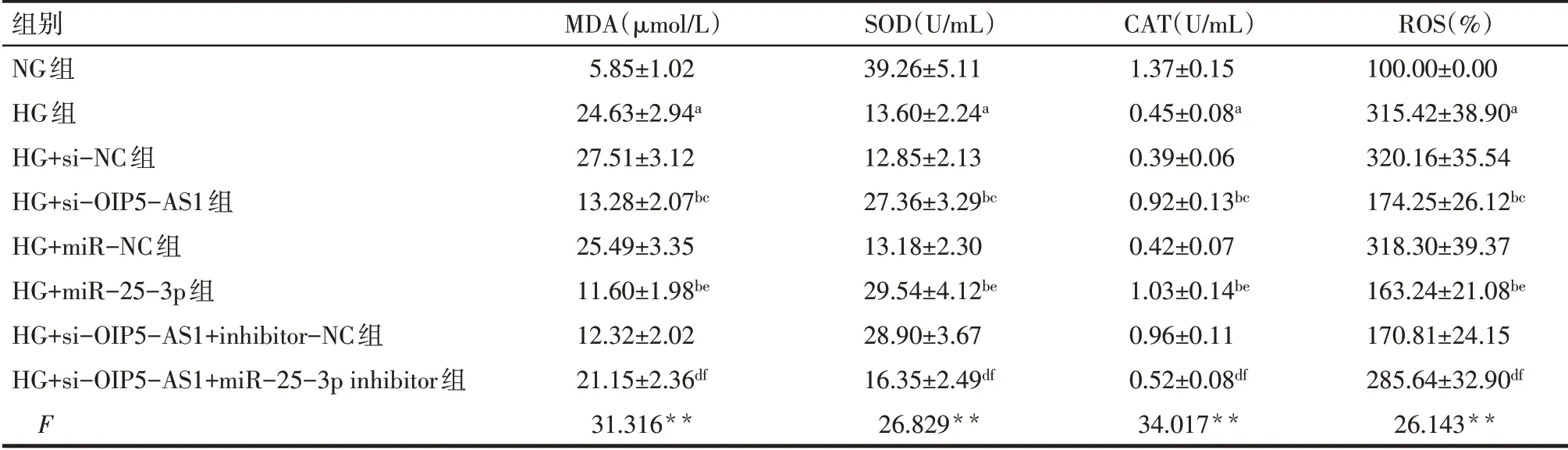
Tab.4 Comparison of MDA,ROS,SOD and CAT activities between the eight groups of cells表4各组细胞中MDA、ROS水平和SOD、CAT活性比较 (n=3
组别NG组HG组HG+si-NC组HG+si-OIP5-AS1组HG+miR-NC组HG+miR-25-3p组HG+si-OIP5-AS1+inhibitor-NC组HG+si-OIP5-AS1+miR-25-3p inhibitor组F MDA(μmol/L)5.85±1.02 24.63±2.94a 27.51±3.12 13.28±2.07bc 25.49±3.35 11.60±1.98be 12.32±2.02 21.15±2.36df 31.316**SOD(U/mL)39.26±5.11 13.60±2.24a 12.85±2.13 27.36±3.29bc 13.18±2.30 29.54±4.12be 28.90±3.67 16.35±2.49df 26.829**CAT(U/mL)1.37±0.15 0.45±0.08a 0.39±0.06 0.92±0.13bc 0.42±0.07 1.03±0.14be 0.96±0.11 0.52±0.08df 34.017**ROS(%)100.00±0.00 315.42±38.90a 320.16±35.54 174.25±26.12bc 318.30±39.37 163.24±21.08be 170.81±24.15 285.64±32.90df 26.143**
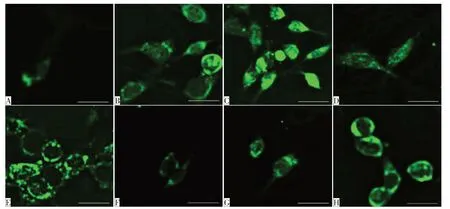
Fig.2 Cellular ROS levels in each group(DCFH-DA,bar scale=20μm)图2 各组细胞ROS水平(DCFH-DA,比例尺=20μm)
2.6 各组中SOX4、Bcl-2、Bax、Cleaved-Caspase-3和Caspase-3蛋白水平比较 与NG组相比,HG组Bcl-2蛋白水平降低,SOX4、Bax蛋白水平和Cleaved-Caspase-3/Caspase-3比值升高(P<0.05);与HG组、HG+si-NC组相比,HG+si-OIP5-AS1组Bcl-2蛋白水平升高,SOX4、Bax蛋白水平和Cleaved-Caspase-3/Caspase-3比值降低(P<0.05);与HG组、HG+miR-NC组相比,HG+miR-25-3p组Bcl-2蛋白水平升高,SOX4、Bax蛋白水平和Cleaved-Caspase-3/Caspase-3比值降低(P<0.05);与HG+si-OIP5-AS1组、HG+si-OIP5-AS1+inhibitor-NC组相比,HG+si-OIP5-AS1+miR-25-3p inhibitor组Bcl-2蛋白水平降低,SOX4、Bax蛋白水平和Cleaved-Caspase-3/Caspase-3比值升高(P<0.05),见图3、表5。
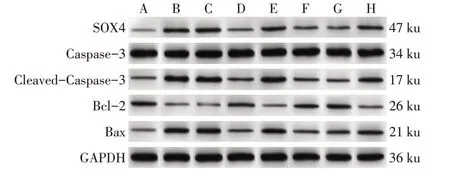
Fig.3 Expression levels of SOX4,Caspase-3,Cleaved-Caspase-3,Bcl-2 and Bax in each group of cells图3 各组细胞中SOX4、Caspase-3、Cleaved-Caspase-3、Bcl-2、Bax蛋白表达
2.7 双荧光素酶报告基因检测结果 使用Starbase v2.0数据库预测到miR-25-3p包含lncRNA OIP5-AS1的结合位点,见图4A。双荧光素酶报告基因检测结果显示,与转染miR-NC相比,转染miR-25-3p mimic后,含有WT-OIP5-AS1质粒细胞的荧光素酶活性显著降低(t=13.362,P<0.01),而含有MUTOIP5-AS1质粒细胞的荧光素酶活性未受影响(t=0.106,P>0.05),见图4B。使用Starbase v2.0数据库预测到miR-25-3p包含SOX4的结合位点,见图4C。双荧光素酶报告基因检测结果显示,与转染miRNC相比,转染miR-25-3p mimic后,含有WT-SOX4质粒细胞的荧光素酶活性显著降低(t=18.706,P<0.01),而含有MUT-SOX4质粒细胞的荧光素酶活性未受影响(t=0.350,P>0.05),见图4D。

Fig.4 Target gene prediction and luciferase activity in cells图4 靶基因预测和细胞中的荧光素酶活性
Tab.5 Comparison of protein levels of SOX4,Caspase-3,Cleaved-Caspase-3,Bcl-2 and Bax between the eight groups of cells表5 各组细胞中SOX4、Caspase-3、Cleaved-Caspase-3、Bcl-2、Bax蛋白水平比较 (n=3)

Tab.5 Comparison of protein levels of SOX4,Caspase-3,Cleaved-Caspase-3,Bcl-2 and Bax between the eight groups of cells表5 各组细胞中SOX4、Caspase-3、Cleaved-Caspase-3、Bcl-2、Bax蛋白水平比较 (n=3)
组别NG组HG组HG+si-NC组HG+si-OIP5-AS1组HG+miR-NC组HG+miR-25-3p组HG+si-OIP5-AS1+inhibitor-NC组HG+si-OIP5-AS1+miR-25-3p inhibitor组F SOX4 0.13±0.02 0.50±0.06a 0.54±0.07 0.23±0.04bc 0.52±0.06 0.20±0.03be 0.21±0.04 0.45±0.05df 36.323**Cleaved-Caspase-3/Caspase-3 0.20±0.04 0.72±0.08a 0.75±0.09 0.34±0.05bc 0.73±0.08 0.30±0.05be 0.32±0.04 0.65±0.07df 37.743**Bcl-2 0.48±0.06 0.16±0.03a 0.13±0.02 0.37±0.05bc 0.15±0.02 0.40±0.04be 0.39±0.05 0.21±0.03df 35.622**Bax 0.15±0.02 0.63±0.07a 0.65±0.08 0.28±0.04bc 0.64±0.07 0.25±0.04be 0.27±0.04 0.56±0.06df 42.279**
3 讨论
DKD是一种高血糖驱动的以肾小管上皮细胞氧化应激和凋亡为特征的疾病[3-4]。DKD常导致肾功能衰竭,但目前尚无有效的治疗方法,因此,寻找新的DKD治疗靶点至关重要。氧化应激、细胞凋亡是参与DKD高血糖损伤的重要机制[17]。持续的高血糖可导致ROS的产生增加,内源性抗氧化剂无法将其完全清除,导致MDA产生和细胞损伤[3-4]。SOD和CAT作为重要的抗氧化防御系统,在DKD中的表达降低[18]。此外,Bcl-2是细胞凋亡抑制因子,Bax不仅拮抗Bcl-2的抑制凋亡作用,而且具有促进细胞凋亡的功能[19]。Caspase-3是细胞凋亡的主要执行者,通常以非活性形式(酶原)存在于细胞质中。Cleaved-Caspase-3是Caspase-3的活化形式,Caspase-3一旦被激活,能将细胞内的蛋白质降解,使细胞不可逆地走向死亡[20]。Chen等[4]研究证实,将HK-2细胞与30 mmol/L葡萄糖孵育,可有效模拟氧化应激引起的肾损伤。在本研究中,在高糖诱导的HK-2细胞培养上清液中LDH活性、细胞凋亡增加,MDA和Bax蛋白水平、Cleaved-Caspase-3/Caspase-3比值升高,SOD、CAT活性和Bcl-2蛋白水平降低,表明细胞活力降低和氧化应激增强,导致细胞凋亡增加,因此靶向氧化应激有望对抗DKD肾小管上皮损伤。
lncRNA OIP5-AS1可调节多种生理功能,研究证明其与DKD等糖尿病相关疾病的进展有关[7-10]。本研究使用高糖诱导HK-2细胞损伤模型,发现lncRNA OIP5-AS1的表达水平显著高于正常葡萄糖组,而miR-25-3p水平显著降低。采用小分子干扰技术敲低lncRNA OIP5-AS1表达后,miR-25-3p水平升高,同时细胞活力和抗氧化能力增强,且高糖诱导的HK-2细胞凋亡和ROS产生减少,表明敲低lncRNA OIP5-AS1对高糖诱导的HK-2细胞损伤具有保护作用;过表达miR-25-3p对高糖诱导的HK-2细胞损伤的影响与敲低lncRNA OIP5-AS1的作用一致。Fu等[10]发现,lncRNA OIP5-AS1在高糖刺激的HK-2细胞中负调控miR-30c-5p的表达。Gholaminejad等[12]发现,miR-25-3p在DKD中下调。这些研究表明lncRNA OIP5-AS1、miR-25-3p可能通过某种途径影响DKD的进展。
lncRNA与miRNA、mRNA之间的相互调控已成为近年来生物信息学研究的热点之一。有研究报道,miRNA通过与靶mRNA的特异性碱基配对可以沉默mRNA的表达,然后lncRNA可以作为竞争性内源性RNA与miRNA结合,进一步参与mRNA表达的调控[21-22]。本研究中,lncRNA OIP5-AS1在高糖诱导的HK-2细胞中呈高表达,而miR-25-3p的表达降低,这与既往研究结果相似[10,12]。因此,推测lncRNA OIP5-AS1可能通过特定位点与miR-25-3p结合来降低其表达水平。笔者检索StarBase数据库发现在lncRNA OIP5-AS1的3′非编码区(3′-UTR)存在与miR-25-3p的结合位点。为了验证此推测,本研究在使用si-OIP5-AS1质粒转染敲低lncRNA OIP5-AS1表达的同时,将miR-25-3p inhibitor也转染至HK-2细胞,结果显示,下调miR-25-3p可明显减弱敲低lncRNA OIP5-AS1对高糖诱导的HK-2细胞氧化应激损伤的保护作用;且双荧光素酶报告基因检测结果证实lncRNA OIP5-AS1是靶向miR-25-3p的调节分子,提示lncRNA OIP5-AS1可能通过靶向抑制miR-25-3p的表达,影响高糖诱导的HK-2细胞的氧化应激和凋亡。
为研究miR-25-3p参与调控高糖诱导的HK-2细胞损伤的分子机制,本研究采用生物信息学方法对miR-25-3p的靶基因进行深入分析,结果表明SOX4的3′-UTR可以与miR-25-3p相互作用。SOX4属于SOX转录因子家族。Yang等[23]研究显示,高糖可上调视网膜色素上皮细胞中SOX4水平,下调其表达可抑制糖尿病性视网膜病变。本研究结果显示,在高糖诱导的HK-2细胞损伤模型中,SOX4 mRNA和蛋白水平均升高,敲低lncRNA OIP5-AS1表达和上调miR-25-3p的表达时均发现SOX4表达降低;而且在敲低lncRNA OIP5-AS1的基础上,利用miR-25-3p inhibitor下调miR-25-3p后,SOX4的表达水平较lncRNA OIP5-AS1敲低组明显升高。双荧光素酶报告基因检测结果表明,miR-25-3p mimic可以抑制WT-SOX4载体的荧光素酶活性,而对MUT-SOX4载体的荧光素酶活性没有影响,提示miR-25-3p可靶向调节SOX4,miR-25-3p对高糖诱导的HK-2细胞损伤的调控作用可能与靶向调节SOX4表达有关。
综上所述,lncRNA OIP5-AS1敲低可抑制高糖处理肾小管上皮细胞的凋亡和氧化应激,增加细胞活力,lncRNA OIP5-AS1可能通过miR-25-3p/SOX4轴促进高糖诱导的HK-2细胞损伤。在未来的研究中,将分析lncRNA OIP5-AS1在DKD动物模型中的功能,进一步明确lncRNA OIP5-AS1在DKD中的调控机制。此外,lncRNA OIP5-AS1在DKD患者临床标本中的表达谱也是未来研究的重点,将有助于阐明lncRNA OIP5-AS1在临床DKD诊断与治疗中的应用价值。

