磷石膏载氧体的褐煤化学链气化数值模拟*
杨 杰,谭 刚,刘海鲨,王文川,李晓玲,牟亮宇,刘盛余,马丽萍
(1 成都信息工程大学资源环境学院,四川 成都 610225;2 四川省固体废物与化学品管理中心,四川 成都 610032;3 昆明理工大学环境科学与工程学院,云南 昆明 650500)
化学链燃烧(Chemical-Looping Combustion,简称CLC)是由德国科学家Richter和Knoche[1]于1983年美国化学学会(ACS)首次提出,其目的是为了降低热电厂气体燃烧过程中产生的熵变,提高能源使用效率。近年来,越来越多的研究人员开始关注固体燃料的化学链转化过程,化学链气化技术(Chemical-Looping Gasification,CLG)为CLC技术拓展技术开始得到应用。CLG与CLC不同的是化学链气化利用氧载体中的氧与燃料反应,通过控制载氧体与燃料的比值,反应温度等条件得到以CO和H2为主要组分的合成气,而避免燃料被完全氧化生成CO2和H2O[2-4]。CLG技术使得固体燃料能够在载氧体的作用下发生部分氧化反应生成合成气[3],一方面可以显著降低生产合成气成本;另外一方面,极大的提高了合成气的气化效率。氧载体的性能对CLG过程也是非常重要,磷石膏(主要成分CaSO4·2H2O)不管在氧化反应还是还原反应中都具备良好的热力学特征且环境友好,经济可行。将其用作载氧体不仅有利于环境的发展而且将“废物”转化为“宝”。本研究中,Fasctsage 6.4中的Reaction模块和Equilibrium模块被用来数值模拟以磷石膏作为载氧体发生的褐煤化学链气化过程。
1 模块建立
通过改变条件利用Factsage 6.4中Equilibrium模块对反应的产物种类及其产物量进行计算;
对反应过程的猜想的反应原理,利用Factsage 6.4中Reaction对反应的焓变,熵变以及反应常数进行考察,验证反应原理。
2 应原理研究
Liping Ma和牛学奎和郑绍聪等[5-7]研究者发现磷石膏的自分解温度开始为950 ℃结束为1 200 ℃,李爱蓉[8]研究发现褐煤的分解温度为300 ℃开始600 ℃终止,在YanBei[9]和Liping Ma[10]中可知道高硫煤还原磷石膏属于气-固反应和固-固反应。因此,磷石膏的褐煤化学链气化过程可以看成是:在低温条件下,褐煤先分解,然后分解产物再与磷石膏反应。

表1 褐煤的组分分析数据
经计算1 mol褐煤的分子式可以表示为:C5.2H4.36O4.26N0.096S0.034,1 mol的褐煤的分解产物其中固体为焦碳,气体主要包括:H2、CO、CH4。褐煤分解其结果如同王亚峰[11]在高温常压固定床M JF-II型反应器中实验结果相同。

图1 褐煤分解的气体产物
以磷石膏(CaSO4·2H2O)为载氧体的褐煤化学链气化,燃料反应器内主要发生如下反应[12-17]:
C5.2H4.36O4.26N0.096S0.034→1.049 2C(s)+2.073 8H2(g)+4.060 9CO(g)+0.013 186CH4(g)+0.031 969H2S(g)+0.047 98N2(g)+other substances
(R1)
(R2)

(R3)

(R4)
还原载氧体:

(R5)

(R6)
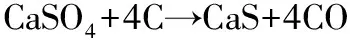
(R7)
通过分析反应的Gibbs自由能变化 ΔH 和反应平衡常数Kep,有助于理解燃料反应器内的化学反应机理[18-19]。
平衡常数的大小,来对各个反应进行的程度进行比较,根据标准常数Gibbs自由能的变换,反应平衡常数Kep与温度T的关系为:
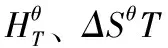
对于化学平衡体系的组分计算,Gibbs最小自由能法建立平衡模型。最小自由能法的主要原理为:对于某一热化学反应体系,在恒温、恒压以及不做非膨胀功的条件下,其自发化学反应过程是向着自由能减小的方向进行的;当自由能达到极小值时,化学反应体系达到平衡状态[21]。
通过Factsage 6.4中的Reaction模块可以的到温度与焓变,反应常数的关系。
通过图2可以看出在温度较低的情况下C与CaSO4的反应常数非常的低,而在温度逐渐增高的时候反应常数增加。这说明在温度较低的时候C与CaSO4不易反应,在高温时有利于反应。对于CO和H2与CaSO4的反应常数都是随着温度的增高反应常数降低。在R5~R7的三个反应式中,在温度较高的时候R7的反应常数高于R5,R6的反应常数。

图2 反应常数与温度的关系
图3中在温度小于700 ℃的时候ΔG>0,则说明在温度小于700 ℃的时候R7不能自发进行。在温度大于1 000℃~ 1 100 ℃时R5~R7的ΔG的比较:ΔG R7<ΔG R6<ΔG R5<0,温度大于1 100 ℃:ΔG R7<ΔG R5<ΔG R6<0,温度小于950 ℃时候ΔG R6<ΔG R5<ΔG R7。

图3 熵变与温度的变化
图2,图3共同可以说明褐煤在低温下分解后在与磷石膏反应。在温度大于950 ℃时候R7反应优于R6,R5这对于制备以H2、CO为主的合成气是十分有利的。这同时证明了以磷石膏为载氧体是可行的。
3 结果及分析
本文从以下2个方面展开分析:通过监测产物在气相中的分布,C分解率,以及合成气产量,研究了以磷石膏为载氧体的褐煤化学链气化的反应机制。然后综合这3方面的监测成果分析,构建以磷石膏为载氧体的褐煤化学链气化系统可行的优化措施。

(R8)
合成气:Syn=nCO+nH2
(R9)

(R10)
3.1 反应物的摩尔比对产物产量的影响示意图
图4(a),图4(b)表示了在反应条件为:N2的气氛,温度950 ℃。各组分随X的变化情况。

图4 反应物摩尔比对产物产量的影响图示
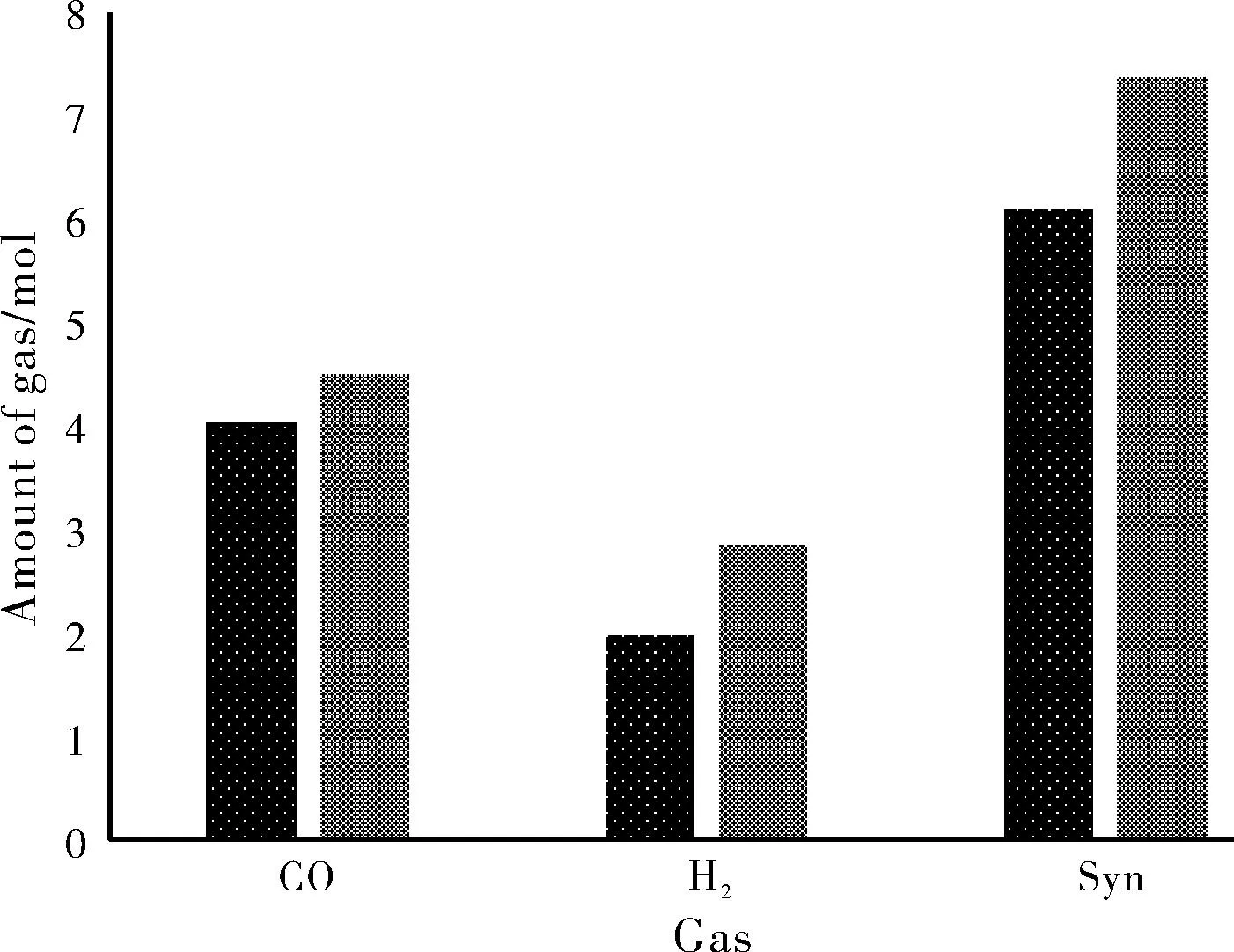
从图4(a)中可以观察到,气相产物的变化呈现2种不同的趋势,分别体现在2个不同的阶段。在第1阶段(X≤0.25),随着X的增大,CO和H2的产量迅速增加,而且CO增加的幅度较大,而CO2和H2O的产量基本不变,在这一阶段 CO和H2的产量占控制地位。这说明一方面是由于载氧体的不足,只有部分焦碳参加了反应,另一方面则在高温下发生了水煤气反应。因此该过程以R6和R2反应为主,且两反应同时进行;在第2阶段(0.25 该现象是由于这是由于发生了R6和R3反应即生成的CO逐渐被载氧体完全氧生成CO2,CO和水蒸气在高温下反应生成CO2。这说明合成气CO和H2与磷石膏发生了R5和R6反应,反应中消耗了之前生成的CO,通过载氧体将其完全氧化CO2。这种先后顺序也说明了R2和R7先与R3和R6反应发生。 从图4(b)中可知,在第1阶段(X≤0.25)随着 X 的增大,碳的转化率增大,合成气的量也逐渐增大,这也同样证实了褐煤分解后的剩余碳一方面被载氧体氧化,另一方面在高温下发生了水煤气反应。在第2阶段(0.25 由图4(a),图4(b)可知,为了获得较高的CO,H2以及C转化率,反应物摩尔比不能过小也不能过大,因此推荐反应物摩尔比取为0.25左右,此时反应以R7和R2为主反应。 图5(a),图5(b)表示了在反应条件为:N2的气氛,X=0.25。各组分随反应温度的变化情况。 图5 温度对产物分布的影响 从图5(a)中可以发现,当温度变化时,N2、H2S、COS的产量变化很小。但是随着温度的增加,CO和H2的产量逐渐增加,并在温度大于950 ℃稳定,CO2、H2O和CH4量迅速的减少并在温度大于950 ℃趋于0。说明在高温下CO2和H2O产生H2和CO的反应为R4反应。 从图5(b)中可看出在850 ℃的时候碳的准化率已经达到100%,然后在温度为800~950 ℃的条件下合成气的量依然在增加,说明800~850 ℃合成气增加的原因是一方面是由于褐煤分解剩余的C被载氧体不完全氧化为CO发生了R7反应;另一方面是由于发生了水煤气反应R2反应,且同样可以说明R7和R2为平行竞争反应。温度为850~950 ℃时候,也如图5(a)显示的那样,CO2和H2O生产H2和CO发生了R4反应。 说明温度的增高有利于反应目的产物H2和CO的产生,因此推荐反应温度取左右温度为950 ℃,此时除了R7反应外R4也为主反应。 图6(a)和图6(b)表示了在N2的气氛下,反应物摩尔比X=0.25 ,反应温度为950 ℃条件下,气相产物分布随水蒸气的变化。 图6 外加水蒸气对原气体产物分布的影响 图6(a)中可以看出,当水蒸气的量逐渐的增加的时候,H2和CO2的产量随之成线性增加,且增加的趋势几乎相同。然而CO的量随着水蒸气的增加增减的减少。这说明H2O和CO反应属于R3反应,产生了CO2和H2。水蒸气的增加有利于H2的产生,但是同时要消耗CO。 图6(b)中在该过程中C的转化率恒为100%,在温度较低时候C发生了反应R2和R7消耗了褐煤分解产生的C。从图6(b)中可以看出,该反应过程可以分为两个阶段。在第一阶段水蒸气的量为0~0.6之间合成气随水蒸气的增加有所增加。这是由于,一方面进行的R3反应是与CO的消耗同时进行的,而另一方面H2O的增加在一定程度上抑制了反应式R5的触发,使得混合气体中的H2含量增加。其中反应R3的发生程度小于R5的抑制程度,这使得合成气的总量在增加。在第二阶段水蒸气的量大于0.6的时候合成气的量趋于平衡,在此过程中混合气体中大量存才水蒸气使得R5反应彻底被抑制,虽然R3反应任在持续着但是消耗1 mol的CO同时也会生成1 mol的H2使得合成气的总量几乎没有变化。 说明水蒸气的增高有利于反应目的产物H2产生,在一定程度上增加了合成气的总量。因此推荐外加水蒸气为0.6左右。外加水蒸气使得反应R3为主要反应。 图7(a)和图7(b)表示反应物摩尔比X=0.25,反应温度为950 ℃条件下,外加水蒸气为0.75 mol,在不同的气氛下原气体产物分布的分布情况。 图7 不同气氛对原气体产物分布的影响 图7(a)可知,在Ne,He,Ar,N2气氛下的各产物量相同,但是在CO2气氛下,与原N2气氛下的产物相比,CH4几乎为0,CO2和H2O的量也有所减少,然而H2和CO的量有所增加。原因是由于大量的CO2的气氛下,大大的促进了R4反应的进行。使得反应平衡向右移促进了CO2,H2O和CH4反应生成了H2和CO速率,同时提高了合成气的产生量。 图7(b)中在该过程中C的转化率恒为100%,在温度较低时候C发生了反应R2和R7消耗了褐煤分解产生的C。更可证实在Ne,He,Ar,N2气氛下的各产物量相同,在CO2气氛的条件下R4反应占到了主导位置,CO2气氛下的合成气的生成量明显的有所增加。 说明CO2气氛下大大的促进了R4反应的进行,使得反应目的产物H2、CO产生加大,大大增加了合成气的总量。因此推荐反应气氛为CO2。 为更好地了解载氧体对褐煤化学链气化过程的影响,在模拟过程中对不添加载氧体的条件下进行了计算,并将得到的结果与添加载氧体后的结果作了对比,分析载氧体在褐煤化学链气化过程中所起的作用.添加载氧体和不添加载氧体时生物质气化情况的对比见图8。由图8可知,添加了磷石膏作为载氧体后,生物质气化产生的CO和H2量明显增加,其中CO量从4.060 9 mol提高到4.53 mol提升了11.58%;H2产量从2 mol提高到2.88 mol提升了44%;合成气的量从原来的6.134 7 mol提高到了7.41 mol产量提升了20.8%。这进一步证明了在进行褐煤化学链气化制取合成气时利用磷石膏作载氧体方案的可行性。 图8 是否加入载氧体对气体产量的影响 通过利用Fasctsage 6.4中的Reaction模块和Equilibrium模块对磷石膏作为载氧体褐煤化学链气化进行数值模拟得出以下结论: (1)在燃料反应器内,当反应物摩尔比 X 达到0.25左右时C的转化率为100%,H2,CO的量最大同时主反应该过程的反应以R6和R2反应为主且同时发生。 (2)燃料反应器温度过低,会抑制R4的发生,使得H2和CO的量减少。增加温度有利于R4的发生。故推荐燃料反应器的最佳温度范围为950 ℃左右。 (3)在一定的温度和反应物摩尔比下,水蒸气和CO2的气氛下可以提高目的产物CO和H2的产生。 (4)添加磷石膏作为载氧体后,褐煤化学链气化产生的CO和H2量明显增加,比不添加载氧体时生物质热解产生的CO量提高11.58%,H2产量提高了44%,气化产生的总气体量提升了20.8%。3.2 温度对产物分布的影响
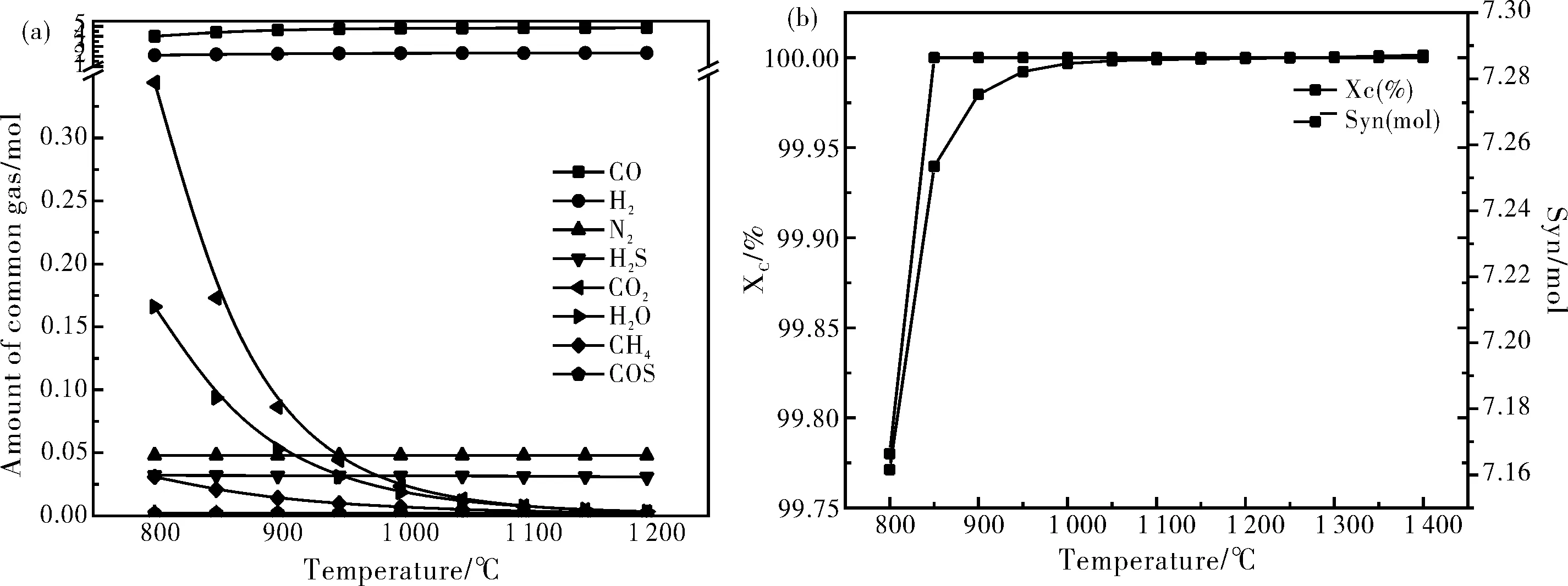
3.3 水蒸气对产物分布的影响

3.4 气氛对产物分布的影响

3.5 添加载氧体与否的区别
4 结 论

