泌尿系统原发性恶性黑色素瘤的生存预后分析:基于SEER数据库的一项研究
夏宇 刘溪 徐丹枫 黄滔 杨安卿 马斌斌 崔仁杰 李梦芸 赵晨晖
恶性黑色素瘤(malignant melanoma, MM)是发生于人体皮肤、黏膜及视网膜等组织内的黑色素细胞的恶性肿瘤,其恶性程度高,易发生转移,具有较高的致死率[1],欧美国家发病率约31.91/10万[2],我国发病率仅0.4~0.55/10万,但近年来有3%~5%的年增长率[3]。既往欧美研究报道皮肤、眼部、黏膜、其他部位发生MM占比分别为91.2%、5.3%、1.3%、2.2%[4],而在亚洲人群中,黏膜黑色素瘤(mucosal melanoma, MML)作为MM的第二大亚型,占比约22.6%,仅次于皮肤MM[5]。
其中,泌尿系统原发性恶性黑色素瘤(primary malignant melanoma of urinary system, PMMU)作为MML中最罕见且恶性程度较高的一类,约占全部MML的4%[1,6-7],目前国内外仅有少量病例报道,临床上尚无规范的分期系统及预后模型。本研究通过获取SEER数据库中PMMU患者的临床资料进行生存分析,探讨影响PMMU患者预后的危险因素及治疗方案,为临床诊治提供依据。
对象与方法
一、研究对象及数据提取
本研究收集SEER数据库中1975年至2019年诊断为PMMU患者的临床资料,从中筛选出符合条件的55例PMMU患者。提取患者临床数据包括性别、年龄、诊断年份、种族(白人/黑人/其他人种)、肿瘤原发部位(肾脏/肾盂/输尿管/膀胱/尿道)、肿瘤分期(肿瘤局限/局部进展/远处转移)、肿瘤原发灶手术方式(未手术/局部肿瘤切除/肿瘤根治性切除)、区域淋巴结清扫(否/是)、放化疗情况、围手术期系统治疗、原发肿瘤大小。其中,围手术期系统治疗在SEER数据库中并未说明具体的治疗方案,包含了患者围手术期间较为宽泛的治疗,如靶向治疗、免疫治疗、内分泌治疗、放化疗等辅助治疗。
二、纳入与排除标准
纳入标准:①患者的临床病理资料完整;②患者的肿瘤病理类型为MM,ICD-O-3编码范围在872-879中的MM及其相关亚型;③肿瘤原发部位包括肾、肾盂、输尿管、膀胱、尿道。排除标准:①基本数据不全的患者;②非病理诊断的患者;③多原发癌患者。
三、统计学方法
通过SEER Stat 8.3.4软件获取SEER数据库中目标患者的资料,使用SPSS 19.0软件进行统计学处理。患者的基线资料采用卡方检验,对其分布进行差异分析;采用Kaplan-Meier生存分析法绘制PMMU患者的肿瘤特异性生存(cancer-specific survival, CSS)曲线及总生存(overall survival, OS)曲线,计算1年、3年、5年的CSS率和OS率。将可能影响PMMU患者预后的相关因素作为自变量进行编码,在满足PH假定下应用Cox单因素及多因素回归分析(Cox多因素分析的变量纳入标准为P<0.1),得出影响PMMU患者预后的独立危险因素,并绘制生存曲线。以P<0.05为差异有统计学意义。
结 果
一、基线资料
根据纳入和排除标准,本研究最终纳入55例PMMU患者,其中男10例、女45例,男女比例为1∶4.5,女性发病率显著高于男性;患者年龄43~93岁,平均(72.4±10.7)岁,男性平均(67.8±7.9)岁,女性平均(75.5±10.8)岁;其中原发于膀胱部位的患者7例,其余48例均原发于尿道,无肾盂及输尿管发病部位患者。详细资料见表1。
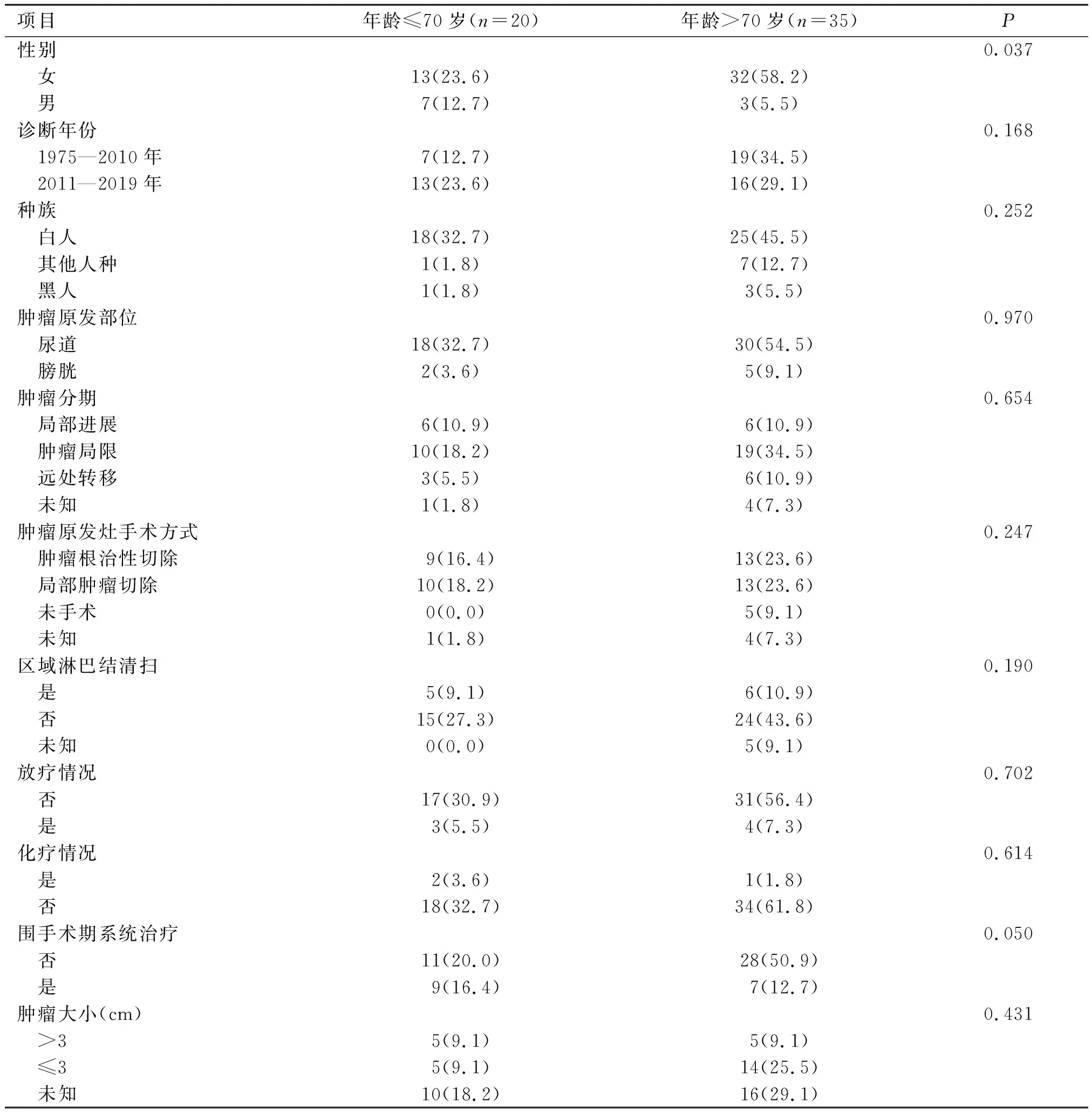
表1 55例PMMU患者的临床特征[例(%)]
PMMU患者的CSS期平均为84.1个月(46.5~121.7个月),中位生存时间26.0个月,患者1年、3年、5年的CSS率分别为76.1%、42.8%、32.4%;OS期平均为57.8个月(31.6~83.9个月),中位生存时间22.0个月,患者1年、3年、5年的OS率分别为72.8%、36.5%、25.1%。CSS和OS的Kaplan-Meier生存曲线见图1。
二、预后危险因素分析
对研究变量行单因素Cox回归分析,结果显示肿瘤分期、肿瘤原发灶手术方式对患者CCS预测均有统计学差异(P<0.05),而肿瘤原发部位、肿瘤分期、肿瘤原发灶手术方式对患者OS预测均有统计学差异(P<0.05)。进一步将单因素分析中P<0.1的变量纳入至Cox多因素回归分析,结果显示原发于膀胱部位(CSS:HR=4.116,95%CI:1.234~13.727,P=0.021;OS:HR=3.632,95%CI:1.241~10.626,P=0.019)、肿瘤远处转移(CSS:HR=7.254,95%CI:1.583~13.231,P=0.011;OS:HR=5.342,95%CI:1.251~12.819,P=0.024)的患者预后生存显著降低,提示肿瘤原发部位、肿瘤分期为影响患者CSS、OS的独立预后危险因素(P<0.05),见表2、3。
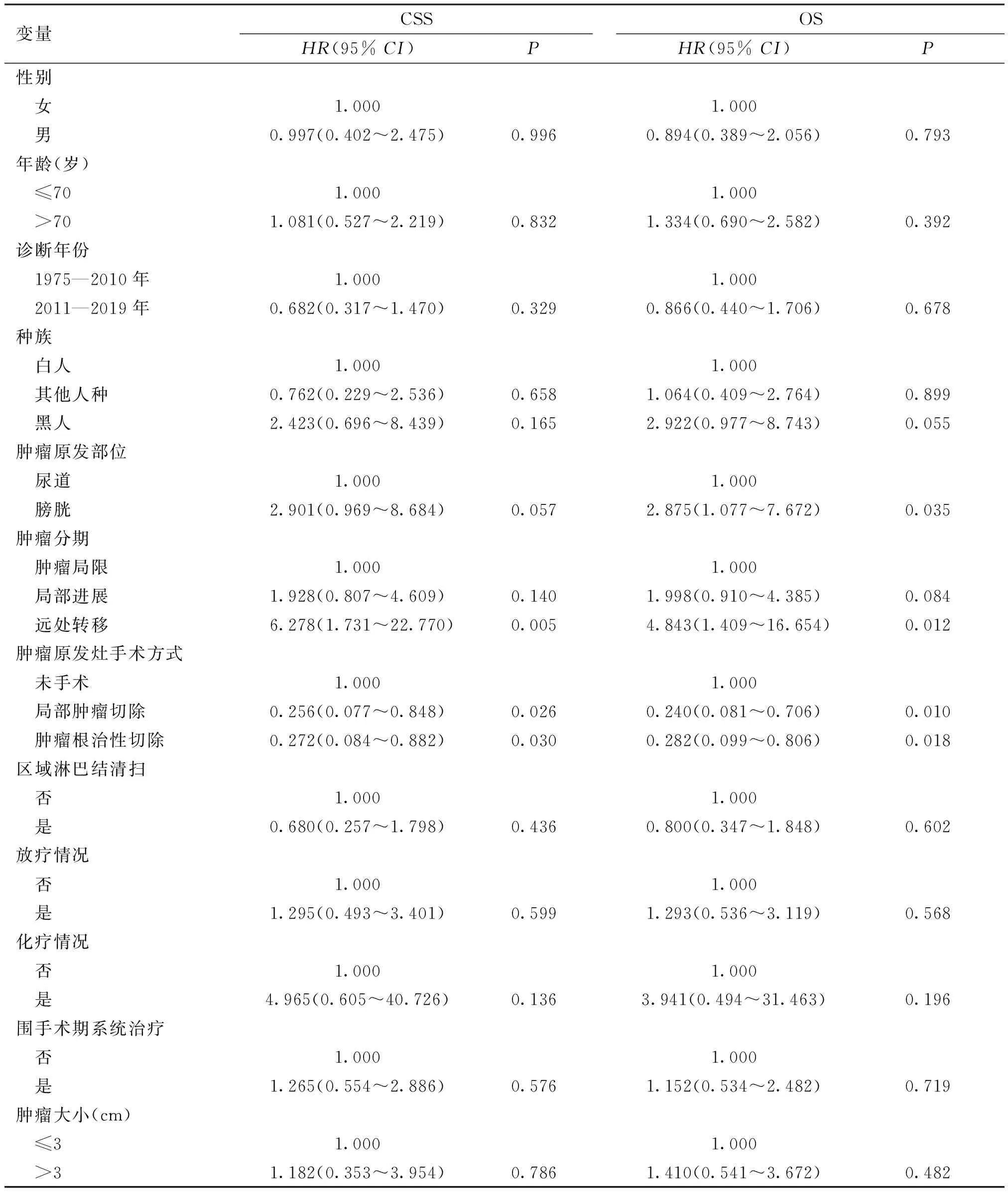
表2 影响PMMU患者预后的Cox单因素回归分析
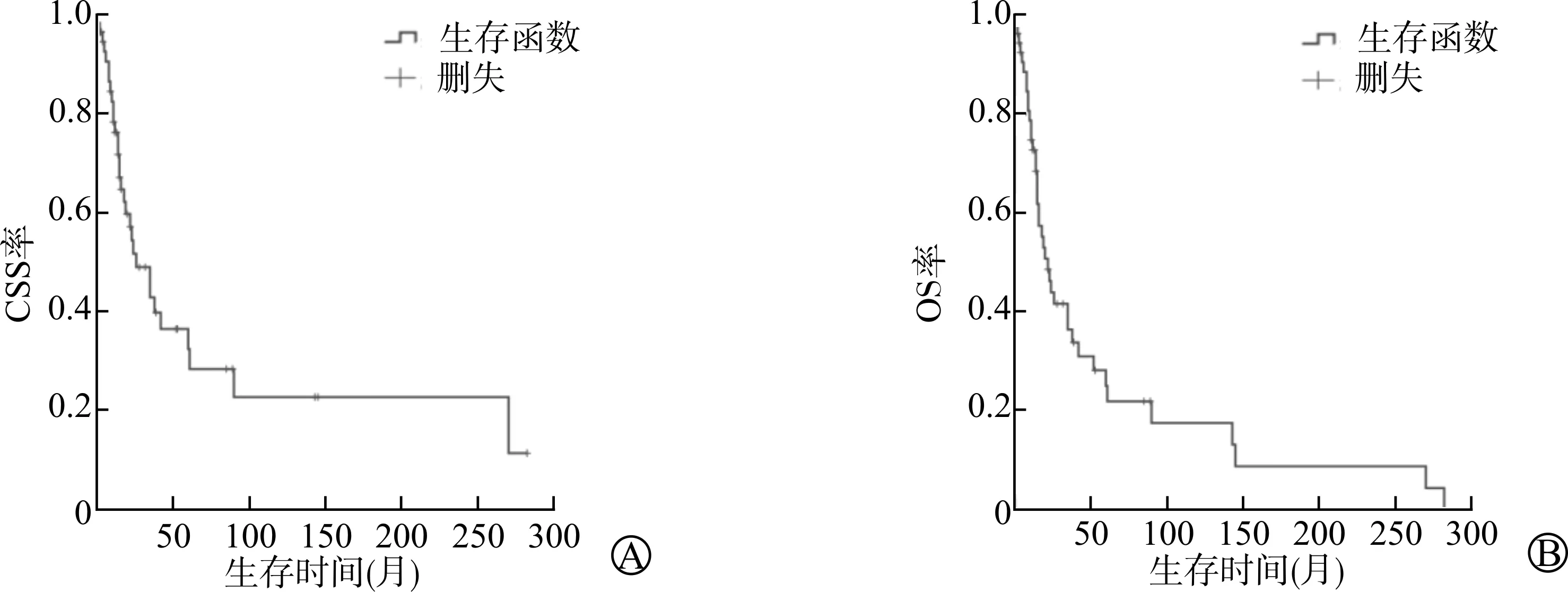
A:CSS生存曲线;B:OS生存曲线图1 55例PMMU患者的生存曲线
对于PMMU患者的CSS,原发于膀胱部位患者的CSS期平均为15.8个月(8.1~23.4个月),原发于尿道部位患者的CSS期平均为91.4个月(50.5~132.3个月);肿瘤局限患者、局部进展患者、远处转移患者的CSS期分别为99.5个月(50.5~148.6个月)、31.1个月(14.5~47.8个月)、9.1个月(43.6~119.6个月)。对于PMMU患者的OS,原发于膀胱部位患者的OS期平均为13.6个月(6.1~21.1个月),原发于尿道部位患者的OS期平均为62.9个月(34.0~91.8个月);肿瘤局限患者、局部进展患者、远处转移患者的OS期分别为71.2个月(35.8~106.6个月)、26.1个月(12.1~40.0个月)、9.1个月(5.5~12.7个月)。对应的Kaplan-Meier生存曲线见图2。
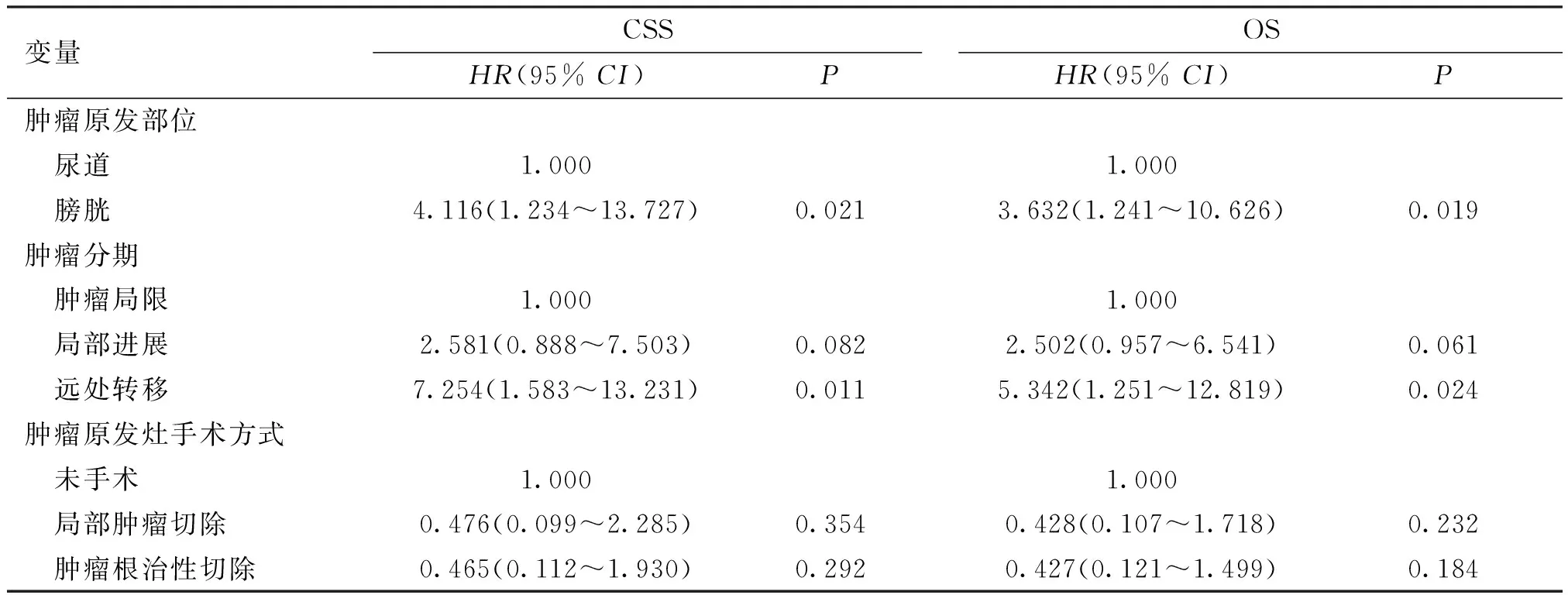
表3 影响PMMU患者预后的Cox多因素回归分析
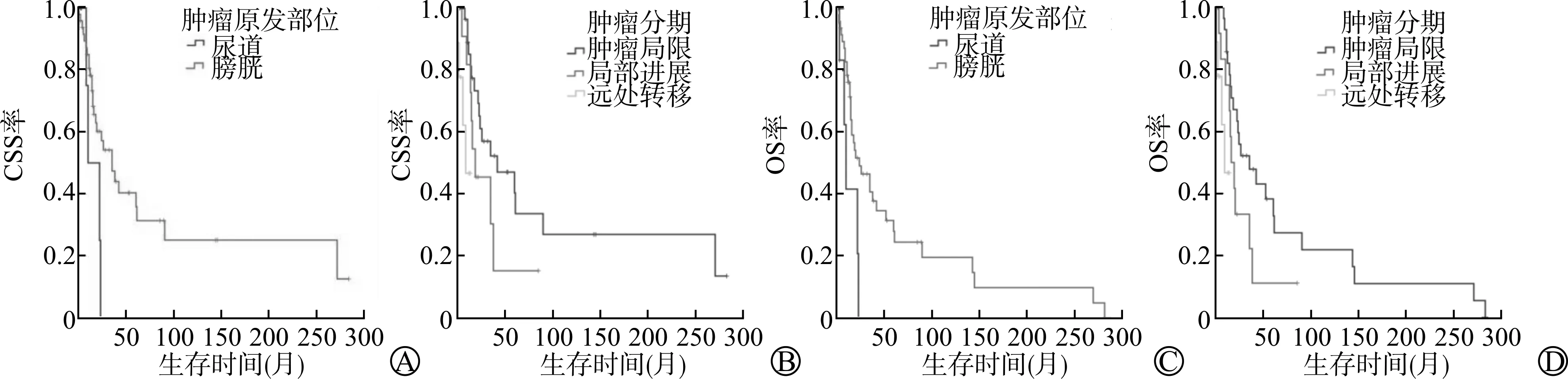
A:不同原发部位患者的CSS生存曲线;B:不同肿瘤分期患者的CSS生存曲线;C:不同原发部位患者的OS生存曲线;D:不同肿瘤分期患者的OS生存曲线图2 不同独立危险因素下PMMU患者的CSS、OS生存曲线
讨 论
PMMU作为MML的一种罕见亚型,其预后较其他类型MML差(皮肤、眼、黏膜MM的5年OS率分别为89.0%、78.4%、34.0%[8])。PMMU最常见的发病部位是尿道,其次是膀胱、输尿管及肾脏,目前仅有少量的临床病例或系列报道[7,9]。2021年,Gazzato等[1]对1952—2021年期间PubMed和Science.gov中泌尿系统相关的MML文献进行检索,最终获取了117篇研究文献,涉及患者147例,发现泌尿系统相关MML的发病部位依次为尿道(88例,59.8%)、膀胱(43例,29.3%)、肾脏(9例,6.1%)及输尿管(7例,4.8%),这与其他文献报道的结果相似,提示尿道及膀胱是PMMU发病的最常见部位,输尿管及肾脏少见[10-15],而输尿管多为其他部位MM的转移灶[9]。在本研究中原发于尿道的PMMU占87.2%,其余均为原发于膀胱的PMMU,这与既往研究报道一致。
PMMU的病因及分子机制尚不明确。目前MM的特征性标志物主要包括SOX10、S-100、Melan A、HMB45、PNL2、Tyrosinase和MITF[16],BRAF突变率为40%~50%,KIT突变率为3%,相反MML的BRAF突变率仅5%,而KIT突变率为14%,也有文献报道亚洲人群的MM患者KIT突变率高达70%[17-19]。而对于PMMU多为个案报道,2020年,Acikalin等[9]报道了8例PMMU患者(尿道部位6例、膀胱部位1例、输尿管部位1例),患者平均生存时间25.2个月,PMMU原发灶肿瘤大小平均为1.95 cm(1.0~2.8 cm),多数伴有溃疡,肿瘤均表现为垂直生长,免疫组化显示肿瘤细胞胞浆中HMB45、S-100和Melan-A呈弥漫性强染色,而泛细胞角蛋白均为阴性;对6例PMMU患者行二代测序(NGS)结果显示,1例原发于膀胱的PMMU患者存在ERBB2和FGFR1的拷贝数增加,2例原发于尿道的PMMU患者BRAF V600E突变,1例原发于尿道的PMMU患者KIT突变合并ERBB2、FGFR1拷贝数减少,1例原发于输尿管的PMMU患者BRAF V600K突变合并ERBB2、FGFR1、MET基因扩增,仅1例原发于尿道的PMMU患者NGS检查正常。在此之前Chaus等[20]报道的1例原发于膀胱的PMMU,基因检测提示BRAF V600E、PTEN外显子9、PDL1-2表达阳性,肿瘤突变负荷高。
目前对于MML的治疗方法是病灶的广泛切除及区域淋巴结清扫,辅助化疗或免疫治疗[9]。2022年中国临床肿瘤协会(CSCO)指南Ⅰ级推荐对可手术切除的MML行原发灶完整切除及区域淋巴结清扫,术后辅助大剂量干扰素、化疗(替莫唑胺+顺铂)和/或局部放疗(对于头颈部MML),对于不可手术切除者建议使用化疗+抗血管生成药物、维莫非尼(BRAF V600突变)、达拉非尼+曲美替尼(BRAF V600突变),而免疫治疗为Ⅲ级推荐[5]。英国肛肠-泌尿-生殖MML指南推荐对无法根治性切除的Ⅲ期或Ⅳ期患者可使用单药PD-1治疗,对于身体状况良好者可采取联合免疫治疗(例如抗-CTLA和PD-1/PD-L1),对于少数合并BRAF突变且肿瘤无法根治性切除的Ⅲ~Ⅳ期患者可选择BRAF+MEK抑制剂治疗[21]。
PMMU的治疗方法类似于MML,通常对相应肿瘤病灶部位行切除术,如尿道切除术、膀胱切除术、外阴切除术等,同时行区域淋巴结清扫,并辅助化疗、放疗或免疫治疗,但不少研究发现这些治疗方法似乎对PMMU患者的预后或生存率无明显改善[7,14]。本研究中,PMMU患者的原发病灶手术治疗率达81.8%,虽然单因素分析提示手术患者的预后均优于未手术者(P<0.05),肿瘤根治性切除、局部肿瘤切除、未手术患者的OS期分别为55.2、50.9和9.8个月,但在多因素分析中却不作为独立的危险预后因素(P>0.05),另外放化疗及围手术期系统治疗对患者预后无明显影响,这可能预示目前对于PMMU的治疗手段仍存在一定的局限性。
在肿瘤的分期方面,美国癌症联合会(AJCC)仅对皮肤、眼葡萄膜、眼结膜及头颈部MM建立了规范的TNM分期,而MML由于发病部位较分散,预后因素不明确,使其缺乏统一分期标准。2022年,Cui等[22]通过搜集我国多中心总计1 814例MML患者,采取多因素分析,验证了不同原发部位MML具有类似的预后,并提出了新的分期系统,该系统提出MML浸润深度为早中期MML的分层预后因素,区域淋巴结转移个数和远处转移则作为晚期MML的分层预后因素。而本研究也得出肿瘤分期为PMMU患者的独立预后危险因素,另外发现肿瘤原发部位对PMMU的预后也有一定的预测作用,但由于除尿道、膀胱以外部位的PMMU尤为罕见,故本研究中仅对比了尿道与膀胱部位的PMMU。
PMMU作为一类临床罕见且侵袭性强的恶性肿瘤,对于其分期标准、治疗方案仍存在一定争议,现阶段许多新型治疗方法也在不断探索。本研究中,我们发现肿瘤原发部位和肿瘤分期可作为PMMU的独立预后因素,但各类治疗似乎未对PMMU患者的预后有明显改善。近年来研究发现的BRAF V600E、BRAF V600K基因的突变,ERBB2、FGFR1和MET基因的扩增,以及KIT基因突变有可能作为PMMU潜在的治疗靶点。

