早期肠内联合肠外营养对老年胃癌根治术患者免疫功能和康复的影响观察#
张利娜,郑丹琼,刘亚颖,李松,陈翔
(1.河南省中医院(河南中医药大学第二附属医院)麻醉科,河南 郑州 450002;2.河南省中医院(河南中医药大学第二附属医院)血液科,河南 郑州 450002;3.河南省中医院(河南中医药大学第二附属医院)生殖科;河南 郑州 450002)
胃癌属于临床上常见的消化系统肿瘤疾患之一,其发病率较高,在恶性肿瘤性疾病发病率中的排名占据首位,且好发于老年群体。目前针对老年胃癌患者的主要治疗手段为胃癌根治术,但由于术后消化吸收功能减弱,且伴随胃胀胃痛等不适,导致患者食纳变差,造成摄食量减少,更严重时会引起机体营养状况恶化,导致免疫功能下降,不利于术后康复。所以合理维持患者的营养状况,对患者术后康复具有重要的意义[1]。
临床上常采用肠外营养(TPN)来维持患者机体基本的营养需求,但经研究发现,对患者长期予以肠外营养支持方案,会引起血清电解质紊乱、肝功能损害、肠粘膜屏障功能减退、肠源性感染等多种并发症出现,不利于患者术后恢复[2]。
近年来,有研究发现肠内营养不仅能有效地增强人体的营养状况,还能促进胃肠黏膜细胞的生长,维持肠道正常的免疫功能[3]。基于此,本文分析老年胃癌根治术后使用早期肠内联合肠外营养对患者免疫功能和康复的影响观察,本研究旨在分析为老年胃癌病人术后实施营养支持方案提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2019 年3 月~2021 年1 月期间在本院收治的经病理确诊为老年胃癌患者102 例的临床资料。纳入标准:均经胃镜活检和病理确诊的老年胃癌患者;家属及病人知情并签署《知情同意书》;肿瘤分期为Ⅰ期~Ⅲ期;无幽门梗阻等胃排空障碍。排除标准:纳入研究前进行过放、化疗治疗者;不能完全配合本次研究项目者;合并其他心脑血管疾病及器质性病变者。
根据营养支持方案不同分为对照组(肠外营养支持,n=53)和观察组(肠内联合肠外营养支持,n=49)。其中对照组,男29 例,女24 例;年龄46~77 岁,平均年龄(57.35±5.48)岁;肿瘤分期:Ⅰ期24 例、Ⅱ期17 例、Ⅲ期12 例。观察组:男26 例,女23 例;年龄46~79 岁,平均年龄(57.51±5.50)岁;肿瘤分期:Ⅰ期23 例、Ⅱ期15例、Ⅲ期11 例。患者临床资料比较,差异无统计学意义(P>0.05)。
1.2 方法
两组患者入院后均进行胃癌根治术治疗。在此基础上,两组采用不同的干预方法。
1.2.1 对照组
对照组采用肠外营养支持。术后即开始自中心静脉管输人全营养混合液(糖类、脂肪乳剂、氨基酸、水、电解质、微量元素和维生素配制而成),共3 L,在18~22 h 内输注完毕。非蛋白热卡不低于41.8 KJ·kg-1·d-1,治疗时间为一周。在术后第8 d 开始流质饮食后,逐步减少全营养混合液用量。
1.2.2 观察组
观察组在对照组的基础上使用肠内营养支持。通过营养管恒温状态输注营养液体能全力(生产厂家:采购自纽迪希亚制药(无锡)有限公司;规格:1.5 kcal·mL-1)500~1000 mL,维持鼻饲液温度在36~41℃,术后第1 d 输注剂量为全量的三分之一,滴速设置为25 mL 每小时。术后第2 d输注全量的三分之二,滴速设置为45 mL 每小时。同时给患者输注250 mL5%葡萄糖溶液补充水分,治疗时间为一周。输注注意事项同对照组。
1.3 观察指标
1.3.1 免疫功能
治疗前及治疗后空腹状态抽取外周静脉血6 mL,离心、分离血清后送检。采用免疫单扩散法检测免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、免疫球蛋白A(IgA)[4]。试剂(来自广州健仑生物科技有限公司)。
1.3.2 营养指标水平
详细的营养指标包括:血清白蛋白(Serum Albumin,ALB)、前白蛋白(Prealbumin,PA)以及转铁蛋白(Transferrin,TRF)[5]。使用日立公司生产全自动生化分析仪(型号:AU5400)检测血清白蛋白、前白蛋白以及转铁蛋白水平,相关操作严格按照实验流程进行。
1.3.3 恢复情况
两组治疗后恢复情况[6]比较,包括:肛门排气时间、首次排便时间、恢复经口进食时间和术后住院时间。
1.3.4 并发症两组治疗后并发症情况比较,并发症包括腹胀、恶心呕吐、感染等,并计算总并发症发生率。
1.4 统计学方法
数据采用SPSS22.0 软件进行分析,免疫指标、营养指标、恢复情况等资料采用()描述,采用t检验;计数资料通过n(%)表示,采用χ2检验;以P<0.05 为差异具有统计学意义。
2 结果
2.1 肠内联合肠外营养支持提升免疫功能
治疗前,两组IgA、IgG 及IgM 水平比较无差异(P>0.05);治疗后两组IgA、IgG 水平均降低,但观察组IgA、IgG 水平高于对照组(P<0.05),见表1。
表1 两组免疫功能指标水平比较()
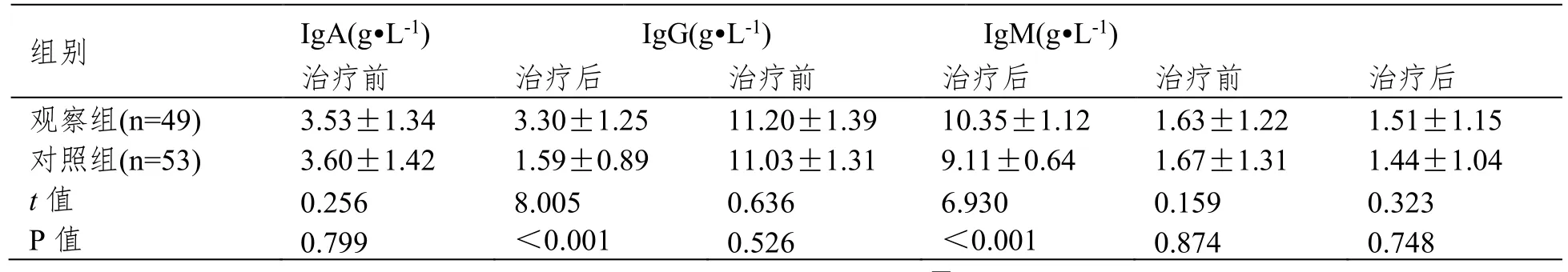
表1 两组免疫功能指标水平比较()
2.2 肠内联合肠外营养支持改善营养指标水平
治疗前,两组ALB、PA 及TRF 水平比较均无差异(P>0.05);治疗后两组ALB、PA 及TRF水平均升高,且对照组ALB、PA、TRF 水平均显著低于观察组(P<0.05),见表2。
表2 两组营养指标水平比较()
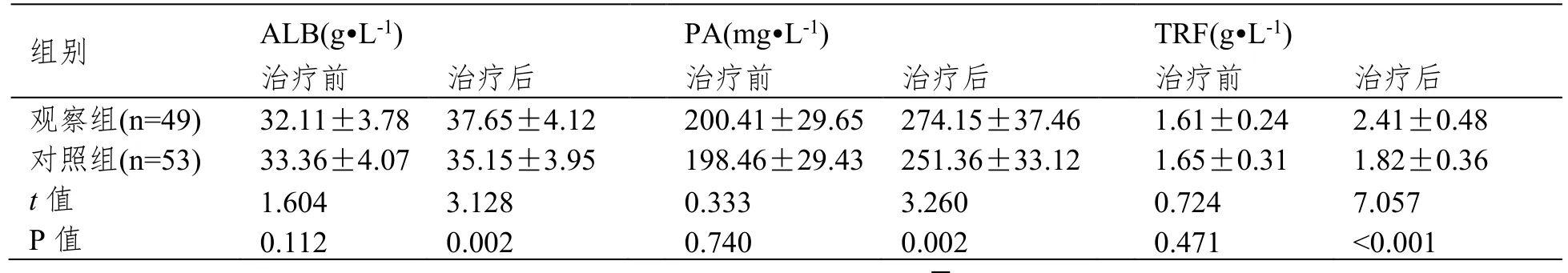
表2 两组营养指标水平比较()
2.3 肠内联合肠外营养支持促进恢复
治疗后,对照组肛门排气时间、首次排便时间、恢复经口进食时间、术后住院时间高于对照组(P<0.05),见表3。
表3 两组治疗后恢复情况比较[(),d]
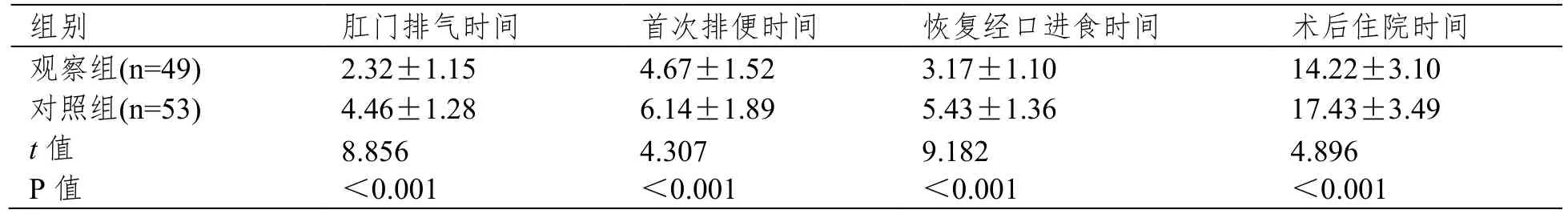
表3 两组治疗后恢复情况比较[(),d]
2.4 肠内联合肠外营养支持不增加并发症
对照组治疗过程中出现1 例恶心呕吐、1 例腹胀、肠源性感染3 例;观察组中出现2 例恶心呕吐、2 例腹胀。对照组并发症总发生率9.43%(5/53)与观察组并发症总发生率6.12%(3/49)比较,差异无统计学意义(P>0.05)。
3 讨论
我国胃癌发病率高于世界平均水平,在我国胃癌每年发病人数约90 万人,且每年病死人数约70 万人,在我国疾病危害性排名中高居首位,严重危害居民生命健康。胃癌患者因长期受疾病折磨,多存在营养不良,机体抵御能力下降,体积再次应激的反应性减弱[1,2]。目前针对老年胃癌患者的主要治疗手段为胃癌根治术,但由于术后消化吸收功能减弱,且伴随胃胀胃痛等不适,导致患者食纳变差,造成摄食量减少,更严重时会引起机体营养状况恶化,导致免疫功能下降,不利于术后康复。所以合理维持患者的营养状况,对患者术后康复具有重要的意义[4]。通过肠外营养可有效改善患者营养状况,但治疗后并发症多,会在一定程度上影响临床治疗疗效,难以在临床推广[3,4]。本研究结果显示,治疗后观察组IgA、IgG 水平高于对照组,同时治疗后对照组ALB、PA、TRF 水平显著低于观察组。可见肠内营养支持联合肠外营养支持能明显提高患者的免疫功能,主要为肠外营养支持无法经过胃肠道摄取营养或摄取营养物质,不能满足患者自身代谢需要。在对胃癌患者营养支持的途径中,通过消化道给予营养支持无疑是最理想途径,肠内营养支持经过胃肠道供给由中小分子营养素组成的流质营养制剂,更有利于患者肠道吸收,可维持肠道通透性,保护肠粘膜屏障[6]。本研究中,对照组肛门排气时间、首次排便时间、恢复经口进食时间、术后住院时间高于对照组。表明肠内营养也有助于促进肠胃蠕动,以缩短患者肛门排气、排便时间,可促进患者术后预后。对于中晚期胃癌患者来说,术后早期肠外营养支持耐受性较差,可能会引起腹胀、恶心呕吐、肠源性感染等并发症出现。既往研究报道,对患者长期通过非经胃肠道途径给与营养物质,会导致患者肠内膜的萎缩,绒毛与皱褶减少,肠道的屏障功能受损,诱发肠源性感染[7]。本研究中,对照组中有3 例患者出现肠源性感染,而观察组中无发生肠源性感染的病例,可见肠内外营养支持可有效规避肠源性感染的发生。综上所述,老年胃癌根治术后使用早期肠内联合肠外营养治疗,能促进胃肠功能恢复,充分满足患者机体的营养需求和改善免疫功能,安全性高,可在临床中应用。

