二甲双胍基于Nrf2/HO-1/NF-κB信号通路对腰椎间盘退变的影响▲
董军立 贾诚谦 姚宪宝 苗二芽 蔡 毅
(华中科技大学同济医学院附属武汉中心医院疼痛科,湖北省武汉市 430014)
腰椎间盘退变是引起腰椎间盘突出、腰背疼痛、椎管狭窄等病症的主要原因之一[1]。腰椎间盘退变发病机制复杂,衰老、遗传易感性增强、营养供应障碍、机械负荷等均是导致腰椎间盘病变及退化的关键因素[2]。近年来有学者提出,炎症浸润及氧化应激反应是导致腰椎间盘退变患者出现髓核细胞数目减少、纤维环层状结构消失、椎间盘组织弹性下降、抗压能力减退等椎间盘病理改变的主要原因[3-4]。核转录因子红系2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是机体内重要的保护因子,凋亡、炎症、氧化应激等因素均可促进Nrf2入核活化,从而诱导下游转录因子如血红素氧合酶1(heme oxygenase 1,HO-1)表达,发挥抗氧化作用[5]。而HO-1高表达也可抑制核转录因子κB(nuclear factor kappa B,NF-κB)入核活化,从而减轻组织炎症损伤及细胞凋亡[6]。上述研究结果提示,抑制Nrf2/HO-1/NF-κB通路的活化可能是抑制或缓解腰椎间盘退变患者髓核组织炎症、氧化应激损伤及凋亡相关性病变的潜在机制。目前临床上缺乏治疗椎间盘退变的特异性药物。二甲双胍是治疗糖尿病的一线药物,有学者发现其可通过抑制自噬、炎症反应、氧化应激反应来缓解阿尔茨海默病、帕金森等神经退行性疾病的进展[7],并通过上调髓核细胞胞外基质合成而影响退变的髓核细胞代谢[8],提示二甲双胍很可能对抑制椎间盘变性及退化有重要作用。本研究基于Nrf2/HO-1/NF-κB通路探讨二甲双胍对腰椎间盘退变大白兔模型椎间盘组织的影响,现报告如下。
1 材料和方法
1.1 实验动物 120只雄性无特定病原体级新西兰大白兔,体质量(2.50±0.50)kg,购自武汉有度生物科技有限公司[生产许可证号:SCXK(鄂)2015-0025]。将大白兔单笼饲养在温度为(22±2)℃、湿度为(50±5)%的动物房内,并保持12 h明暗循环。本试验符合3R原则并经本院医学伦理委员会批准[审批号:IACUC-01(20210010014)]。
1.2 主要试剂和仪器 二甲双胍(中美上海施贵宝制药有限公司,批号:202103012003),全反式维甲酸(上海联硕宝为生物科技有限公司,批号:SIGMA R2625),HE染色液(北京伊塔生物科技有限公司,批号:YT8310);白细胞介素(interleukin,IL)-6、IL-1β、活性氧簇、丙二醛ELISA试剂盒(上海酶联生物科技有限公司,批号:ml027836、ml027836、ml092661、ml094971),Nrf2山羊抗兔一抗、HO-1山羊抗兔一抗、NF-κB山羊抗兔一抗、磷酸化NF-κB(phosphorylated NF-κB,p-NF-κB)山羊抗兔一抗、Ⅱ型胶原蛋白山羊抗兔一抗、超氧化物歧化酶2(superoxide dismutase 2,SOD2)山羊抗兔一抗、过氧化氢酶(catalase,CAT)山羊抗兔一抗、Caspase-3山羊抗兔一抗、Ⅰ型胶原蛋白山羊抗兔一抗、β-actin抗体、辣根过氧化物酶标记的驴抗山羊IgG二抗(Abcam公司,批号:20210708、20210512、20210921、20210704、20210613、20210325、20210416、20210524、20210908、20210926、20210817),DAB、二喹啉甲酸(bicinchoninic acid,BCA)、ECL液、RIPA裂解液(上海碧云天生物科技有限公司,批号:P0202、P0010S、P0018FS、P0013B),光学显微镜(HITACHI公司,型号:S-3400N)。
1.3 实验方法
1.3.1 椎间盘退变模型的建立、分组及干预方法:采用随机数字表法选取100只大白兔,采用3%戊巴比妥钠麻醉后行左侧腹背部备皮,暴露L2~6椎间盘,参照文献[9]的方法采用髓核穿刺抽吸法破坏椎间盘建立椎间盘退变模型。术后12周行X线及MRI检查,当检查结果提示椎间隙缩窄且Prirrmann分级[10]为Ⅱ级时判定为造模成功,本研究100只大白兔均造模成功。将椎间盘退变大白兔模型按随机数字表法分为模型组、二甲双胍低剂量组、二甲双胍高剂量组、Nrf2抑制剂组、二甲双胍+Nrf2抑制剂组,每组20只。取剩余的20只大白兔作为假手术组,只暴露其L2~6椎间盘,不进行破坏。
将二甲双胍的使用剂量按人与动物体表面积等效剂量换算单位折算为等效剂量40 mg/kg,并设置低剂量(40 mg/kg)与高剂量(160 mg/kg),然后给予二甲双胍低剂量组与二甲双胍高剂量组大白兔灌胃相应剂量的二甲双胍,1次/d。参照文献[11],给予Nrf2抑制剂组大白兔腹腔注射Nrf2抑制剂(全反式维甲酸)7 mg/kg,1次/48 h。给予二甲双胍+Nrf2抑制剂组大白兔灌胃160 mg/kg二甲双胍及腹腔注射7 mg/kg全反式维甲酸,1次/48 h。给予假手术组及模型组大白兔灌胃10 mL/kg生理盐水,1次/d。各组干预4周。
1.3.2 X线及MRI检查观察腰椎骨质改变及退变程度:末次干预后2 h,采用3%戊巴比妥钠麻醉各组大白兔,参照文献[12]的方法进行腰椎X线检查及MRI检查。通过X线图像计算L4~5椎间盘相对高度(干预前椎间隙高度/干预后椎间隙高度×100%)通过MRI图像观察椎间盘髓核与纤维环的形态及信号变化,并用Prirrmann分级法对椎间盘退变程度进行评分,Ⅰ级(正常)为0分,Ⅱ级(轻度退化)为1分,Ⅲ级(中度退化)为2分,Ⅳ级(重度退化)为3分,Ⅴ级(晚期退化)为4分,评分越高说明椎间盘退变程度越严重。
1.3.3 HE染色观察椎间盘组织病变:X线及MRI检查2 h后,按随机数字表法选取各组6只大白兔,将其麻醉处死后取椎间盘组织并用4%多聚甲醛固定,然后用0.5 mol/L乙二胺四乙酸脱钙20 d,石蜡包埋后制成厚度为4 μm的连续横断面切片。依次行二甲苯脱蜡、梯度乙醇脱水,再用苏木精浸泡染色5 min,自来水冲洗20 min,1%酸性酒精分色1~3 s,0.5%伊红溶液染色1~3 min,梯度乙醇脱水,二甲苯透明,中性树胶封固,于光学显微镜下观察纤维环及髓核形态变化。
1.3.4 免疫组化法检测Ⅱ型胶原蛋白、Nrf2阳性表达:取1.2.3制备的椎间盘组织石蜡切片,经脱蜡、透化及抗原修复处理后,加入稀释比为1 ∶300的Ⅱ型胶原蛋白山羊抗兔一抗、Nrf2山羊抗兔一抗孵育过夜,滴加辣根过氧化物酶标记的驴抗山羊IgG二抗(稀释比为1 ∶500)孵育45 min,DAB显色后置于光学显微镜下观察拍照,采用ImagePro Plus 6.0软件分析单位面积内(mm2)阳性染色的平均光密度值。Ⅱ型胶原蛋白主要存在于细胞外基质中,Nrf2在细胞质和细胞核内均有分布,棕黄色染色即为阳性染色。
1.3.5 ELISA检测椎间盘组织IL-6、IL-1β、活性氧簇、丙二醛水平:X线及MRI检查2 h后,按随机数字表法选取各组6只大白兔,麻醉处死后取椎间盘组织,置于液氮冻存。取出冻存的组织,加入液氮后粉碎研磨,获取匀浆液,按ELISA试剂盒说明书检测IL-6、IL-1β、活性氧簇、丙二醛水平。
1.3.6 Western blot检测椎间盘组织Nrf2/HO-1/NF-κB信号通路相关蛋白及下游抗氧化、凋亡相关蛋白的表达:将各组剩余8只大白兔麻醉处死后取椎间盘组织,置于液氮中冻存。取出冻存的组织,加入液氮后粉碎研磨,获取匀浆液,加入RIPA裂解液以提取总蛋白,利用BCA法检测细胞蛋白浓度。取95℃高温变性后的50 μg蛋白,通过SDS-PAGE分离等量蛋白,将蛋白转至PVDF膜。用5%脱脂牛奶4 ℃封闭PVDF膜1 h,再用TBST洗膜3次,5 min/次,然后将膜与Nrf2、HO-1、NF-κB、p-NF-κB、SOD2、CAT、Caspase-3、Ⅰ型胶原的山羊抗兔一抗(稀释比均为1 ∶600)4 ℃孵育过夜。TBST洗膜3次,5 min/次,将膜与辣根过氧化物酶标记的驴抗山羊IgG二抗(稀释比为1 ∶800),37 ℃孵育75 min,TBST洗膜5次,5 min/次。以β-actin抗体(稀释比为1 ∶700)为内参蛋白,采用ECL液显影曝光后,利用Image J软件对蛋白条带的灰度值进行分析。
1.4 统计学分析 采用SPSS 24.0软件进行统计学分析。计量资料用(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大白兔的腰椎骨质改变及退变程度 X线检查显示,假手术组大白兔L4~5椎间隙正常,关节面光滑平整且骨质无明显改变;相比于假手术组,模型组大白兔L4~5椎间隙变窄,关节面毛糙,上下椎体前缘增生且呈唇状改变,相邻椎体终板骨质硬化及骨赘形成明显,L4~5椎间盘相对高度减少(P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔L4~5椎间隙增宽,相邻椎体终板骨质硬化及骨赘形成消失或部分可见,L4~5椎间盘相对高度均增加,且二甲双胍高剂量组的L4~5椎间盘相对高度大于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔L4~5椎间隙变窄,相邻椎体终板骨质硬化及骨赘形成更为明显,L4~5椎间盘相对高度减少(P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔L4~5椎间隙变窄,相邻椎体终板骨质硬化及骨赘形成明显,L4~5椎间盘相对高度减少(P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔L4~5椎间隙增宽,L4~5椎间盘相对高度增加(P<0.05)。见图1、表1。
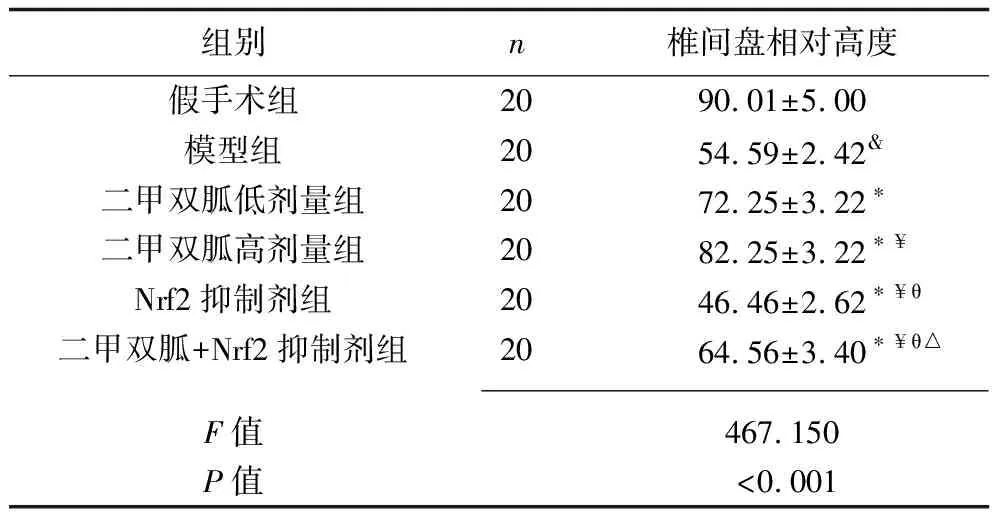
表1 各组大白兔L4~5椎间盘相对高度的比较(x±s,%)
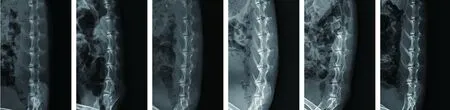
假手术组 模型组 二甲双胍低剂量组 二甲双胍高剂量组 Nrf2抑制剂组 二甲双胍+Nrf2抑制剂组
2.2 各组大白兔椎间盘Prirrmann分级评分的比较 MRI检查显示,假手术组大白兔腰椎间盘呈高信号;相比于假手术组,模型组大白兔腰椎间盘呈低信号,椎间盘Prirrmann分级评分升高(P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔腰椎间盘呈高信号,椎间盘Prirrmann分级评分均降低,且二甲双胍高剂量组的椎间盘Prirrmann分级评分低于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔腰椎间盘呈低信号,椎间盘Prirrmann分级评分升高(P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔腰椎间盘呈低信号,椎间盘Prirrmann分级评分高于二甲双胍高剂量组(均P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔腰椎间盘呈高信号,椎间盘Prirrmann分级评分降低(P<0.05)。见图2、表2。
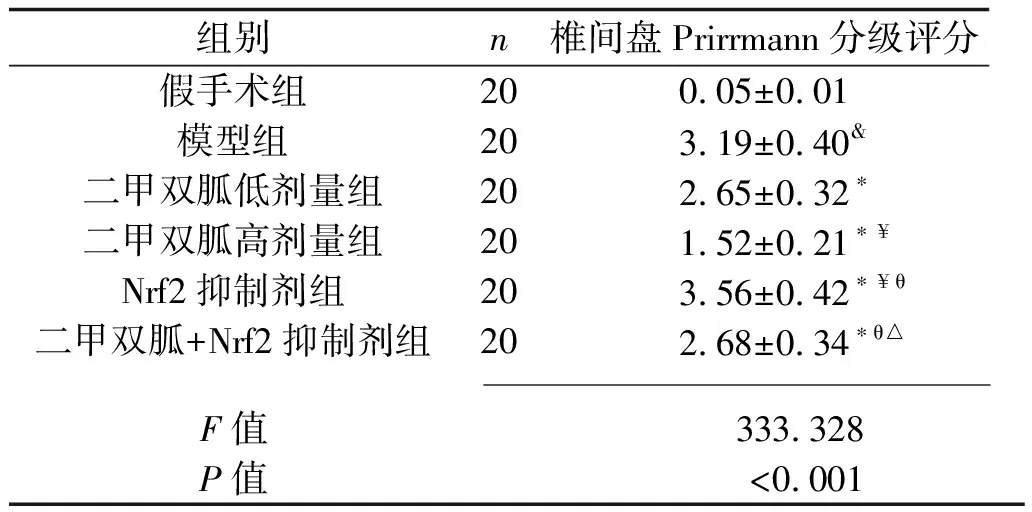
表2 各组大白兔椎间盘Prirrmann分级评分的比较(x±s,分)
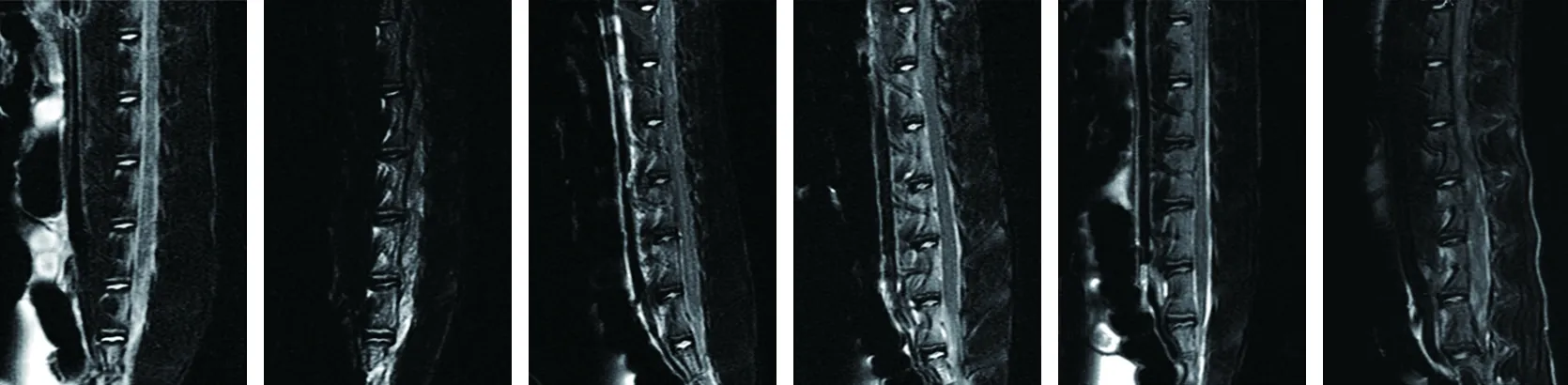
假手术组 模型组 二甲双胍低剂量组 二甲双胍高剂量组 Nrf2抑制剂组 二甲双胍+Nrf2抑制剂组
2.3 各组大白兔腰椎间盘组织病理变化的情况 HE染色结果显示,假手术组大白兔腰椎间盘组织纤维环层状结构及髓核细胞、纤维样软骨细胞的形态均正常;相比于假手术组,模型组大白兔腰椎间盘组织纤维环层状结构紊乱、部分断裂,髓核细胞被胶原组织分裂为椭圆形的细胞岛,纤维样软骨细胞增多;相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔腰椎间盘组织纤维环层状结构逐渐清晰,髓核细胞逐渐增多,纤维样软骨细胞减少;相比于模型组,Nrf2抑制剂组大白兔腰椎间盘组织纤维环层状结构断裂更明显,髓核细胞被纤维样软骨细胞代替;相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔腰椎间盘组织纤维环层状结构断裂及髓核细胞凋亡的情况更严重;相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔腰椎间盘组织纤维环层状结构清晰,髓核细胞增多,纤维样软骨细胞减少。见图3。
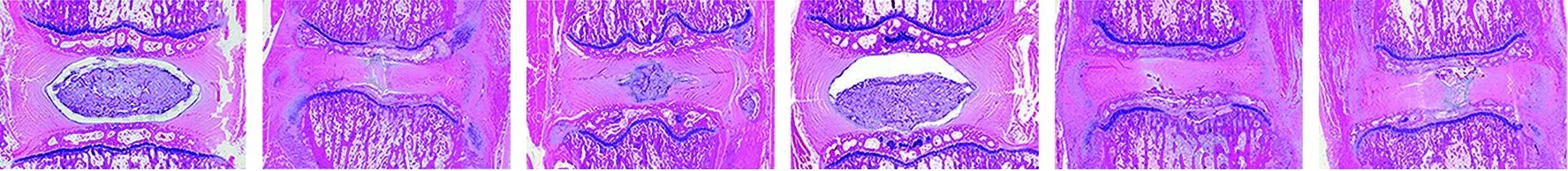
假手术组 模型组 二甲双胍低剂量组 二甲双胍高剂量组 Nrf2抑制剂组 二甲双胍+Nrf2抑制剂组
2.4 各组大白兔髓核细胞Ⅱ型胶原蛋白阳性表达的比较 免疫组化染色结果显示,假手术组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色较深;与假手术组相比,模型组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色变浅,Ⅱ型胶原蛋白平均光密度值降低(P<0.05);与模型组相比,二甲双胍低剂量组、二甲双胍高剂量组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色加深,Ⅱ型胶原蛋白平均光密度值均升高,且二甲双胍高剂量组Ⅱ型胶原蛋白平均光密度值高于二甲双胍低剂量组(均P<0.05);与模型组相比,Nrf2抑制剂组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色变浅,Ⅱ型胶原蛋白平均光密度值降低(P<0.05);与二甲双胍低剂量组、二甲双胍高剂量组相比,二甲双胍+Nrf2抑制剂组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色变浅,Ⅱ型胶原蛋白平均光密度值降低(P<0.05);与Nrf2抑制剂组相比,二甲双胍+Nrf2抑制剂组大白兔的髓核细胞Ⅱ型胶原蛋白阳性染色加深,Ⅱ型胶原蛋白平均光密度值升高(P<0.05)。见图4、表3。
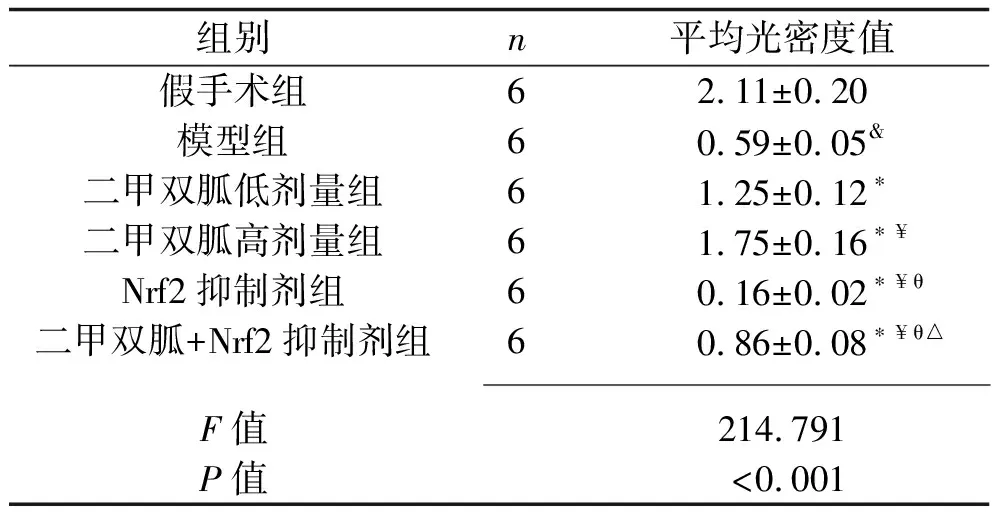
表3 各组大白兔椎间盘组织Ⅱ型胶原蛋白阳性表达平均光密度值的比较(x±s)
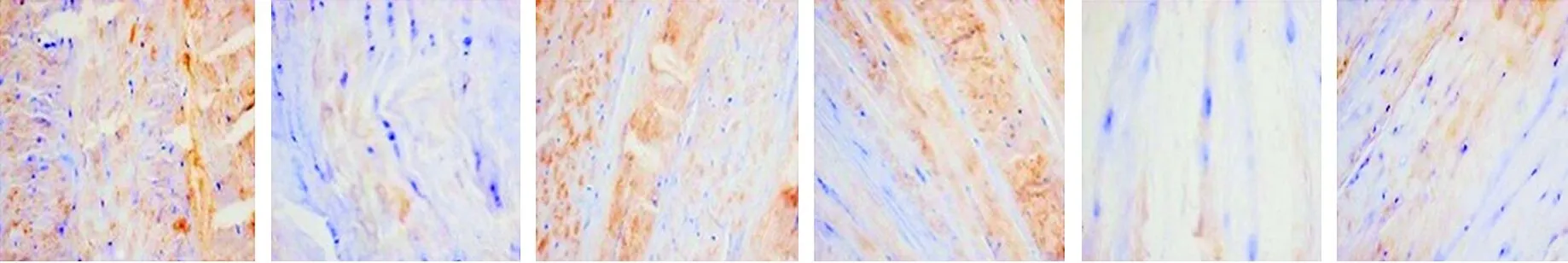
假手术组 模型组 二甲双胍低剂量组 二甲双胍高剂量组 Nrf2抑制剂组 二甲双胍+Nrf2抑制剂组
2.5 各组大白兔椎间盘组织Nrf2阳性表达的比较 免疫组化染色结果显示,相比于假手术组,模型组大白兔椎间盘组织Nrf2阳性染色变浅,Nrf2平均光密度值降低(P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔椎间盘组织Nrf2阳性染色加深,Nrf2平均光密度值均升高,且二甲双胍高剂量组大白兔椎间盘组织Nrf2平均光密度值高于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔椎间盘组织Nrf2阳性染色变浅,Nrf2平均光密度值降低(P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织Nrf2阳性染色变浅,Nrf2平均光密度值降低(P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织Nrf2阳性染色加深,Nrf2平均光密度值升高(P<0.05)。见图5、表4。
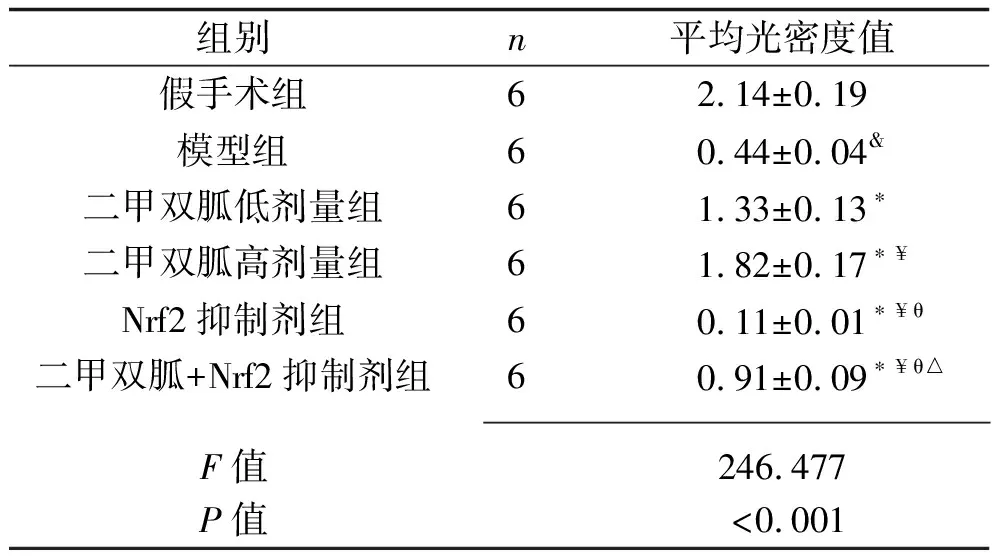
表4 各组大白兔椎间盘组织Nrf2平均光密度值的比较(x±s)
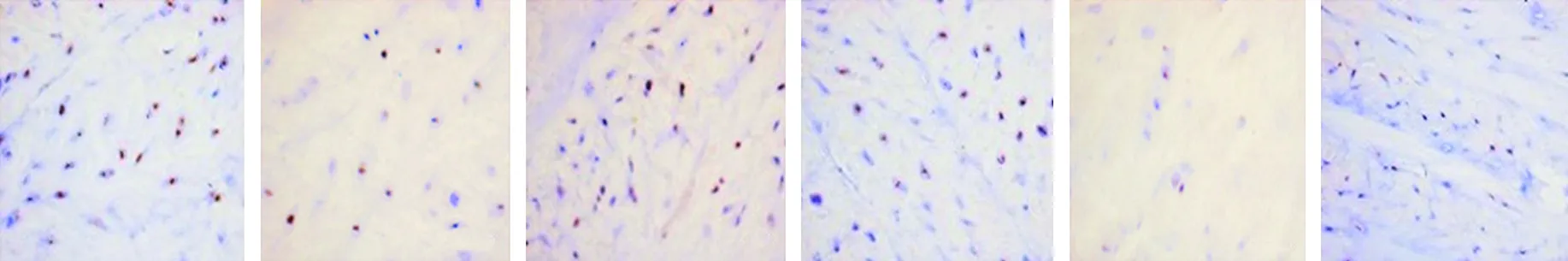
假手术组 模型组 二甲双胍低剂量组 二甲双胍高剂量组 Nrf2抑制剂组 二甲双胍+Nrf2抑制剂组
2.6 各组大白兔椎间盘组织IL-6、IL-1β、活性氧簇、丙二醛水平的比较 相比于假手术组,模型组大白兔椎间盘组织的IL-6、IL-1β、活性氧簇、丙二醛水平均升高(均P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔椎间盘组织的IL-6、IL-1β、活性氧簇、丙二醛水平均降低,且二甲双胍高剂量组上述指标均低于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔椎间盘组织的IL-6、IL-1β、活性氧簇、丙二醛水平均升高(均P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织的IL-6、IL-1β、活性氧簇、丙二醛水平均升高(均P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织的IL-6、IL-1β、活性氧簇、丙二醛水平均降低(均P<0.05)。见表5。
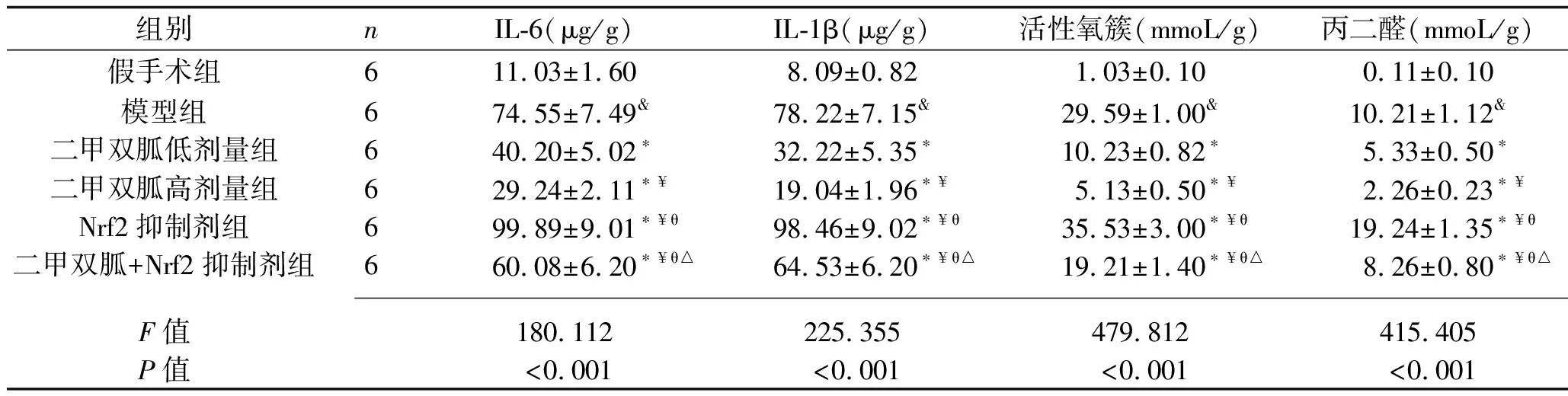
表5 各组大白兔椎间盘组织IL-6、IL-1β、活性氧簇、丙二醛水平的比较(x±s)
2.7 各组大白兔椎间盘组织Nrf2、HO-1蛋白表达量及p-NF-κB/NF-κB值的比较 相比于假手术组,模型组大白兔椎间盘组织Nrf2、HO-1蛋白表达量均降低,p-NF-κB/NF-κB值升高(均P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔椎间盘组织Nrf2、HO-1蛋白表达量均升高,p-NF-κB/NF-κB值均降低,且二甲双胍高剂量组的上述指标均优于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔椎间盘组织Nrf2、HO-1蛋白表达量均降低,p-NF-κB/NF-κB值升高(均P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织Nrf2、HO-1蛋白表达量均降低,p-NF-κB/NF-κB值升高(均P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织Nrf2、HO-1蛋白表达量升高,p-NF-κB/NF-κB值降低(P<0.05)。见图6、表6。
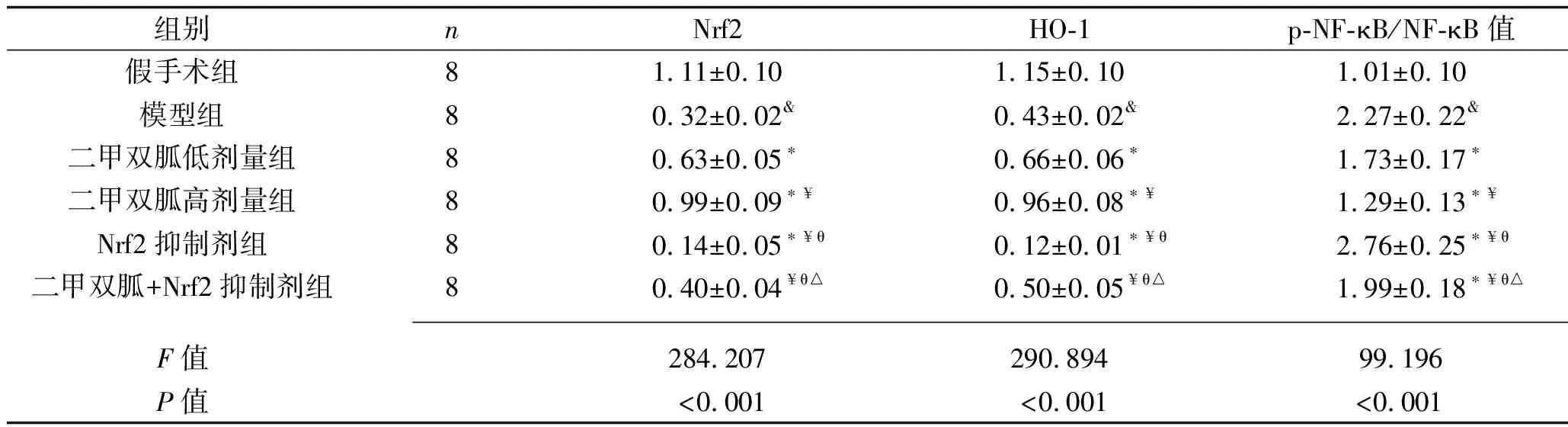
表6 各组大白兔椎间盘组织Nrf2、HO-1蛋白相对表达量及p-NF-κB/NF-κB值的比较(x±s)
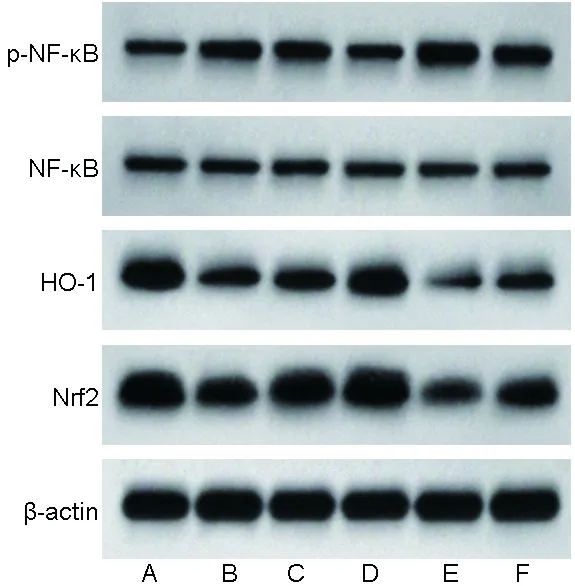
图6 各组大白兔蛋白表达Western blot图
2.8 各组大白兔椎间盘组织SOD2、CAT、Caspase-3蛋白表达量及Ⅰ型胶原蛋白表达量的比较 相比于假手术组,模型组大白兔椎间盘组织SOD2、CAT蛋白表达量及Ⅰ型胶原蛋白表达量均降低,Caspase-3蛋白表达量升高(均P<0.05);相比于模型组,二甲双胍低剂量组、二甲双胍高剂量组大白兔椎间盘组织SOD2、CAT蛋白表达量及Ⅰ型胶原蛋白表达量均升高,Caspase-3蛋白表达量均降低,且二甲双胍高剂量组上述指标均优于二甲双胍低剂量组(均P<0.05);相比于模型组,Nrf2抑制剂组大白兔椎间盘组织SOD2、CAT蛋白表达量及Ⅰ型胶原蛋白表达量均降低,Caspase-3蛋白表达量升高(均P<0.05);相比于二甲双胍低剂量组、二甲双胍高剂量组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织SOD2、CAT蛋白表达量及Ⅰ型胶原蛋白表达量均降低,Caspase-3蛋白表达量升高(均P<0.05);相比于Nrf2抑制剂组,二甲双胍+Nrf2抑制剂组大白兔椎间盘组织SOD2、CAT蛋白表达量及Ⅰ型胶原蛋白表达量升高,Caspase-3蛋白表达量降低(P<0.05)。见图7、表7。

表7 各组大白兔椎间盘组织SOD2、CAT、Caspase-3蛋白相对表达量及Ⅰ型胶原蛋白相对表达量的比较(x±s)
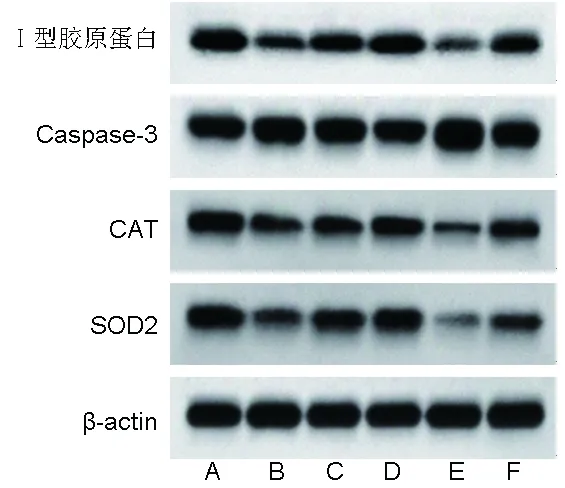
图7 各组大白兔蛋白表达Western blot图
3 讨 论
椎间盘由髓核、纤维环及软骨终板构成。髓核内丰富的Ⅱ型胶原纤维随机排列在蛋白多糖基质中,使髓核具有膨胀性,发挥抗压缩作用[13]。纤维环内含有丰富的Ⅰ型胶原纤维,由25层平行胶原纤维以60°交叉排列在椎体与脊柱轴线之间,从而有效抵抗脊柱弯曲及扭转拉力[14]。由软骨细胞及细胞外基质构成的软骨终板,是为椎间盘细胞提供营养的重要通道[15]。纤维环层状结构排列混乱并逐渐消失,髓核细胞体积及含水成分减少,软骨终板内软骨细胞退化、骨赘形成,而骨赘大量形成可导致椎间盘营养通道闭塞、纤维环及髓核大量减少,并最终引起椎间盘抗压缩、抗脊柱弯曲及扭转的作用减退[16]。关于椎间盘纤维环、髓核细胞及软骨细胞减少的机制,国内外学者尚未达成一致,目前公认氧化应激、炎症可能是引起椎间盘组织结构破坏的主要原因。研究表明,在氧化应激状态下,活性氧簇及丙二醛的大量聚集,可通过一系列途径破坏并降解髓核细胞内的聚糖蛋白、Ⅱ型胶原蛋白等,从而引起髓核组织皱缩、细胞凋亡及功能丢失[17]。氧化应激过程往往伴随着炎症的发生。既往研究表明,炎症调节因子如NF-κB对活性氧簇极为敏感,机体活性氧簇的大量蓄积可激活酪氨酸激酶并诱导NF-κB二聚体与NF-κB抑制蛋白解离而入核活化,活化的NF-κB可与相应DNA的κB结合位点结合,诱导椎间盘组织中基质金属蛋白酶及水通道蛋白酶降解而诱发凋亡;活化的NF-κB也可诱导IL-6、IL-1β转录并释放,而IL-6、IL-1β可通过脂肪酸合成酶/脂肪酸合成酶配体途径诱导髓核细胞及软骨细胞凋亡,并参与椎间盘退变[18]。本研究采用髓核穿刺抽吸法建立腰椎间盘退变模型,发现大白兔的椎间盘组织纤维环破坏、髓核细胞减少,部分髓核被类骨质取代,椎间隙变窄、关节面毛糙,椎体前缘骨质增生并呈唇状改变,椎间盘退变程度加重(椎间盘Prirrmann分级评分升高),髓核细胞凋亡加重(Ⅱ型胶原蛋白阳性染色减弱),纤维环减少明显(Ⅰ型胶原蛋白表达降低),提示大白兔椎间盘退变明显。另外,椎间盘组织中氧化应激产物(活性氧簇及丙二醛)及炎症因子水平(IL-6、IL-1β)均升高,提示氧化应激及炎症反应参与椎间盘退变过程。
有学者发现,用活性氧簇及IL-1β阻断剂抑制氧化应激及炎症反应,可明显延缓髓核细胞及纤维环组织破坏,达到延缓椎间盘退变的目的[3,17],提示抗炎及抗氧化应激可能是治疗椎间盘退变的潜在策略。二甲双胍除了具有降糖作用,还具有抗炎及抗氧化作用。田径等[19]发现,二甲双胍的抗炎及抗氧化作用可减轻脂多糖诱导的脑损伤;赵季伟等[20]发现,二甲双胍的抗凋亡作用可抑制脊髓组织坏死;Chen等[21]发现,二甲双胍可通过刺激自噬来抑制体内及体外髓核细胞的衰老及凋亡,提示二甲双胍也可能为缓解椎间盘退变的潜在药物。但二甲双胍的抗炎、抗氧化、抗凋亡作用是否能缓解椎间盘组织应激性退变,相关研究仍较少。本研究结果显示,给予低剂量、高剂量二甲双胍干预后,腰椎间盘退变模型大白兔的椎间盘退变程度减轻,椎间隙变窄及骨质改变、椎间盘组织纤维环破坏、髓核细胞减少及骨赘增加等病理表现得以缓解,髓核细胞(Ⅱ型胶原蛋白阳性染色)、纤维环(Ⅰ型胶原蛋白表达)均有所增加,椎间盘组织中的氧化应激及炎症反应也明显减弱,表明二甲双胍可减轻椎间盘组织纤维环减少及髓核细胞凋亡等退变表现,且其抑制作用可能与抑制炎症及氧化应激反应有关。此外,高剂量二甲双胍对椎间盘组织损伤的改善程度优于低剂量二甲双胍,推测二甲双胍对椎间盘组织损伤的改善作用可能具有剂量依赖性,在后续的研究中将对二甲双胍的最佳给药剂量及是否存在剂量依赖性进行深入探究。
Nrf2/HO-1/NF-κB通路是调控炎症、氧化应激及凋亡反应的关键通路之一。研究表明,活性氧簇及丙二醛可与Kelch样环氧氯丙烷相关蛋白1的Cys273及Cys288位点相互作用并诱导其构象改变,导致Nrf2与Kelch样环氧氯丙烷相关蛋白1解离活化入核,活化的Nrf2可与抗氧化反应元件的DNA启动子结合序列结合并形成复合物,启动下游抗氧化酶、抗炎蛋白及Ⅱ相解毒酶的转录表达来发挥抗炎、抗氧化[22]。有学者发现,Nrf2的表达随着椎间盘退变程度的加重而降低,并认为提高Nrf2的抗氧化及抗炎作用,对延缓椎间盘退变有显著效果[22]。另外,HO-1为Nrf2的下游转录因子之一,Nrf2活化后可促进HO-1的转录,HO-1的高表达可促进SOD2及CAT等抗氧化酶的表达,从而清除活性氧簇及丙二醛,发挥抗氧化作用,HO-1的高表达还可抑制活化NF-κB介导的炎症应答及凋亡途径的活化[23]。张雪梅等[24]发现,上调HO-1表达可抑制髓核细胞中磷酸化NF-κB的活化,从而减少IL-1β促发的凋亡。本研究结果显示,Nrf2在腰椎间盘退变模型大白兔中表达降低,且其下游HO-1及抗氧化酶表达均降低,NF-κB介导的炎症及凋亡反应增强,而进一步抑制Nrf2/HO-1表达后,腰椎间盘退变模型大白兔的椎间盘退变程度加重,炎症反应、氧化应激反应增强,髓核细胞凋亡现象明显,提示Nrf2/HO-1介导的抗氧化、抗炎、抗凋亡活性降低可能参与椎间盘退变的过程。二甲双胍各剂量组大白兔椎间盘退变组织中的Nrf2、HO-1表达升高,NF-κB活化及炎症、氧化应激、凋亡反应均受到抑制,提示二甲双胍具有抗椎间盘退变的作用,这可能与其促进Nrf2/HO-1介导的抗氧化、抗炎及抗凋亡作用有关。为了进一步验证二甲双胍在椎间盘退变中的作用机制,本研究采用Nrf2抑制剂进行干预实验,并在二甲双胍处理的基础上应用Nrf2抑制剂进行验证,结果显示,与单独应用Nrf2抑制剂相比,二甲双胍与Nrf2抑制剂联合应用后,大白兔椎间盘退变组织中的Nrf2、HO-1表达升高,NF-κB活化及炎症、氧化应激、凋亡反应均受到抑制,表明二甲双胍可以缓解Nrf2抑制剂对兔椎间盘退变程度、炎症反应、氧化应激反应及髓核细胞凋亡的影响。此外,与单独应用二甲双胍相比,二甲双胍与Nrf2抑制剂联合应用后,大白兔椎间盘退变组织中Nrf2、HO-1表达降低,NF-κB活化及炎症、氧化应激、凋亡反应均增强,表明Nrf2抑制剂可在一定程度上削弱二甲双胍的抗炎、抗氧化应激及抗凋亡作用,从而加重椎间盘退变程度。
综上所述,二甲双胍可能通过激活Nrf2/HO-1信号通路,抑制NF-κB活化,来发挥抗炎、抗氧化应激及抗凋亡的作用,从而延缓椎间盘退变,且高剂量二甲双胍的干预效果更好。这或许可为椎间盘退变的治疗提供新的策略,但Nrf2抑制剂并不能完全逆转二甲双胍的抗椎间盘退变作用,提示二甲双胍还可能通过其他途径发挥抗椎间盘退变作用,这需要深入研究以进一步探讨。

