复配条件对矢车菊素-3-O-葡萄糖苷与β-胡萝卜素复合模拟体系物化稳定性的影响
谢惠敏,毕金峰,刘 璇,姜溪雨,刘嘉宁
(中国农业科学院农产品加工研究所/农业农村部农产品加工重点实验室 北京 100193)
水果及蔬菜可提供人体所必需的多种营养成分,如膳食纤维、维生素、碳水化合物及矿物质等[1]。果蔬汁是由新鲜或冷藏的果蔬原料通过榨取直接制成的汁液[2],其风味最为接近果蔬本身,营养更是结合果蔬原料各自的营养成分,具有“液体果蔬”之称[3],尤其是由多种果蔬原料加工而成的复合果蔬汁,富含多种营养功能成分,如花色苷和类胡萝卜素等。花色苷及类胡萝卜素是果蔬中含量较多的天然植物化合物,这两类营养因子具有多种功能活性,如花色苷具有抗氧化活性、增强机体免疫力、改善视力、抗辐射等[4]功能,类胡萝卜素能够降低致癌、心血管疾病及视力相关功能障碍等风险[5],因此越来越受到人们的关注。目前,市场上出现大量以花色苷及类胡萝卜素为主要功能成分的复合果蔬汁,如番茄-草莓复合果蔬汁、以接骨木莓-胡萝卜为主的复合果蔬汁等。此类产品的复配方案主要以产品口感及外观品质为主,然而,关于这两类天然营养物质复合对各自物化特性及稳定性的影响尚未见报道。此外,富含花色苷及类胡萝卜素的果蔬汁加工及贮藏中易因花色苷和类胡萝卜素降解而导致褐变等问题,进而影响产品的感官品质及生理活性功能。花色苷及类胡萝卜素的稳定性是复合果蔬汁加工中,尤其是热处理过程中的一个重要问题。另外,在产品贮藏及售卖过程,光照也会对这两类色素稳定性产生影响。因此,明确复合汁体系中花色苷及类胡萝卜素的光、热降解规律,对于控制产品品质具有重要意义。
基于果蔬汁物化特性及主要物质成分,如pH值、糖类及金属离子等,是影响花色苷及类胡萝卜素稳定性的重要因素。其中,花色苷色泽及结构受pH 值影响较大。糖类不仅是果蔬原料的重要组成成分之一,也是果蔬汁饮料加工中重要的口味调节剂,因此研究不同糖种类及浓度对花色苷及类胡萝卜素稳定性的影响十分重要。此外,果蔬汁为矿物质强化的良好载体,其中,对人体有利的Ca2+、Fe3+对其稳定性的影响,对于复合果蔬汁的开发也十分重要。
基于上述对果蔬汁中C3G 及β-胡萝卜素稳定性可能产生影响的重要因素,构建相应的模拟体系来研究其物化稳定性,有利于揭示不同营养因素对花色苷及类胡萝卜素在果蔬汁体系中物化稳定性的影响,为富含这两类营养因子的果蔬汁产品的复配方案及加工提供数据支撑。
1 材料与方法
1.1 材料、设备与仪器
黑米花色苷提取物(纯度30%),购自宝鸡森瑞物化工有限公司;XAD-1600N 大孔吸附树脂,北京绿百草科技发展有限公司;β-胡萝卜素(纯度>97%),C3G 标准品,β-胡萝卜素(β-carotene)标准品购自美国Sigma 公司;甲醇、无水乙酸钠、蔗糖、果糖、葡萄糖,均为分析纯,购自国药集团化学试剂有限公司;色谱级甲醇,色谱级乙腈,购自Fisher。
电热恒温水浴锅,上海精宏仪器设备公司;SB25-12DTN 超声波清洗机,宁波新芝生物科技股份有限公司;Centrifuge 5804R,德国Eppendorf公司;N-EVAP 氮吹仪,美国Organomation 公司;T25 ultra turrax 分散机,德国IKA 公司;RE-3000旋转蒸发仪,上海亚荣生化仪器厂;高效液相色谱仪(Waters 1525 溶剂输送系统和Waters 2489 紫外/可见光检测器,Waters 公司;Q-SUN Xe-1-B氘灯老化箱,美国Q-lab 公司;Spark 多功能酶标仪,瑞士Tecan 公司;CM-5 色泽测定仪,日本Konica Minolta 公司。
1.2 试验方法
1.2.1 纯化花色苷 参照郝婧玮等[6]方法,对所购的黑米花色苷进行提取、纯化,并对纯化后的C3G进行液相检测,液相结果显示C3G 峰面积占98%以上。
1.2.2 β-胡萝卜素浓缩储备液的制备 将β-胡萝卜素以1 ∶4(m/V)的比例溶解在乙酸钠缓冲溶液(0.2 mol/L,pH 6.0)中,在55 ℃水浴条件下,使用分散机以14 000 r/min 的转速分散40 min,即得β-胡萝卜素浓缩储备液。
1.2.3 复合果蔬汁模拟体系的制备 为了研究复合果蔬汁中共存的花色苷与类胡萝卜素对果蔬汁食用及营养品质的影响,选定自然界中分布最广、含量最多的花色苷及类胡萝卜素——矢车菊素-3-O-葡萄糖苷(C3G)及β-胡萝卜素作为研究对象,选定糖类及金属离子作为果蔬汁的物质组分,在不同pH 值条件下,以模拟不同酸碱度的果蔬汁,自制了以C3G 与β-胡萝卜素为核心的果蔬汁液态模拟体系。其中,C3G 与β-胡萝卜素浓度的设置参照市面上复合果蔬汁常见水平,糖的种类、含量及pH 值根据市面上果蔬汁产品中的糖种类及含量(蔗糖、葡萄糖和果糖;5%、12%)与pH 值(pH 2.0、pH 3.5、pH 6.0)设定,离子浓度也是根据市面上果蔬汁产品浓度而设定,分别为0.1,0.3,1 mmol/L。
1.2.4 热稳定性试验 根据果汁加工中的温度,样品选择50,70,90 ℃温度条件下均匀加热,每隔40 min 取样检测。具体方法如下,样品每3 mL 分装在密封的PE 管中,在设定的温度下恒温水浴。在水浴时要注意不断摇匀,保证受热均匀。样品在热处理后应尽快转移进行冰浴,冰浴后,将样品置于-20 ℃条件下冷藏备用。
1.2.5 光照稳定性试验 将样品分别置于光照箱中光照,每隔2 h 取样检查花色苷和类胡萝卜素的含量变化。样品在处理后应尽快转移进行冰浴,冰浴后,将样品置于-20 ℃保存以进一步分析。
1.2.6 表观色泽的测定 利用色彩色差计,以仪器白板色泽为标准,依HunterLAB 表色系统测量样品的明度指数L*、彩度指数a*和b*。根据L*、a*和b*值计算总色差(ΔE),计算公式如下:
1.2.7 花色苷含量的测定 模拟果蔬汁溶液用0.22 μm 微孔滤膜过滤后装入液相瓶中。采用高效液相色谱法,反相C18 柱加可见光检测器。流动相A:1%甲酸水溶液,流动相B:1%甲酸乙腈进行梯度洗脱,洗脱程序为0~2 min,92%~88%,0~2 min,92%~88% A,2~5 min,88%~82% A,5~10 min,82%~80% A,10~12 min,80%~75% A,12~15 min,75%~70% A,15~18 min,70%~55% A,18~20 min,55%~20% A,20~22 min,20%~92% A,22~30 min,92%~22% A;流速为1 mL/min,检测波长为515 nm,进样量为10 μL,柱温30 ℃。
1.2.8 β-胡萝卜素提取与测定 β-胡萝卜素的提取参照Knockaert 等[7]方法稍作修改。取1 mL 样品,加入乙醇和正己烷(体积比为1∶2)的混合液,振荡,取上层萃取液。对样品重复萃取3 次,合并上层萃取液,并于10 mL 容量瓶中定容,测其在450 nm 处的吸光度。根据β-胡萝卜素标准曲线计算出β-胡萝卜素含量。
1.2.9 可见光谱检测 模拟果蔬汁溶液在300~700 nm 可见光范围内进行扫描,得到光谱图,分析样品在反应前后在最大波长处的吸收情况,及最大波长有无改变。其中,将不同pH 值体系样品分别用相对应pH 值的缓冲溶液进行适当稀释,然后进行紫外-可见光进行扫描。
1.2.10 降解动力学及热力学分析 大多数研究表明,花色苷及类胡萝卜素降解遵循一级反应动力学模型[8-10],假设复合果蔬汁模拟体系中的C3G与β-胡萝卜素的热降解也符合一级降解动力学,其降解动力学参数(速率常数k 和半衰期t1/2)和热力学参数(活化能Ea,焓变ΔH,吉布斯自由能ΔG及熵变ΔS)可采用下面公式计算得出:

表1 降解动力学及热力学参数计算公式Table 1 Calculation formula of degradation kinetics and thermodynamic parameters
1.3 数据分析
采用SPSS21.0 进行Duncan's 检验的差异显著性分析及Pearson 相关性分析,P<0.05 表示差异显著,P<0.01 表示差异极显著;图表由Origin 软件绘制;数据均以平均值±标准差来表示。
2 结果与分析
2.1 复合模拟体系表观色泽
C3G、β-胡萝卜素及C3G-β-胡萝卜素复合模拟体系色泽由图1 及表2 所示。由图1 可知,在当前浓度条件下,复合模拟体系呈现出以C3G 为主的紫红色,β-胡萝卜素对复合模拟体系色泽影响较小。

图1 C3G、β-胡萝卜素及复合模拟体系表观色泽和仿真色块Fig.1 Apparent color and color swatches of C3G,β-carotene and their complex simulated system

表2 C3G、β-胡萝卜素及复合体系表观色泽Table 2 Color parameters of C3G,β-carotene and their complex simulated system
2.2 不同pH 值及离子对复合模拟体系光谱特性的影响
2.2.1 不同pH 值对复合模拟体系光谱特性的影响 不同pH 值的模拟体系的吸收光谱如图2 所示。从图中可观察到在350 nm 处附近观察到β-胡萝卜素的特征吸收峰[11],但是信号较弱,可能的原因是β-胡萝卜素在缓冲液中溶解度较低或在目前试验条件下浓度较低。
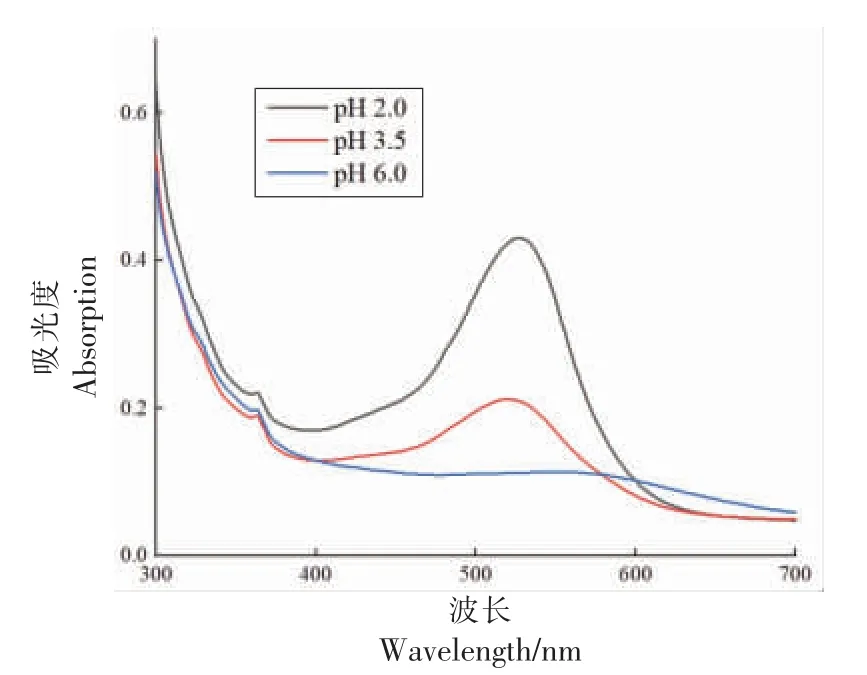
图2 不同pH 值复合模拟体系的紫外-可见光谱Fig.2 UV-Vis spectra of different pH simulated systems
不同pH 值条件下,体系在530~580 nm 范围内出现特征吸收峰,符合花色苷类物质的2-苯基苯并吡喃母环的特征吸收波长范围。当pH 值从2.0 增大至3.5 时,体系的颜色从粉红色变成浅粉色,其最大吸收波长几乎无变化,但吸光度值急剧下降;当pH 值从3.5 提高至6.0 时,体系色泽由浅粉色转变为紫色,且吸收波长红移,吸光度继续下降。这主要是花色苷结构受酸碱条件影响较大的原因。一般来说,在不同pH 值的水溶液中,花色苷存在4 种分子结构的平衡,包括红色黄酮阳离子(Flavylium,AH+),无色的甲醇假碱(Carbinol Pseudo-base,B),蓝紫色醌型碱(Quinoidal Base,A)和无色査尔酮(Chalcone,C)。当体系pH 值较小时,花色苷主要以红色黄酮阳离子(AH+)的形式存在,体系呈粉红色,随着pH 值增大,水分子亲核攻击AH+的2 位,破坏其双键,生成无色的甲醇假碱B 及蓝紫色醌型碱A,引起溶液颜色及光谱特征发生改变[12],如最大吸收波长出现红移现象。此外,由于β-胡萝卜素不受pH 值影响且在目前试验条件下浓度、溶解度较低,故对模拟体系光谱特性不会造成影响。
2.2.2 不同离子对复合模拟体系光谱特性的影响
2.2.2.1 Fe3+对复合模拟体系光谱特性的影响 从图3a 可以看出,加入Fe3+后,体系色泽由红色转变为紫黑色,说明花色苷分子已经被Fe3+完全破坏或已经生成其它物质,且由图3b 可以看出体系的紫外吸收光谱发生较大的变化,花色苷的特征吸收峰消失。造成这一现象的原因可能是Fe3+具有较强的氧化作用,能迅速氧化破坏C3G 分子中的酚羟基;也可能是因为C3G 邻位羟基结构不稳定,容易与Fe3+等金属离子配合形成络合物,这种络合物的稳定性强于花色苷,因此生成后不可逆转[13]。李颖畅等[14]研究发现Fe3+使蓝莓花色苷溶液产生沉淀,颜色由红色变为黄褐色,花色苷保留率降低;马越[15]研究发现向紫玉米花色苷的溶液加入Fe3+,溶液迅速变成黄褐色,并产生黑褐色沉淀,可能是因为多酚类色素与Fe3+反应生成复杂络合物。故在生产和研发中应注意避免花色苷应用于铁强化的复合体系或与铁具接触。
2.2.2.2 Ca2+对复合模拟体系光谱特性的影响 从图3c 可看出,Ca2+对体系的最大吸收波长没有影响,但随着Ca2+浓度的增加,体系的吸光度增大,故高浓度Ca2+对花色苷略有增色作用,这一结果与其他研究结果相似[16]。从图3a 可看出,Ca2+不会使体系颜色发生明显变化。因此,花色苷和β-胡萝卜素可以与Ca2+含量高的原料复合或应用于Ca2+强化体系。
2.3 pH 值及糖类对复合模拟体系热稳定性的影响
果蔬汁加工过程中常涉及热灌装、巴杀等热处理,且果蔬汁因原料种类、产品配方不同,其含有的糖类和pH 值存在差异,因此,基于生产常用热处理条件和果蔬汁成分特点,研究了不同糖类(蔗糖、果糖、葡萄糖)、糖质量分数(0%,5%,12%)及pH 值(pH 2.0、pH 3.5、pH 6.0)在不同温度(50,70,90 ℃)条件下,对体系中C3G 及β-胡萝卜素稳定性的影响。
2.3.1 不同pH 值对复合模拟体系热稳定性的影响
2.3.1.1 不同pH 值对复合模拟体系C3G 及β-胡萝卜素降解动力学的影响 图4 是不同pH 值条件对C3G 及β-胡萝卜素热降解的一级动力学曲线,从图4 中可以计算出动力学参数,包括反应速率常数k 和半衰期t1/2。基于不同温度条件下的简介动力学数据及曲线、热力学模型,可以预判降解反应的活化能Ea,焓变△H、吉布斯自由能△G 和熵△S,结果见表3。线性关系(R2均>0.836)表明,C3G 及β-胡萝卜素的热降解过程复合一级动力学方程。由图4c 可得,C3G 的热降解速率均随着温度的升高而加快,表现为降解速率常数k 增大,半衰期t1/2相应减小。原因可能是由于花色苷的二苯基苯并吡喃阳离子(AH+)失电子放热,而水解和开环反应吸热且伴随熵增大,从而使其平衡转向不平衡的甲醇假碱和査尔酮形式[17]。由此得出,花色苷在低温条件下更利于其贮藏。


图4 不同pH 值复合模拟体系中C3G 及β-胡萝卜素热降解一级动力学方程Fig.4 Thermal degradation pseudo first-order kinetics of C3G and β-carotene in the simulated systems of different pH

表3 不同pH 值复合模拟体系中C3G 和β-胡萝卜素热处理过程中降解参数Table 3 Degradation parameters of C3G and β-carotene during heat treatment in the simulated systems of different pH
β-胡萝卜素体系中(图4g),随着温度上升,β-胡萝卜素的热降解速率增加,但其速率常数k的变化速度低于C3G,表明β-胡萝卜素在这一条件下的稳定性高于C3G。
热力学参数能够为热降解动力学提供有用的信息(表3)。焓变(△H)代表使反应发生的反应物所需的最少能量,它与反应物化学键的强度有关,化学键在反应过程中会发生破裂和生成[20]。C3G及β-胡萝卜素的△H 受温度变化影响较小,说明降解过程中的势垒大小与温度无关[21]。此外,由△H 均为正值可知,C3G 及β-胡萝卜素降解过程为吸热反应,反应温度越高,供应能量越多,越有利于活化络合物的形成。吉布斯自由能(△G)代表反应物的能量与活化状态之间的差异,可用于判断反应能否自发进行[20]。由表3 可知,体系中C3G及β-胡萝卜素热降解的吉布斯自由能在不同温度条件下变化不大(112.06~115.68 kJ/mol,109.73~123.10 kJ/mol),且△G 均为正值,表明C3G 及β-胡萝卜素降解反应为非自发反应。熵变(△S)代表反应体系中分子的混乱变化,它常与具有可以实际反应的能力的分子数量有关。△S 受温度变化影响较小,本试验中,C3G 及β-胡萝卜素△S 均为负值,说明过渡态的结构自由度低于反应物[22]。
复合模拟体系中,在不同pH 值条件下,C3G或β-胡萝卜素热降解的焓变相差很大,如以C3G为例,pH 6.0 体系的△H 为27.41~27.74 kJ/mol,而pH 2.0 则为62.61~62.94 kJ/mol。与单独体系相比,复合体系中C3G 的△H(79.98~80.31 kJ/mol)低于前者的△H(82.73~83.06 kJ/mol);而β-胡萝卜素单独体系的△H 为28.56~28.89 kJ/mol,比相同pH 值条件下复合体系中β-胡萝卜素焓大,这表明C3G 及β-胡萝卜素体系相较于复合体系,在热处理过程中需要克服更大的势垒[23]。pH 6.0 复合体系中C3G 的△S 的绝对值为233.70~234.68 J/mol,明显高于pH 3.5 时△S 的绝对值97.79~100.15 J/mol,这表明复合体系中C3G 在pH 3.5条件下对温度较不敏感。当环境pH 值较低时,初始系统与其自身热力学平衡之间的距离较短,体系中C3G 发生降解的概率较低[24]。而对于β-胡萝卜素,pH 6.0 复合体系△S 的绝对值为204.28~205.11 J/mol,明显低于pH 3.5 体系△S 的绝对值295.97~296.93 J/mol,表明β-胡萝卜素在pH 6.0条件下对温度较不敏感。复合模拟体系经加热后,二者的热反应学常数焓变△H、吉布斯自由能△G及熵变△S 与C3G 和β-胡萝卜素体系相比均未发生实质性变化,即经过复合后,二者的反应还是非自发的吸热反应。
2.3.1.2 不同pH 值对复合模拟体系色泽的影响 总色差△E(total color difference)结合了L*、a*、b*3 个指标变化情况,可直观反映模拟果蔬汁溶液的色泽变化[25]。由图5 可知,在相同pH 值条件下,△E 随着温度的升高而增加。随着pH 值的增加,总色差△E 呈逐渐增加的趋势,其中,pH 6.0 的复合模拟体系的总色差△E 远大于pH 2.0及3.5,这表明花色苷稳定性随着pH 值的升高而降低。

图5 pH 对模拟果蔬汁溶液加热前后总色差△E(a)和仿真色(b)Fig.5 Effect of pH on the color difference △E(a)and color swatches(b)of the simulated system before and after heating
2.3.2 不同糖种类对复合模拟体系热稳定性的影响
2.3.2.1 不同糖种类对复合模拟体系C3G 及β-胡萝卜素降解动力学的影响 蔗糖、果糖和葡萄糖体系中C3G 及β-胡萝卜素的热降解如图6 所示,由拟合常数R2均>0.87 可知,不同糖体系中的C3G 及β-胡萝卜素均符合一级动力学方程。对比每种糖50,70,90 ℃3 种温度下的反应速率常数k 可知,90 ℃下C3G 和β-胡萝卜热降解速率远远快于50 ℃和70 ℃。故在果蔬汁加工过程中应尽可能避免长时间高温热处理。而对比3 种糖的k可知,蔗糖体系下C3G 的降解速度快于葡萄糖,而慢于果糖。该试验结果与Rubinskiene 等[26]研究结果相似,可能的原因是蔗糖是二糖,故需要通过水解成葡萄糖和果糖才能形成糠醛,糠醛是引起花色苷降解的重要物质之一,故由蔗糖引起的花色苷降解速率介于葡萄糖和果糖之间。对于β-胡萝卜素,对比3 种不同糖体系的k 可知,所选用的3 种糖对β-胡萝卜素的稳定性影响较小。

图6 不同糖种类复合模拟体系中C3G 及β-胡萝卜素热降解一级动力学方程Fig.6 Thermal degradation pseudo first-order kinetics of C3G and β-carotene in the simulated systems of different sugar types
由表4 可知,不同糖种类复合模拟体系中的C3G 和β-胡萝卜素的△H 与△G 均为正值,添加不同种类的糖并未改变复合体系中C3G 和β-胡萝卜素的反应本质,即体系中C3G 和β-胡萝卜素降解还是非自发的吸热反应。

表4 不同糖种类复合模拟体系中C3G 和β-胡萝卜素热处理过程中降解参数Table 4 Degradation parameters of C3G and β-carotene during heat treatment in the simulated systems of different sugar types
2.3.2.2 不同糖种类对复合模拟体系色泽的影响 不同糖种类对模拟果蔬汁溶液加热后色泽变化的影响如图7 所示。加热处理后,模拟果蔬汁溶液的△E 均大于3,表明加热前后体系产生了肉眼可辨别的差异[27],不利于食品生产。此外,在90 ℃加热条件下,添加果糖体系的△E 显著增大,可能的原因是果糖在高温加热下产生大量糠醛,花色苷降解,从而导致色泽发生变化[26]。
采用SPSS15.0统计学软件进行分析,计量资料以均数±标准差(x±s)表示,组内比较采用单因素方差分析,组间比较采用成组t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。

图7 糖种类对模拟果蔬汁溶液加热前后总色差△E(a)和仿真色(b)Fig.7 Effect of sugar type on the color difference △E(a)and color swatches(b)of the simulated system before and after heating
2.3.3 不同糖浓度对复合模拟体系热稳定性的影响
2.3.3.1 不同糖浓度对复合模拟体系C3G 及β-胡萝卜素降解动力学的影响 不同浓度蔗糖的模拟体系中C3G 及β-胡萝卜素的热降解如图8 所示,由拟合常数R2均>0.92 可知,不同糖浓度中的C3G 及β-胡萝卜素均符合一级动力学方程。蔗糖对花色苷的稳定性的影响较复杂。一方面,糖可通过减小水分活度,进而减慢花色苷二苯基苯并吡喃阳离子发生水合作用生成醇形假碱结构的速率,从而在一定程度上抑制花色苷的降解,表现出对花色苷的保护作用[28]。另一方面,糖热降解生成降解产物,如糠醛,羟甲基糠醛等,可与花色苷缩合生成褐色物质,加速其降解[29]。在本研究中发现,随着糖含量的不断增加,体系中C3G 的活化能Ea 不断上升,表明C3G 稳定性随着糖浓度的增加而提高,即糖对花色苷表现出的保护作用大于其降解作用。与不同糖浓度对体系中C3G 稳定性影响的结果相反,随着糖浓度的增加,β-胡萝卜素的活化能Ea逐渐下降,即高浓度糖对β-胡萝卜素具有促进降解的作用,其可能的原因是由于糖产生的热降解的产物如呋喃型化合物等具有较强的亲电反应能力,能攻击β-胡萝卜素电子云而使其发生氧化降解[30]。

图8 不同糖浓度复合模拟体系中C3G 和β-胡萝卜素热降解一级动力学方程Fig.8 Thermal degradation pseudo first-order kinetics of C3G and β-carotene in the simulated systems of different sugar contents
由表5 可知,复合模拟体系中C3G 和β-胡萝卜素的焓变(△H)分别随着蔗糖浓度的增加而呈现逐渐升高和降低的趋势,表明C3G 在高浓度蔗糖复合体系中需要克服更大的势垒,而β-胡萝卜素则在低浓度蔗糖复合体系中需要克服更大的势垒。由所有样品组的△H 及△G 均为正值可知,添加不同浓度的蔗糖并未改变复合体系中C3G 和β-胡萝卜素的反应本质,即还是吸热的非自发反应。

表5 不同蔗糖浓度复合模拟体系中C3G 和β-胡萝卜素热处理过程中降解参数Table 5 Degradation parameters of C3G and β-carotene during heat treatment in the simulated systems of different sugar contents
2.3.3.2 不同糖浓度对复合模拟体系色泽的影响 不同糖浓度对模拟果蔬汁溶液加热前后色泽变化的影响如图9 所示。随着蔗糖浓度及温度的增加,△E 逐渐增加,其中,在90 ℃加热的条件下,添加12%蔗糖的模拟果蔬汁溶液△E 远大于无糖及添加5%蔗糖的体系,且由图9b 可知,其溶液颜色退减最为明显,因此应尽量避免富含花色苷的高糖产品在生产过程中高温长时加热。

图9 糖浓度对模拟果蔬汁溶液加热前后总色差△E(a)和仿真色(b)Fig.9 Effect of sugar concentration on the color difference △E(a)and color swatches(b)of the simulated system before and after heating
2.4 糖对复合模拟体系光稳定性的影响
由于果蔬汁产品可通过选择不同材质的包装材料避免光降解的过程,因此本试验拟采用pH 3.5 的模拟体系,初步探究光照对C3G 体系、β-胡萝卜素体系、复合体系及含糖复合体系光谱特性及光降解动力学的影响,结果如图10 所示。随着光照时间的增加,所有体系的最大吸收波长的吸光度值逐渐下降,其中,光照8 h 后,C3G 体系、复合体系及含糖复合体系中C3G 的降解率分别为27.84%,32.27%和37.74%,而β-胡萝卜素体系、复合体系及含糖复合体系中β-胡萝卜素的降解率分别为19.90%,29.57%和37.98%,即光照对体系中花色苷及类胡萝卜素均具有降解作用。可能的原因是光照引起花色苷降解生成C4 羟基的中间产物,该中间产物在C2 位上水解开环,最终生成査尔酮,査尔酮快速降解生成苯甲酸及2,4,6-三羟基苯甲醛等产物[25]。对比单独体系与复合体系中C3G 和β-胡萝卜素的反应常数k 可知,复合体系中的C3G 和β-胡萝卜素在光照条件下的降解速率大于C3G 和β-胡萝卜素体系,而含糖体系中的C3G 和β-胡萝卜素的降解速率大于无糖体系,可能的原因是由于光照产生热量,使得样品升温,蔗糖发生降解,降解产物如糠醛等与花色苷缩合,或者因攻击β-胡萝卜素电子云使其发生氧化降解,进而使得花色苷和类胡萝卜素降解速率增大[29-30]。因此,基于上述试验结果,对于富含花色苷及类胡萝卜素的果蔬汁产品,采用避光包材,并在实际生产加工及储存过程中尽量避免光照。

图10 光照对复合体系花色苷稳定性的影响Fig.10 Effect of illumination on the stability of anthocyanin in the simulation system
3 结论
本研究通过构建不同条件的果蔬汁模拟体系,探究了果蔬汁中物化特性及主要物质成分对模拟果蔬汁中C3G 及β-胡萝卜素稳定性的影响。其中,Fe3+对花色苷具有破坏作用,高浓度的Ca2+具有增色作用。在不同pH 值、糖种类及糖浓度的模拟体系中,C3G 和β-胡萝卜素热降解均符合一级反应动力学,此外,通过热力学分析可知:两者的降解反应均为吸热的非自发反应。通过对比复合模拟体系及C3G 和β-胡萝卜素体系中的C3G与β-胡萝卜素的反应活化能Ea可知,复配对C3G的稳定性无显著影响,但降低了β-胡萝卜素稳定性。
试验表明,不同糖种类及浓度对复合模拟体系中的C3G 和β-胡萝卜素热降解的影响机制不相同。其中,糖类对花色苷的促进降解作用影响依次为:果糖>蔗糖>葡萄糖,可能的原因是蔗糖在产生降解产物糠醛前,需要水解成果糖和葡萄糖。随着蔗糖浓度升高,体系中C3G 的活化能Ea不断上升,表明C3G 稳定性随着糖浓度的增加而提高。这种现象是由于高浓度糖能够降低体系中溶解氧及水分活度而使C3G 更加稳定。然而,对比3 种糖对体系中β-胡萝卜素活化能Ea可知,所选用的3 种糖对β-胡萝卜素的稳定性无显著影响。且随着蔗糖浓度的增加,β-胡萝卜素的活化能Ea逐渐下降,表明高浓度糖对β-胡萝卜素具有促进降解的作用,这与不同浓度糖对C3G 的稳定性结果相反。造成这一现象的原因可能是糖类降解产物具有较强的亲电反应能力,易攻击β-胡萝卜素电子云而使其发生氧化降解。
此外,对比体系加热前后色泽的变化可知,在一定pH 值条件下,随着温度的升高,△E 逐渐增大;随着pH 值的增大,△E 逐渐增大。对比加糖与不加糖样品,前者的总色差△E 均大于后者,这表明加糖可加速体系加热后色泽的变化。最后,通过对比单独体系与复合模拟体系中C3G 和β-胡萝卜素的反应常数k 可知,复配及添加糖类使得C3G 和β-胡萝卜素的光稳定性均下降。
通过系统的研究不同物化特性及主要物质成分对模拟体系中花色苷及类胡萝卜素的降解规律,可为进一步探究真实复合果蔬汁真实体系加工过程中花色苷及类胡萝卜素降解机制提供理论依据,同时为富含花色苷及类胡萝卜素的果蔬汁产品的品质保持加工提供了可借鉴的思路。

