基于Illumina 高通量测序分析相温贮藏对黄花菜表面微生物的影响
张 鹏,刘英杰,贾晓昱,薛友林,李江阔*
(1 天津市农业科学院农产品保鲜与加工技术研究所 天津 300384 2 国家农产品保鲜工程技术研究中心(天津)农业农村部农产品贮藏保鲜重点实验室 天津市农产品采后生理与贮藏保鲜重点实验室 天津 300384 3 辽宁大学轻型产业学院 沈阳 110036)
黄花菜(Hemerocallis citrina Baroni)又称金针菜、柠檬萱草,是我国特有的药食同源珍有蔬菜[1]。截至2020 年底,我国黄花菜种植面积占全球总面积约98%,是山西大同、甘肃庆阳、宁夏吴忠、陕西大荔等地区重要种植经济作物[2]。黄花菜味质鲜美,肉质厚,口感佳,营养丰富,其所含的碳水化合物、蛋白质、脂肪分别占到60%,15%,2%[3]。现代药理研究表明,黄花菜的次级代谢产物如多酚和黄酮具有抗抑郁、抗癌、抗菌、抗炎、抗氧化和保肝功效[4]。它既是佐餐佳品又是药用保健食品,深受人们的喜爱。尤其是种植地当地的消费者,喜欢吃新鲜的黄花菜,然而黄花菜不耐储,保鲜期极短,久贮后表面会生绒毛,产生腐烂,在运输和贮藏中易霉变[5]。霉变会对黄花菜的产量和商业价值产生影响,同时霉菌会产生毒素,危害人体健康。弄清贮藏期间黄花菜表面的主要微生物,寻找相关抑制方法,对黄花菜产业的发展十分重要。
高通量技术作为一种非培养技术,在食品微生物学领域应用的越来越多[6]。它可以检测食品微生物的群落结构,具有测序通量高、结果精准等优点[7],在基因组测序、功能基因组学、表观基因组学等方面广泛应用[8-10]。目前,基于16S/18S/ITS 的二代高通量测序技术已较为普遍地应用于果蔬微生物菌群的多样性研究。Zhang 等[11]采集14 个地区的28 个核桃样品,对细菌16S rRNA 的V4 区进行高通量测序分析,研究细菌在核桃壳表面的分布,得到蓝藻门是核桃壳表面主要致病菌。李婕等[12]分别运用16S rRNA 高通量测序技术和平板分离培养法探究双孢蘑菇在贮藏温度4 ℃的环境下,菇体表面细菌的种群结构及其变化情况,结果显示,随贮藏时间延长,菇体表面细菌菌群丰度逐渐增加,其中,主要致腐菌为假单胞菌(Pseudomonas spp)。然而,目前基于高通量技术对黄花菜表面微生物的研究较少,对引起黄花菜霉变的主要菌群尚不清楚。
本试验以微环境气调箱为载体,将采收的黄花菜分组放入冰箱(4 ℃±1 ℃)、冷库(0 ℃±0.5 ℃)及相温环境(-0.5 ℃±0.1 ℃)中。在进行品质检测的基础上,通过对其表面真菌、细菌的宏基因组检测,确定主要微生物种群,同时研究抑制黄花菜褐变与霉变的保鲜方法。
1 材料与方法
1.1 试验材料
黄花菜产自甘肃庆阳,采摘时挑选成熟度一致、无病虫害、无机械损伤的黄花菜作为试验材料。
冰箱,无锡松下冷机有限公司;冷库,国家农产品保鲜工程技术研究中心(天津);500 mL 蓄冷剂,河南迪赛尔商贸有限公司;59.5 L 精准温控保鲜箱,上海佳寰实业有限公司;7.4 L 微环境气调箱,宁波国嘉农产品保鲜包装技术有限公司。
1.2 试验方法
1.2.1 样品处理 挑选无褐变现象、无开花的黄花菜,装入微环境气调箱中,每箱容量为1 000 g(±5 g),共装9 箱,分为3 组,每组3 箱。A 组:置于冰箱(4 ℃±1 ℃)贮藏;B 组:置于冷库(0 ℃±0.5℃)贮藏;C 组:置于内有16 个500 mL 蓄冷剂盒的精准温控保鲜箱中,放入冷库贮藏,控制温度在-0.5 ℃±0.1 ℃。7 d 后拍照,测定褐变率和腐败率,并随机选取约70 g 黄花菜果实用液氮进行冻样,放于超低温(-80 ℃)冰箱留存。混样提取DNA分别建库,提取DNA 样本。
1.2.1.1 褐变率测定 每组选取30 个黄花菜进行褐变级别判定,以无褐变为0 级,褐变面积小于10%为1 级,10%至30%为2 级,大于30%为3级,按褐变率=∑(褐变级别×该级别根数)/(最大褐变级别×总根数)计算。
1.2.1.2 DNA 提取与PCR 扩增 使用CTAB 法提取黄花菜样本中DNA,用无菌水将DNA 样本稀释至1 ng/μL,以稀释后的黄花菜表面微生物宏基因组DNA 为模板,使用高效高保真酶、PhusionHigh-Fidelity PCR Master Mix with GC Buffer 及带Barcode 的特异引物进行PCR 扩增。
1.2.1.3 PCR 产物的混样和纯化 用2%琼脂糖凝胶电泳检测PCR 产物,合格后进行磁珠纯化及等量混样,再次电泳检测后用胶回收试剂盒回收。
1.2.2 测序数据处理 从下机数据中依据Barcode 序列和PCR 扩增引物序列拆分出各组黄花菜表面微生物DNA 样本数据,再用FLASH[13]拼接每个黄花菜DNA 样本的reads 后得到原始黄花菜Tags 数据,之后再过滤处理[14]。根据Caporaso 等[15]的Tags 质量控制流程进一步处理数据,将原始黄花菜Tags 数据从第一个碱基数长度值为3(阈值≤19)的碱基位点断开,再过滤碱基长度小于75%的黄花菜Tags 数据[16],将得到的DNA 序列与物种注释数据库进行比对检测,去除最终产生的嵌合体序列DNA[17]。
1.3 数据处理
1.3.1 数据作图 利用Excel 工作表进行数据作图。
1.3.2 OTU 聚类和物种注释 用Uparse 算法[18]以一致性为97%的原则将黄花菜表面微生物DNA样本序列聚类成为OTUs(Operational Taxonomic Units),利用Qiime 软件中的blast 方法[19]与Unit数据库[20]进行微生物样本的物种注释分析,使用MUSCLE[21]软件进行黄花菜微生物DNA 的快速多序列比对。
1.3.3 样本复杂度分析 用Qiime 软件计算各项指数,R 软件绘制各种曲线及分析Alpha 多样性指数组间差异。
1.3.4 多样本比较分析 做Metastats 分析时使用R 软件,在得出p 值后,再针对p 值用Benjamini and Hochberg False Discovery Rate 方法进行修正,最终得到q 值[22]。进而用R 软件绘制PCA 图及分析Beta 多样性指数组间差异。
2 结果分析
2.1 不同处理黄花菜感官图片和褐变率分析
由图1 可看出,7 d 时3 组黄花菜均出现了不同程度的褐变,A 组黄化褐变最为严重,个别出现微微开花现象,是3 组中感官品质最差的,B 组相较于A 组褐变程度较轻,C 组少数黄花菜尖部出现褐变,部分未黄化,感官品质优秀,说明相温贮藏在黄花菜感官品质的保持方面效果最佳。

图1 不同处理黄花菜7 d 的感官图片Fig.1 Sensory pictures of 7 d of different treatments of daylily
图2 显示的是不同处理黄花菜7 d 时褐变率情况,A 组黄花菜的褐变率高于35%,与其它两组差异显著(P<0.05),表明A 组黄花菜在贮藏期间感官品质下降得最快,B 组和C 组则下降得较为缓慢,两组褐变率均低于15%,说明冷库贮藏和相温贮藏对黄花菜贮藏期间感官品质的保持发挥了有效作用,且褐变率与感官图片相符。

图2 不同处理黄花菜7 d 褐变率Fig.2 The browning rate of daylily in different treatments at 7 days
2.2 物种注释
对Illumina NovaSeq 测序得到的有效数据如下:真菌样本中,A、B、C 组黄花菜样品平均测得232,236,238 条tags,3 组样品过滤嵌合体后的有效百分比分别为70.91%,71.56%,73.14%。细菌样本中,A、B、C 组黄花菜样品平均测得413,406,406 条tags,3 组样品过滤嵌合体后的有效百分比分别为70.05%,77.52%,74.29%。
稀释曲线可以描述不同处理组黄花菜组内表面微生物DNA 样本多样性。稀释曲线是黄花菜表面DNA 测序数据量与对应的微生物物种数的数据图,数据量越合理,稀释曲线则越趋向平坦,同时,同一测序深度中OTU 数越多,样本多样性越高。如图3、图4 所示,各组处理黄花菜的稀释曲线随着深度的增加趋向平坦,说明此次测序数据足够反映黄花菜的微生物群落组成。真菌测序深度为60 000 时,OTU 数:B 组>C 组>A 组,说明B组黄花菜的表面真菌多样性高于其它两组,细菌测序深度为50 000 时,OUT 数:A 组>C 组>B 组,说明A 组黄花菜的表面细菌多样性高于其它两组,C 组黄花菜表面真菌及细菌多样性均为最低,证明相温贮藏可以有效抑制黄花菜真菌及细菌的生长,抑制其多样性。

图3 不同处理黄花菜真菌稀释曲线和等级聚类曲线Fig.3 The sparse curve and rank abundance curve of daylily fungi in different treatments

图4 不同处理黄花菜细菌稀释曲线和等级聚类曲线Fig.4 Bacterial sparse curve and rank abundance curve of daylily in different treatments
同样的,等级聚类曲线也可以表述不同处理组黄花菜组内表面微生物DNA 样本多样性。等级聚类曲线横坐标是黄花菜微生物样本中的OTUs按相对丰度排序编号,纵坐标是微生物样本相对丰度,等级聚类曲线趋势越平缓,黄花菜微生物物种分布越均匀,而黄花菜微生物物种的丰富度越高,等级聚类曲线在横坐标上的跨度越大[23]。由图3、图4 可知,A 组黄花菜表面微生物样本曲线在横轴上的跨度最大,曲线最平缓,说明其真菌种类分布的均匀程度和丰富度高于其它两组处理,同理,B 组黄花菜的细菌种类分布的均匀程度和丰富度高于其它两组处理,相比之下,C 组样本真菌细菌丰富度、均匀度最低,进而得出相温贮藏处理可使表面微生物生长的丰富度降低。
2.3 基于OTU 的花瓣图分析
如图5 所示,真菌样本中,在A 组黄花菜表面共有543 个OTUs,A 组特有142 个OTUs;B 组黄花菜表面共有764 个OTUs,B 组特有302 个OTUs;C 组黄花菜表面共有606 OTUs,C 组特有176 个OTUs。B 组样本序列所得真菌OTU 数量最多,C 组其次,A 组最少。如图5 所示,细菌样本中,在A 组黄花菜表面共有843 个OTUs,A 组特有672 个OTUs;B 组黄花菜表面共有199 个OTUs,B 组特有59 个OTUs;C 组黄花菜表面共有263 OTUs,C 组特有100 个OTUs。冰箱贮藏的A组样本序列所得细菌OTU 数量最多,含有最丰富的细菌种群,且与其它两组差异较大,C 组其次,B 组最少。

图5 不同处理黄花菜真菌和细菌OTU 花瓣图Fig.5 Different treatment of daylily fungus and bacteria OTU petal map
2.4 属水平注释概况
根据不同处理组黄花菜表面微生物物种注释结果,选取在属水平上黄花菜微生物相对丰度排名靠前的10 个物种名称和其相对丰度,以及其它物种占比,用这些数据制作成柱形图,由图6 所示,可以得到在属水平上各组黄花菜表面相对丰度较高的真菌群落及其比例为:座囊菌(31.54%,45.77%,53.37%)、小葡萄菌(19.72%,13.53%,9.09%)、银耳菌(6.84%,19.24%,8.05%)、散囊菌(0.22%,1.15%,0.16%)、子囊菌(0.54%,1.43%,0.80%),由图6 可知,蓝细菌(20.61%,63.09%,69.70%)、γ-变形杆菌(38.84%,2.04%,0.33%)、α-变形杆菌(35.65%,34.21%,28.91%)、芽孢杆菌(1.76%,0.12%,0.08%)、梭菌(1.70%,0.25%,0.44%)是不同处理黄花菜细菌群落在属水平上的优势菌群。
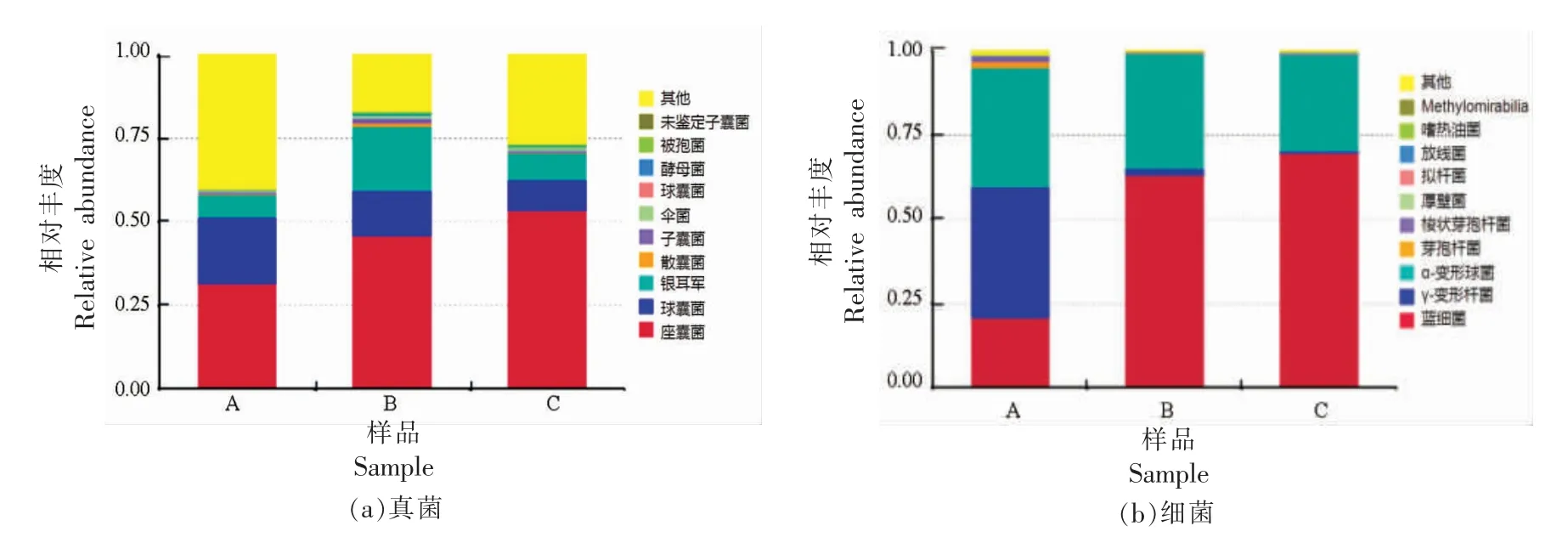
图6 不同处理黄花菜真菌和细菌在属水平上的物种相对丰度柱形图Fig.6 Histogram of relative abundance of daylily fungi and bacteria in different treatments at the genus level
2.5 样本复杂度分析
用Alpha Diversity 分析不同处理黄花菜表面的微生物群落多样性[24],得到各组黄花菜表面微生物种群及群落内物种的丰富度和多样性。统计表中涉及到4 个指数,Shannon 指数是样品中的分类总数及其占比,物种分布越均匀,群落多样性越高,Shannon 指数越大。Simpson 指数是群落内物种分布的多样性和均匀度,Simpson 指数值越大,群落多样性越低。Chao1 指数是群落样品中包含的物种总数,ACE 指数是群落中OTU 数目。
表1 及表2 中所有结果Coverage 指数为0.99或1.00,说明不同处理黄花菜样品中各微生物群种序列基本都已被测出,结果可以反映黄花菜样本的测序情况。A、B、C 3 组检测出的真菌物种数依次为:292,404,323,检测出的细菌物种数依次为:344,120,128。根据表3 里的Shannon 指数,真菌群落多样性及物种分布均匀程度由高到低依次为:B 组、C 组、A 组,Simpson 指数说明群落内物种多样性及均匀度由高至低为:B 组、A 组、C 组。同样的,由表4 可得,Shannon 指数证明细菌群落多样性和物种分布均匀度最高为A 组,B 组次之,C组最低,Simpson 指数证明细菌群落内结果由高到低为:A 组、B 组、C 组。

表1 不同处理黄花菜真菌Alpha Indices 统计表Table 1 Statistical table of alpha indices for different treatments of daylily fungi
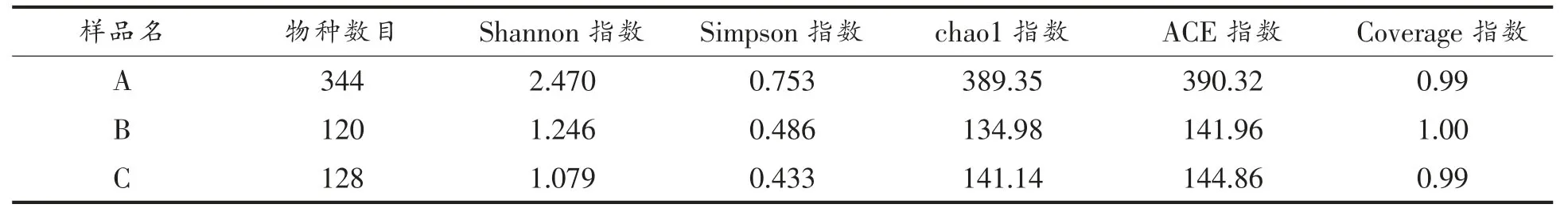
表2 不同处理黄花菜细菌Alpha Indices 统计表Table 2 Statistical table of alpha indices for different treatments of daylily bacteria
2.6 多样本比较分析
多样本比较分析是通过制作黄花菜表面微生物样本DNA 的PCA 图及Beta 多样性指数组间差异分析,比较各组间黄花菜样本的表面微生物群落信息[25-26]。根据黄花菜微生物物种注释结果,选取丰度排名靠前的10 个属,根据其在每个黄花菜表面微生物DNA 样本中的丰度信息,将同类OTUs 信息制作成聚类热图,再进行主成分分析。由图9、图10 所示,可以直观地显示不同处理黄花菜样品中真菌及细菌的差异。
如图7,根据黄花菜表面微生物OTU 的丰度数据,绘制黄花菜微生物属水平上的数据热图,热图中不同颜色的梯度反映出不同处理组黄花菜表面微生物的群落相似性及物种聚类关系。不同处理的3 组黄花菜真菌群落结构只有1 个聚类:A组和C 组聚为一类,B 组则分散不能聚类,说明不同样品间真菌群落存在一定的差异性,A 组和C组群落结构相似度较高。主成分分析(PCA,Principal Component Analysis)[27]是依据降维思维提取出现有的有效数据中最关键元素的一种方法[28]。不同处理组黄花菜的样本DNA 在PCA 图中的距离越近,其微生物群落结构越相似。结果也显示黄花菜样品A 组、C 组距离较近,即A 组黄花菜和C组黄花菜表面真菌群落结构更相似。

图7 不同处理黄花菜真菌品种多样本比较分析Fig.7 Comparison and analysis of multi-samples of fungus varieties of daylily
图8 为不同处理黄花菜细菌样本分析比较,不同处理的3 组黄花菜细菌群落结构可分为1 个聚类:B 组和C 组聚为一类,A 组则分散不能聚为一类,说明A 组与其它两组真菌群落存在一定的差异性,B 组和C 组群落结构较接近。主成分分析结果也显示样品B 组、C 组距离较近,与聚类热图结果一致。

图8 不同处理黄花菜细菌品种多样本比较分析Fig.8 Comparative analysis of multiple samples of daylily bacteria in different treatments
3 结论
综合对比得出,稀释曲线和等级聚类曲线证明相温贮藏可以有效抑制表面微生物的多样性生长,在属水平上真菌的优势菌群有:座囊菌(Dothideomycetes)、小葡萄菌(Microbotryomycetes)、银耳菌(Tremellomycetes)、散囊菌(Eurotiomycetes)、子囊菌(Sordariomycetes),属水平上黄花菜细菌的优势菌群为:蓝细菌(Cyanobacteriia)、γ-变形杆菌(Gammaproteobacteria)、α-变形杆菌(Alphaproteobacteria)、芽孢杆菌(Bacilli)、梭菌(Clostridia)。不同的贮藏温度对黄花菜表面细菌多样性及群落结构具有一定的影响,冷库贮藏和相温贮藏黄花菜细菌群落结构相似度较高,相比之下冰箱贮藏处理则有很大差异。

