碳热还原法制备碳化硼的热力学研究
李 欣, 牛 群, 陈 滨, 乔 佳, 程恩庆, 邢鹏飞
(1.江苏大学 绿色材料与冶金研究院, 江苏 镇江 212013;2.辽宁省国家新型原材料基地建设工程中心, 沈阳 110819; 3.东北大学 冶金学院, 沈阳 110819)
碳化硼(B4C)具有仅次于金刚石、立方氮化硼的高硬度(莫氏硬度9.32).此外,它还具有高熔点(2 450 ℃)、低密度(2.52 g/cm3)、较好的化学惰性、优良的电学性能及中子吸收性能等优点[1-4],因此被广泛用作LED 底衬的研磨材料[5-6]、军工防弹材料、核工业中子控制和屏蔽材料、工程陶瓷材料及高级耐火材料等.近年来,随着LED 产业、军工防弹产业和核电产业的大力发展,高品质B4C 粉体的需求量大幅增加.
碳热还原法制备B4C 因其工艺简单,是目前应用最广泛且可实现工业化大规模生产的方法[见式(1)][7-8].但该工艺反应过程较为复杂,会产生较多的中间化合物.其中,易挥发的B2O3及一些硼化物气体(如B2O2,BO 等)的产生,均会直接影响到B4C 的还原过程及品质[9-11].另外,高品质B4C 的制备不仅取决于反应物配比,同时也受还原温度、保温时间及炉内气压等因素影响.目前,有众多学者对碳热还原法制备B4C 进行研究,但多集中于真空条件下工艺参数(原料配比、反应温度和反应时间等)的研究,并未对体系的热力学及反应机理进行系统分析,无法为高品质B4C 的高效制备提供充足依据和有效支撑.
本文中采用FactSage 热力学软件分别对B-O体系和B-C-O 体系进行热力学研究,确定B-O 体系和B-C-O 体系状态图,并系统分析B4C 制备过程中主、副反应及理论反应温度;阐明B2O3-C 体系的优势区域图,并解析温度和气相分压对制备B4C 的作用规律,以此明确B4C 生成的优化区域和热力学条件,提出还原反应的热力学模型;在热力学研究的基础上,建立碳热还原制备B4C 的反应机理,并进行实验验证.该研究结果对碳热还原法制备高品质B4C 具有理论指导意义和实际应用价值.
1 热力学研究
1.1 热力学研究方法
在恒温恒压状态下,化学反应过程沿吉布斯自由能减少的方向自发进行,直至反应结束[12].在标准状态下,吉布斯自由能的大小可描述反应发生的可能性或发展趋势.由热力学第二定律可知,在恒温恒压条件下,吉布斯自由能可表示为
式中:ΔHΘT,ΔSΘT和ΔCP分别为温度T下物质的标准焓变(J/mol)、物质的标准熵变[J/(K·mol)]、恒压热容差[J/(K·mol)].
积分法求出的ΔGΘ与T的关系式一般为多项式,但通常会把ΔGΘ与T的多项式简化为二项式.在冶金计算中,多采用ΔGΘ=A+BT的二项式形式,可将斜率看作某反应式自由能变化对温度的敏感性.为简便计算,可根据式(3)计算各反应在不同温度下的ΔGΘ.
在得到不同温度T下的后,令X=T,Y=ΔGΘ,利用以下两个公式可拟合得到各化学反应的关系式.
FactSage 是一款集多种计算功能于一体的综合性热力学计算软件,该软件的计算过程是基于系统吉布斯自由能的最小化原理,其中,最小吉布斯自由能法是求解热力学平衡态的常用方法之一[13].在给定的压力、温度和系统组成的条件下,总的吉布斯自由能最小时,系统处于热力学平衡状态.
1.2 实验方法
以硼酐(B2O3,质量分数99%)和石油焦(CP,固定碳质量分数90%)为原料,将B2O3和CP粉按原料配比(质量比) 3.3 ∶1 放入混料罐内,球磨5 h 至混合均匀,然后在30 MPa 单轴压力下,压制成Φ25 mm 的圆柱体.在80 ℃下干燥6 h,随后将圆柱体置于高纯石墨坩埚内,真空碳管炉内通入Ar 气.在不同温度(1 550,1 700,1 850 ℃)下反应30 min 进行碳热还原实验,待实验结束冷却至室温后,对实验产物进行物相结构和微观形貌的表征与分析.
1.3 分析检测
采用X 射线衍射仪(D8 ADVANCE,德国布鲁克)和Cu-Kα 辐射(k=0.154 06 nm)确定物相组成.利用场发射扫描电子显微镜(SIGMA300,德国蔡司)研究产物粉末的微观形貌,并采用能谱分析(SIGMA300,德国蔡司)确定产物组成及含量.
2 分析与讨论
2.1 B-O 和B-C-O 体系的热力学分析
采用FactSage 软件对B-O 体系进行热力学研究,可得到B-O 体系状态图,如图1 所示.
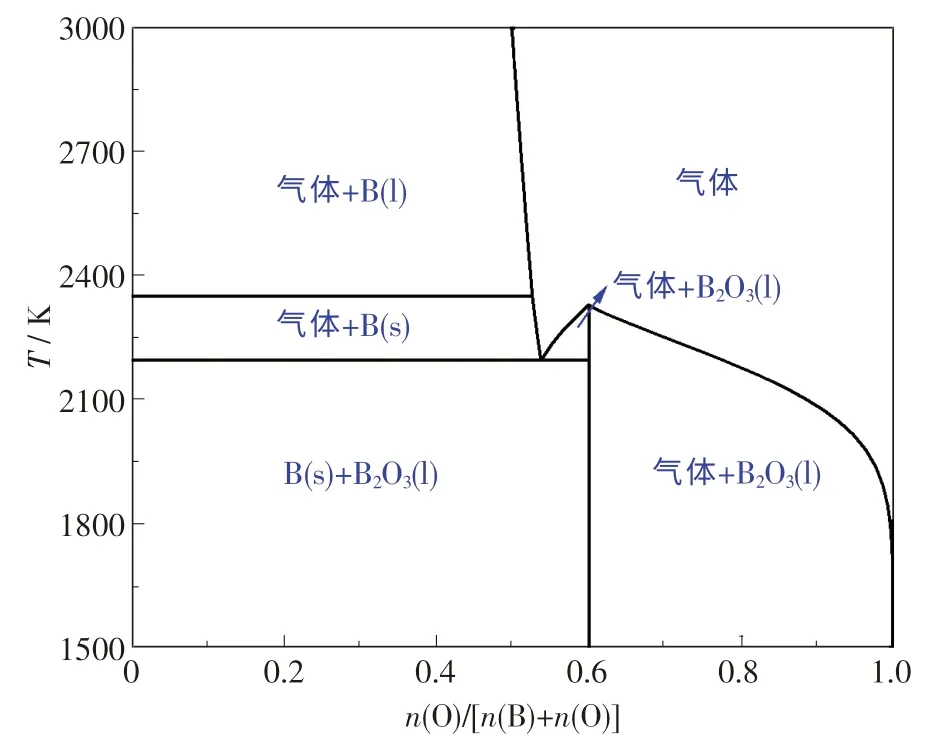
图1 B-O 体系状态图Fig.1 Binary phase diagram of B-O system
由图1 可知:当n(O)/[n(B)+n(O)]为0 ~0.6、温度低于1 921 ℃时,主要产物为B(s)和B2O3(l);当温度由1 921 ℃升高至2 077 ℃时,产物主要为B(s)和混合气体;当n(O)/[n(B)+n(O)]>0.6、温度低于2 049 ℃时,主要产物为B2O3(l)和混合气体;当温度高于2 049 ℃时,主要产物为混合气体.综上分析,B-O 体系中存在的产物主要有B(s),B2O3(l)和混合气体,其中混合气相组成可能为B2O3,B2O2或BO 等.Inghram 等[10]研究表明:在还原条件下,液态B2O3主要以亚氧化硼(B2O2)形式挥发;当温度为1 227 ℃时,气相中B2O2与B2O3的摩尔比为7 ∶1.Rentzepis 等[11]提出,在B2O3-C 体系中,随温度的升高,B2O3将发生由固态向液态以至气态的转变.一般情况下,B2O3在327 ℃开始软化,453 ℃熔化,当高于1 277 ℃时,将与C 反应形成B2O2.综上可知,B2O2是B-O 体系重要的气相产物之一.
原料B2O3与C 通过反应(6)可形成B2O2,同时还可以满足ΔGΘ=644.22 - 0.311 02T+0.019 147Tlg[PCOPB2O2/(PΘ)2],可见降低气相分压能降低反应(6)的起始反应温度.当分压由101.325 kPa 降至101.325 Pa 时,起始反应温度则由1 791 ℃急剧下降到1 474 ℃.当压力低于1.013 Pa、温度高于1 277 ℃时,反应(6)在热力学上是可行的,这与文献[11]的研究结果相吻合.综上分析可知,提高温度和降低压力均有利于B2O2气体的形成.
使用FactSage 软件对B-C-O 体系进行热力学分析,可得到B-C-O 体系状态图,如图2 所示.由图可知,随着n(C)/[n(B2O3)+n(C)]和温度的变化,产物也发生变化.当温度低于1 561 ℃时,体系未发生化学反应,仅有B2O3由固态熔化为液态.当温度高于1 561 ℃时,B2O3与C 开始发生反应,形成B4C,并伴随着气体产生.当温度提高至1 867 ℃,n(C)/[n(B2O3)+n(C)]<0.77 时,主要产物为B2O3(l),B4C(s) 和气体.当0.77 <n(C)/[n(B2O3) +n(C)]<1 时,产物组成为C(s),B4C(s)和气体,这主要是由C 含量提高所致.当 温 度 由 1 867 ℃升 高 至 1 961 ℃,n(C)/[n(B2O3)+n(C)]<0.41 时,产 物则 由B2O3(l),B4C(s)和气体变为B2O3(l)和气体,这可能是由于C 含量减少,多余的B2O3(l) 与B4C(s)发生反应产生气体,B4C 则被消耗掉.在此温度下,当n(C)/[n(B2O3)+n(C)]由0.41 提高至0.66 时,产物由气体和B2O3(l)变为气体和B(s),这可能是随着C 含量的增加,C 与B2O3(l)发生还原反应形成单质B,当继续增加至0.77时,单质B 与C 发生化合反应形成目标产物B4C.综上所述,B-C-O 体系是一个复杂的体系,随着n(C)/[n(B2O3)+n(C)]和温度的变化,B2O3与C,B4C,B 均会发生一系列复杂的反应,并形成不同的反应产物.
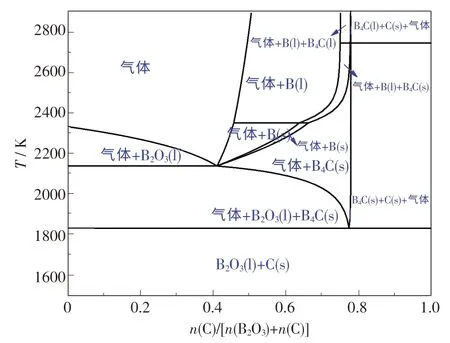
图2 B-C-O 体系状态图Fig.2 Phase diagram of B-C-O system
2.2 B-C-O 体系的优势区域图分析
对碳热还原法制备B4C 的B-C-O 体系及其优势区域图进行热力学分析,可确定适宜的反应条件,并为后续还原反应提供相关的理论依据,这具有重要的理论与实践意义.通过分析B-C-O 体系状态图可知,B-C-O 体系中存在的凝固相主要有B4C、单质C 和单质B,而气相主要有B2O2和CO.表1 列出了B-C-O 体系中存在的主要反应式及其相关的ΔG~T关系式.

表1 B-C-O 体系中各反应式的吉布斯自由能ΔG 与温度T 的关系式Table 1 Relationship between ΔG and T of reactions in B-C-O system
为了探讨B2O2和CO 等气体对凝固相B4C、单质C 及单质B 生成的影响,利用表1 中各反应的吉布斯自由能和温度的关系式,从热力学角度分别绘制出不同分压和温度下B-C-O 体系的优势区域图,结果如图3 和图4 所示.

图3 不同B2O2 分压下B-C-O 体系的优势区域图Fig.3 Predominance diagram at different B2O2 partial pressures for B-C-O system
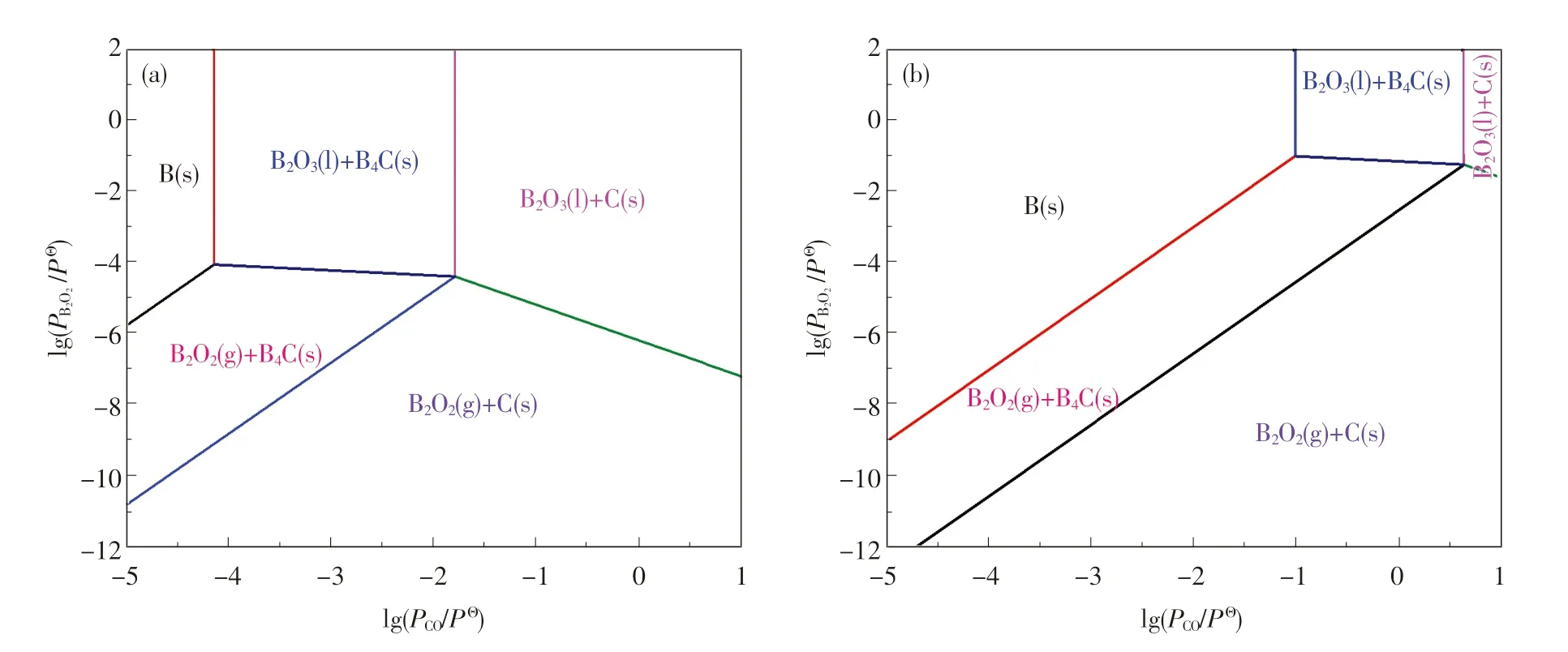
图4 不同温度下B-C-O 体系的优势区域图Fig.4 Predominance diagram at different temperatures for B-C-O system
从图3(a)中可看出,CO 气体分压对B2O3,B,C,B4C 的稳定存在区域有显著影响.随着CO分压的降低,B-C-O 体系中稳定存在的物相分别为B2O3(1)+C(s),B2O2(g)+C(s),B2O2(g)+B4C(s),B2O3(1)+B4C(s),B(s).当B2O2气体的分压由101.325 Pa 降至1.013 25 Pa 时,稳定物相的共存区域也随之发生变化,B2O3(1)+C(s),B2O3(1)+B4C(s),B(s)的共存区域逐渐缩小,而B2O2(g)+C(s),B2O2(g)+B4C(s)的共存区域增大,这说明B2O2是B-C-O 体系中重要的气态产物,它可能会参与到B4C 的制备反应,这一结论也与文献[14]的研究结果相吻合.
同时,B2O2气体的存在也可通过图4 得到验证.随着碳热还原反应的进行,B2O3先被C 还原形成B2O2气体[见反应(6)],B2O2气体再与C反应形成B4C[见反应(12)].此外,反应对CO 分压的要求也逐渐提高,只有当CO 分压极低(10.325 Pa)时,才有可能形成单质B.结合图3 和图4 可知,B4C 比B 更易形成,而B 可能是B4C与B2O3或B2O2进一步反应所形成的[见反应(13)或(14)].从热力学角度进行分析,通常情况下先形成单质B,而后单质B 和C 化合成B4C 的概率较小.在碳热还原反应中,通过C 还原B2O3可得到B2O2气体.该气体既是B-C-O 体系重要的中间气态产物之一,又是形成B4C 的前驱体[15],B2O2(g)与C 可通过气-固(VS)机制形成B4C.
目前,关于碳热还原法制备B4C 的反应机理研究较少.Kobayashi 等[16]认为针状B4C 颗粒的形成机制为气-液-固(VLS)机制,Ma 等[17]则认为B4C 纳米是通过气-气(VV)机制形成,El-Eheikh 及Weimer 等[18-19]提出液/气态B2O3与C通过液-固(LS)机制或气-固(VS)机制形成B4C.结合热力学分析可发现,B2O3与C 通过LS 机制[见反应(11)]或气态B2O2与C 通过VS 机制[见反应(12)]形成B4C 的概率较大.为了更直观地进行对比分析,绘制出反应(11)和(12)的ΔGΘ与温度T关系图,结果如图5 所示.在标准状态下,当温度高于1 559 ℃时,反应(11)在热力学上是可行的.此外,在整个温度范围内(1 500 ~2 500 K),反应(12)的吉布斯自由能均为负值,这意味着反应(12)在热力学上也是可行的.
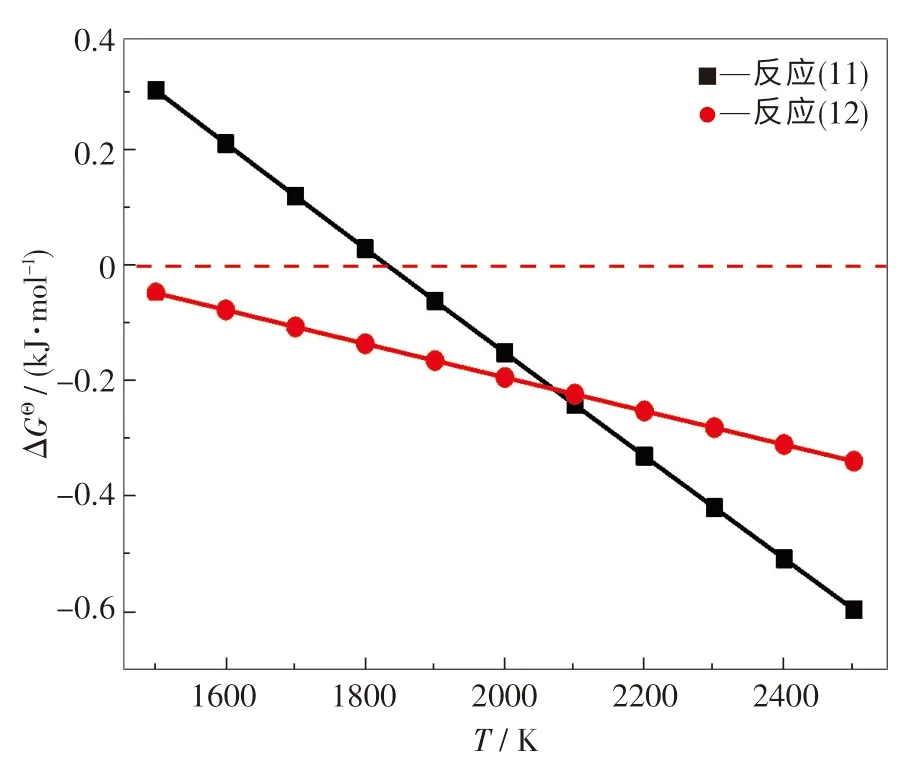
图5 标准状态下反应(11)和(12)的ΔGΘ ~T 图Fig.5 ΔGΘ ~T relationships for reactions (11) and (12) under standard state
通过对CTR 法制备B4C 的热力学过程及优势区域图的讨论分析,推测出B4C 的生成机理可能有两种:①LS 机制,即2B2O3(l)+7C(s)==B4C(s)+6CO(g);②VS 机制,即先通过B2O3(l)+C(s)==B2O2(g)+CO(g)反应形成B2O2气体,B2O2气体再与C 发生气-固反应2B2O2(g)+5C(s)==B4C(s)+4CO(g)形成B4C.
2.3 碳热还原法制备B4C 的反应机理验证
以B2O3和CP为原料,对不同温度下的还原产物进行XRD 分析,结果如图6 所示.由6(a)可知,衍射峰的主峰位置基本一致,2θ=19.7°,22.0°,23.5°,31.8°,35.0°,37.8°和63.7°的衍射峰分别对应于B4C 的(101),(003),(012),(110),(104),(021)和(125)晶面(JCPDS 卡No.35-0798)[18],且产物中只出现B4C 衍射峰,无其他杂质的衍射峰.B4C 的衍射峰强度较高且尖锐,这说明B4C 晶化程度较高.此外,当还原温度由1 550 ℃提高至1 700 ℃时,B4C 衍射峰强度增加,这表明升高温度有利于提高B4C 的结晶性.将B4C 相(110),(104)和(021)晶面进行局部放大,结果如图6(b)所示.从图中可以看出,当温度进一步升高至1 850 ℃时,衍射峰强度减弱,半峰变宽,说明此时B4C 结晶性变差,这可能是高温所诱发的晶体结构缺陷增多或非晶化造成的.
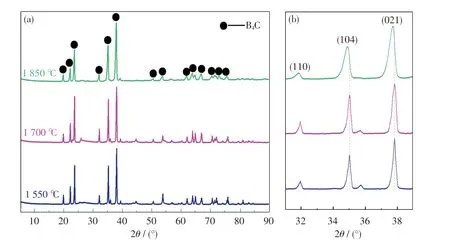
图6 不同还原温度下实验产物的XRD 图Fig.6 XRD patterns of products synthesized at different temperatures
图7 为不同温度下还原产物的SEM-EDS 图.有研究表明,当温度发生变化时,产物的微观形貌和晶粒粒径也会随之变化.由图7(a)和(b)可知:在1 550 ℃下还原产物呈不规则多面体状,经EDS证实为B4C;B4C 结晶发育完整,晶粒边缘棱角分明,晶粒尺寸为4~10 μm.由于碳热还原反应释放的高热量,B4C 晶粒会相互依附、堆垛生长,从而使得晶粒聚集形成较大的团聚体.B4C 晶体显示为层状结构,侧面出现明显的生长台阶,这表明B4C 的生长机理是二维形核控制的小平面生长.此外,由晶体界面生长理论可知[20-21],不规则B4C 多面体晶体是在液态B2O3中形核并逐渐长大的,而多面体晶体的团聚也证实了液态反应物的存在[14].该实验结果则证实了热力学的研究结果,即不规则 B4C 多面体是通过 LS 机制[2B2O3(l)+7C(s)==B4C(s)+6CO(g)]反应形成.

图7 不同温度下实验产物的SEM-EDS 图Fig.7 SEM-EDS results of products synthesized at different temperatures
从图7(c)(d)中可看出,当温度提高至1 700 ℃时,制备的B4C 存在两种截然不同的晶体形貌:一种是类似于图7(a)中的不规则多面体晶体;另一种是长度为3~10 μm 棒状B4C 晶体,并且这些棒状晶体会相互交叉形成多重结构.显而易见,不同形貌的B4C 晶体,其生成机理也不相同[22].棒状晶体是典型的气-固反应晶体形貌,结合热力学研究可知,棒状B4C 是通过VS 机制[反应(2)]形成的.当还原温度继续提高至1 850 ℃时,B4C 晶体呈二维薄片状,薄片长度大于50 μm,宽度为10~20 μm,这进一步证明B4C 是由高温下形成的过饱和B2O2气体与C 通过反应(12)形成的[23].综合上述分析可知,B4C 的生成机理如下:低温下(~1 550 ℃)以LS 机制为主;随温度的升高,气态产物增多,高温下(~1 800 ℃)则以VS 机制为主.
3 结 论
(1)B2O2气体是B-C-O 体系重要的中间气态产物之一,B2O2气体是形成B4C 的前驱体.
(2)B-C-O 体系优势区域图分析表明体系中稳定的共存区域为B2O3(1)+C(s),B2O2(g)+C(s),B2O2(g)+B4C(s),B2O3(1)+B4C(s)和B(s).随温度和分压的变化,物相共存区域的大小也随之变化,优势区域图的分析证实了B2O2气体的存在及气-固反应形成B4C 的可行性.
(3)B4C 的生成机理为:低温下(~1 550 ℃)以液-固机制为主;随温度升高,气态产物的增多,高温下(1 850 ℃~)则以气-固机制为主.

