主动脉瓣狭窄的心脏损伤分期在临床中的应用及研究进展
金权 方臻飞
主动脉瓣狭窄(aortic stenosis,AS)的病因有多种,与年龄相关的退行性病变已占据首位,随着我国人口老龄化加重,故我国AS的患病人数剧增[1]。若不及时干预,此类患者死亡率极高,至今仍没有任何药物治疗能减缓或阻止疾病的进展和影响,主动脉瓣置换术(aortic valve replacement,AVR)是唯一治疗方式。早期各指南中提出AS患者的手术干预指征依赖于以下3个标准:AS的严重程度(表1)、患者的相关症状或左心室收缩功能障碍[2-3]。然而,就AS患者的超声心动图而言,仅仅考虑AS程度和左心室收缩功能障碍可能缺乏对不良事件预测的敏感度。有研究发现严重AS患者的临床结局并不仅仅受狭窄的主动脉瓣影响,心脏结构和功能的改变如显著的二尖瓣反流[4]、三尖瓣反流[5]和右心室功能障碍[6]均与AVR后预后不良相关。因此,2017年Généreux等[7]结合超声心动图首次提出了基于心脏解剖和功能损伤程度的心脏损伤分期,用于评估心脏损伤程度,并首次用于判断预后。本文对这一分期的病理生理、临床应用及研究进展进行综述。
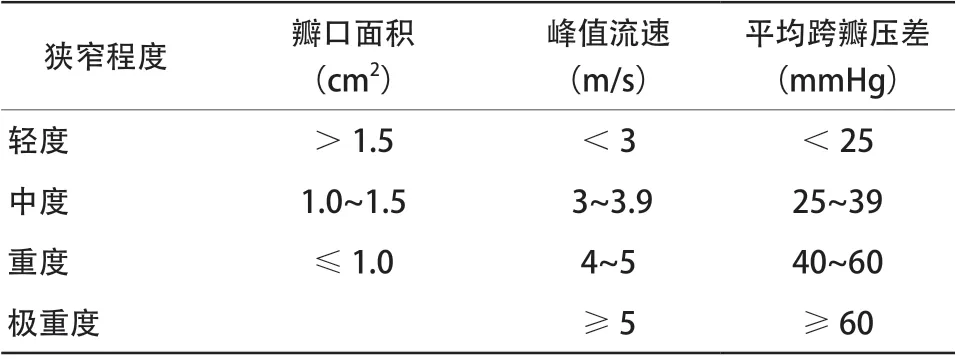
表1 AS 的严重程度Table 1 The severity of AS
1 AS 心脏损伤分期的提出
随着主动脉瓣口面积减小,收缩期左心室-主动脉压差增大,最初的压力超负荷将逐渐导致代偿性左心室肥厚和舒张功能障碍。压力逆传至左心房,进一步引起左心房增大和功能性二尖瓣反流,进而演变成左心房压力和平均肺动脉楔压的慢性升高,最终导致肺血管内的改变。由于肺动脉高压的发生,右心室功能障碍也逐渐进展,在后期,往往会出现双心室功能障碍。2015年,Tan等[8]在对接受AVR的AS患者的研究中就发现左心室舒张末期容积减小、左心室肥大、重度二尖瓣关闭不全的患者死亡率增加。2017年Généreux等[7]结合超声心动图首次提出基于心脏解剖和功能损伤程度的心脏损伤分期,以量化与AS相关的心脏变化程度以及这些变化与接受AVR患者死亡率的关联,其将心脏结构损伤分为以下5期(图1):无主动脉瓣外心脏结构功能损伤(0期)、左心室损伤(1期)、左心房或二尖瓣损伤(2期)、肺动脉血管或三尖瓣损伤(3期)、右心室损伤(4期)。若患者同时满足多个分期(至少满足各分期中1个标准),则以最晚期分期对患者进行划分。
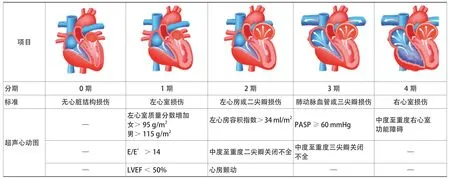
图1 心脏损伤分期Figure 1 Stage of heart injury
所有心脏结构损伤的评估均由经胸超声心动图检查完成,于胸骨旁长轴切面测量左心室舒张末期内径、室间隔厚度、左心室后壁厚度,以此计算左心室质量分数;于心尖四腔心及两腔心切面应用Simpson双平面法测量左心室射血分数(left ventricular ejection fractions,LVEF);于胸骨旁长轴切面评估二、三尖瓣反流程度(轻度、中度、重度);利用心尖四腔心切面、胸骨旁长轴切面、胸骨旁短轴切面共同计算左心房容积指数;通过三尖瓣反流压差估测肺动脉收缩压;使用心尖四腔心切面测量三尖瓣环收缩期位移,小于17 mm定义为右心室损伤。
2 心脏损伤分期与AVR 术后临床结果
在一项包括1 661例重度AS患者的研究中,首次提出心脏损伤分期,并将其用于评估预后[7]。结果显示,心脏损伤分期是术后1年死亡率(包括全因死亡和心原性死亡)的最强预测指标之一,分期每增加一个阶段,患者1年死亡风险上升45%。此外,研究还表明这种新的心脏损伤分期系统对于预测AVR后结局事件的几个预测因子[包括患者虚弱和美国胸外科医师协会(Society of Thoracic Surgeons,STS)评分]的1年生存率具有显著的增量价值。Généreux等[7]人最初提出的心脏损伤分期陆续被其他研究人员验证和修订[9-13]。自2002年法国Cribier教授进行首例经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)以来,国内外多家医院逐渐将其应用于治疗主动脉瓣疾病,近年来一系列大型临床研究结果表明接受TAVR治疗的AS患者的预后不劣于,甚至优于接受外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)的患者[14-15]。因此近年来国内外最新指南已将TAVR作为治疗症状性重度AS患者的Ⅰ类推荐手术方式,TAVR适应证也从外科手术风险高危扩展到了中低危[16-21]。我国TAVR年手术量呈倍数增长,甚至在欧美等发达国家,TAVR年手术量已超过SAVR。考虑到心脏损伤分期提出的背景及未来发展趋势,现今关于心脏损伤分期的研究将更多关注TAVR患者。2019年Fukui等[9]对689例TAVR患者进行回顾性分析发现,TAVR患者术前分期越靠后,术后2年死亡风险越高。基于上述研究,我国于2022年首次将该分期分类系统与传统的STS风险分层评分进行比较,发现在中国患者队列中,分期和STS评分都是1年死亡率的危险因素,且心脏损伤分期风险分层的有效性与STS评分相当[22]。
3 心脏损伤分期的改良
然而,上述2项研究都没有发现分期较早的心脏损伤(即左心功能不全、左心房损伤或严重的二尖瓣反流)对预后的相关影响。实际上,LVEF低估了AS中左心室收缩功能障碍的程度,约1/3无症状AS或LVEF保留的患者,都有一定程度的亚临床左心室收缩功能障碍,定义为左心室整体纵向应变(left ventricular global longitudinal strain,LVGLS)受损[23]。更有一些研究报道,LVEF 50%~60%的AS患者与LVEF>60%的患者相比,发生心脏事件和死亡的风险更高[24-28],这提示应该将LVEF之外的因素考虑进去。直至2019年,一项Meta分析显示LVEF 60%的无症状AS患者的LVGLS受损(即绝对值≤14.7%)与死亡率之间存在显著相关[29]。随后,Vollema等[12]也证实LVGLS与独立于心脏损伤阶段之外的全因死亡率相关,并表明LVGLS受损与LVEF受损的重度AS患者有相当的全因死亡风险。因此Vollema等[12]建议将LVGLS纳入心脏损伤分期中,用于识别早期心脏损伤的患者,并将这些患者重新分类到较晚期的心脏损伤阶段,以此细化危险分层,从而提高心脏损伤分期对于AVR术后预后的预测价值。
2019年Tastet等[10]在已有研究基础上,纳入既往学者的建议,对原有心脏损伤分期做出了如下调整:(1)1期,将LVEF临界点从50%提高到60%,以提高LVEF在重度AS患者中识别亚临床左心室收缩功能不全的敏感性。此外,增加了LVGLS受损(即绝对值≤15%)作为左心室损伤的标准,从而将部分患者从0期重新划分为1期。(2)4期,加入了中至重度低血流状态(定义为右心室容积指数<30 ml/m2),作为亚临床心力衰竭的标志。(3)其他分期参数和依据均未发生变化。分别使用原有分期方案和修正后分期方案对735例无症状中-重度AS患者进行心脏损伤分期,结果显示,改进后的分期方案较原有分期方案在预测5年死亡率方面比原有分期方案更加可靠。
4 AVR 后心脏损伤的转归、影响因素及预后
2022年Généreux等[30]首次描述了AVR术后心脏损伤分期的演变及其对预后的影响。其按照最新瓣膜损伤分期对1 974例患者进行分类,结果显示,与术前相比,15.6%的患者在1年随访中至少改善了1个阶段,57.9%仍处于同1阶段,26.5%至少恶化了1个阶段。在调整了基线因素(包括心脏损伤阶段)和手术类型后,术后1年的心脏损伤阶段的变化与全因死亡率(P=0.023)及死亡或心力衰竭再住院综合事件(P<0.001)独立相关。且术后分期改善是全因死亡率及综合事件的保护因素。进一步探讨术后1年分期变化的可能影响因素,发现高血压(OR1.73,95%CI1.01~2.96,P=0.044)是术后心脏损伤阶段恶化的独立预测因素。可能与高血压进一步增加了AS患者的后负荷相关,这一发现强调了AVR术前对于血压控制的重要性。
5 心脏损伤分期对治疗管理的意义
5.1 心脏损伤分期的优势
就AS患者所致心脏结构损伤而言,无创与有创2类评估方案,既往右心导管是精准评估心脏结构和功能损伤的唯一手段,但右心导管为有创评估,且费用高昂,临床应用受到限制。随着超声心动图技术逐渐成熟,已有研究证实超声心动图可代替右心导管对心脏结构和功能进行准确评估。超声心动图已经成为临床上评估心脏结构和功能的重要手段,不仅可评估AS患者的狭窄程度,还可对心脏及周围大血管的结构和功能进行完整的评价[3,31]。
此外,无症状重度AS患者的治疗时机及治疗方式仍不明确。目前指南建议此类患者在随访期间出现症状或左心室收缩功能障碍后再接受手术,然而部分非随机研究表明,早期手术干预比保守治疗的预后更好[32]。保守治疗易发生潜在的不可逆心脏损伤,而这些损伤并不能通过后期AS的解除而得到纠正。当AS患者出现症状时,基本已经到了疾病的晚期,在这些疾病较晚期的患者中,可能出现严重的永久性心脏损伤,甚至已经丧失可逆性的潜力,在短期内出现不良事件的风险更高。因此,早期识别无症状的重度AS患者尤为重要,对于提高人群整体生活质量有着至关重要的意义,这可以通过无创的超声心动图监测心脏结构和功能来实现。已经有研究表明,在无症状的严重AS患者中,心脏损伤2期的存在可以被认为是早期选择性干预的识别因素,而对于那些0期及1期的患者则可以进行保守治疗和密切的临床和超声心动图随访[33]。
5.2 心脏损伤分期局限性
(1)目前关于该分期的证据均来自回顾性研究,且数据来源较少,未来需要更多的多中心大数据,必要时进行前瞻性病例对照研究来验证最新心脏损伤分期的作用。(2)该分期严格参照AS所致瓣膜外心脏损伤的发生发展顺序,然而最新有研究表明,在AS的发生发展过程中,与左心室压力超负荷有关的心脏结构损伤并不一定严格按照左心室、左心房、肺血管系统、右心室的顺序发生。在这方面,最近的研究表明,这种无规律的心脏结构损伤可能与以下2个因素相关:左心室肥大或左心室功能障碍的发生可能会早期影响右心室功能,或通过心室相互依赖,或通过对左心室超负荷的全身激素反应,或通过对压力超负荷的病理反应的连续延伸[34-35];不同患者存在不同的易感性或遗传易感性[36-37]。(3)目前公认的2017年心脏损伤分期系统纳入的参数较少。2019年Tastet等[10]在已有研究基础上,拟定了新的心脏损伤分期标准,改良的心脏损伤分期标准的预测价值进一步提高,这表明可能需要纳入更多超声心动图指标或结合多种影像学手段共同评估心脏损伤,来不断改进分期系统。如心脏磁共振成像(cardiac magnetic resonanceimaging,CMR),其具有宽视野、多参数、任意平面成像等优点(图2),克服了超声心动图对心脏几何假设的局限性,对各项参数测量更为精准[38-39]。2021年有研究表明,CMR左心室心肌应变分析有助于对二叶式AS患者左心室重构进行量化、分级[40]。

图2 CMR 不同成像平面Figure 2 Different imaging planes of CMR
6 展望
AS患者的预后与瓣膜外心脏损伤严重程度息息相关。诸多临床研究已经证实2017年提出的心脏损伤分期及后续修订的改良分期的预后预测价值,有利于对AS患者的制定个性化及优化决策过程,改善预后。
目前国内外关于心脏损伤分期的研究多为回顾性研究,未来需要更大样本的随机对照研究来验证这一分期的作用。其次,现有研究数据多来自国外,与国外不同,中国老龄人口更多,且二叶式AS患者比例更高,钙化也更为严重,因此,需要进一步在国内开展多中心研究,再次改良分期方案。此外,该分期系统较少关注生化指标的变化。如AS患者发生心力衰竭时,N末端B型脑钠肽前体会随着心力衰竭加重而相应上升,往往提示预后不良,故应该将心脏损伤相关的血清学指标纳入考虑范畴。最后,心脏损伤分期方案目前被提出用于AS患者,未来仍需要对主动脉瓣关闭不全或主动脉瓣联合病变的患者进行扩展和调整。
利益冲突所有作者均声明不存在利益冲突

