薯蓣皂苷对烟曲霉菌性角膜炎的作用及其机制
綦英合,尹敏,刘桂波,李翠
(青岛大学附属医院眼科,山东 青岛 266003)
真菌性角膜炎(FK)是一种由病原真菌引起的顽固性角膜疾病,如果治疗不当会引起角膜溃疡、穿孔甚至失明[1]。由于工农业生产导致眼外伤、术后角膜感染、隐形眼镜的佩戴以及类固醇激素的滥用,FK的发病率越来越高[2]。FK的严重程度与真菌病原体的毒力和宿主防御机制密切相关[3]。一方面,真菌病原体的孢子侵入眼表,对角膜组织造成物理损伤,同时分泌毒力因子进一步破坏角膜结构[4];另一方面,真菌病原体侵入角膜会引发强烈的免疫反应,诱导免疫细胞积累,进一步促进促炎细胞因子的产生,导致角膜溃疡的延迟愈合[5]。因此,抗真菌联合抗炎治疗是快速改善FK的关键。最近,中药治疗真菌感染引起了国内外的广泛关注。薯蓣皂苷(DS)是一种从薯蓣、穿山龙、闭鞘姜等多种植物根茎中分离提取的天然化合物,具有毒性低、资源丰富等优点[6]。药理学研究证明DS具有抗肿瘤、抗炎、抗真菌和降血脂等多种药理作用[7-10]。有研究发现,DS通过破坏真菌细胞膜的完整性导致细胞内离子外流、细胞膜电位和细胞内渗透压发生改变,对白色念珠菌具有良好的抗菌活性[11],然而其是否对烟曲霉菌(AF)有作用目前尚不清楚。RAN等[12]研究显示,DS通过激活核因子-红细胞2相关因子2(Nrf2)信号通路,减少炎症细胞浸润,并抑制白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)等炎症因子的表达和分泌,从而改善炎症反应。本研究拟通过体内和体外实验探究DS在AF性角膜炎中的作用及其机制。
1 材料与方法
1.1 DS溶液的制备和AF培养
用精密电子天平称量32 μg的DS加入至1 μL的DMSO中,然后用无菌PBS将该混合物稀释至1 mL,得到32 mg/L的 DS储存溶液,之后再用DMEM培养液将其稀释至所需浓度。参考相关文献的方法[13],将AF株(NO3.0772,中国北京微生物中心)接种于沙氏液体培养基中,37 ℃孵育48 h,收集菌丝洗涤、离心、弃上清,将部分真菌活菌丝用于动物实验;另一部分用体积分数0.75的乙醇处理作为灭活菌丝用于细胞实验。所有菌丝均用DMEM培养液和无菌PBS稀释至3×108CFU/L。
1.2 细胞培养及处理
将RAW264.7细胞(购自中国科学院上海细胞库)接种于12孔板中,在37 ℃、体积分数0.05 CO2的条件下进行培养,随机分为溶剂对照组(A组)、DS处理组(B组)、单纯加菌组(C组)和加菌DS处理组(D组),每组设置6个复孔。待细胞密度约为80%时,向溶剂对照组和单纯加菌组每孔加入1 mL体积分数0.000 1 的DMSO;DS处理组、加菌DS处理组每孔加入16 mg/L的 DS溶液1 mL,刺激1 h,再向单纯加菌组和加菌DS处理组每孔加入灭活菌丝60 μL,6 h后收集细胞用于实时荧光定量聚合酶链反应(qRT-PCR)。
1.3 DS毒性测定
1.3.1CCK-8实验 将RAW264.7细胞接种于96孔板中,实验组用不同浓度的DS溶液(1、2、4、8、16和32 mg/L)处理,对照组用体积分数0.000 1 的DMSO处理,每组设置6个复孔。37 ℃培养48 h后,每孔中加入10 μL CCK-8试剂并继续在37 ℃条件下培养1 h。使用酶标仪(ViCTOR Nivo 5s,PerkinElmer,美国)检测450 nm波长处的吸光度值,以其作为细胞存活率的指标。
1.3.2Draize眼表毒性实验 取12只健康的8周龄C57BL/6雌性小鼠(购于济南朋悦实验动物繁育有限公司),随机分为实验组和对照组,每组6只。实验组小鼠的右眼用16 mg/L的DS溶液点眼处理,对照组则用体积分数0.000 1的DMSO点眼处理,每日4次。于点眼后的第1、3天进行角膜荧光素钠染色,并在裂隙灯下使用钴蓝光进行拍照记录。观察小鼠角膜的染色程度。
1.4 体外抗真菌实验
1.4.1菌丝形态及真菌细胞结构观察 将浓度为3×108CFU/L的烟曲霉分生孢子接种在6孔板上,37 ℃下培养24 h。应用PBS洗涤3次,离心10 min后转移至新的6孔板中,并向每孔中加入16 mg/L的DS或体积分数0.000 1 DMSO溶液培养12 h。PBS洗涤后,用体积分数0.025的戊二醛固定。采用相关文献的方法[14],通过包埋、脱水、干燥处理固定菌丝。用JSM-840扫描电子显微镜(JOEL,日本)以1 000倍和5 000倍的放大倍数拍摄照片,用JEM-1200EX透射电子显微镜(JOEL,日本)以25 000倍的放大倍数拍摄照片,观察菌丝形态以及真菌细胞结构。
1.4.2碘化丙啶(PI)摄取实验检测AF细胞膜完整性 将浓度为3×108CFU/L的烟曲霉分生孢子接种在6孔板上,37 ℃下培养24 h。PBS洗涤3次,离心10 min后转移至新的6孔板中,并向每孔中加入16 mg/L 的DS或体积分数0.000 1 DMSO溶液培养12 h。PBS冲洗菌丝,向每孔中加入50 mg/L的 PI溶液。随后将孔板避光静置15 min。使用Axio-Vert显微镜(Zeiss,Oberkochen,德国)在200倍放大倍数下获取图像。观察不同处理组的荧光强度,以其反映AF细胞膜完整性。
1.5 qRT-PCR检测Nrf2及细胞因子的mRNA表达
使用RNAiso Plus试剂盒(Takara Biotechno-logy,中国大连)提取细胞总RNA,按试剂盒说明书进行操作,并使用分光光度计对结果进行定量。以提取的mRNA为模板,使用PrimeScript RT试剂盒(Vazyme)通过两步法合成cDNA。按照相关文献报道的方法[13],使用梯度热循环仪(Eppendorf MasterCycler)和TB Green预混物(Vazyme)进行qRT-PCR,检测细胞因子IL-1β、IL-6、TNF-α和Nrf2的mRNA表达,以β-actin作为内参照。根据循环数计算基因的相对表达量。PCR所用引物及其序列见表1。

表1 PCR引物及其序列
1.6 小鼠AF性角膜炎模型的建立及角膜感染情况的观察
将24只C57BL/6小鼠随机分为DMSO溶剂对照组(对照组)和DS组,每组12只。用80 g/L的水合氯醛对小鼠腹腔注射麻醉后,刮除小鼠右眼直径约2 mm的中央角膜上皮,将5 μL AF活菌丝涂于刮除处,然后放置直径为3 mm的角膜接触镜,缝合眼睑。24 h后通过裂隙灯显微镜确认小鼠AF性角膜炎模型建立成功后,在右眼结膜下注射体积分数0.000 1 DMSO或16 mg/L的DS溶液,每天2次。建立模型后的第1天和第3天通过裂隙灯显微镜观察小鼠角膜情况,按照相关文献方法评估角膜炎的严重程度[15],分为Ⅰ~Ⅳ级。于感染后的第3天处死小鼠,每组收集6只小鼠角膜进行平板菌落计数[16],收集另外6只小鼠眼球进行苏木精-伊红(HE)染色[5],观察小鼠角膜的真菌存活数量及炎症细胞浸润程度。
1.7 统计学处理
2 结 果
2.1 DS对RAW264.7细胞和小鼠角膜的毒性
CCK-8实验表明,DS浓度为0、1、2、4、8、16、32 mg/L时,细胞存活率分别为(100.00±4.19)%、(96.25±5.53)%、(94.32±7.85)%、(94.43±9.34)%、(93.93±7.32)%、(92.81±5.67)%和(45.76±9.03)%,DS浓度≤16 mg/L不会影响RAW274.7细胞的活力(P>0.05),而32 mg/L的DS溶液处理组细胞存活率与其他处理组比较差异有统计学意义(F=39.01,P<0.01)。Draize眼表毒性实验结果显示,用16 mg/L的 DS点眼处理第1天和第3天小鼠角膜均无着染(图1)。因此,选用16 mg/L 的DS溶液用于后续实验。
2.2 DS对AF的影响
扫描电子显微镜观察显示,与DMSO组相比,DS组的菌丝皱缩、卷曲、质地粗糙(图2A~D)。透射电子显微镜观察显示,与对照组相比,DS组真菌细胞质变得透明、细胞器和核膜溶解(图2E、F)。PI摄取实验显示,DS组的荧光强度明显高于DMSO组(图2G、H)。

A、B:DMSO组和DS组1 000倍扫描电子显微镜图像;C、D:DMSO组和DS组5 000倍率扫描电子显微镜图像;E、F:DMSO组和DS组25 000倍率透射电子显微镜图像;G、H:DMSO组和DS组200倍率PI染色荧光图像。
2.3 DS对AF诱导的炎症因子及Nrf2 mRNA表达的影响
析因设计方差分析结果显示,DS处理(FDS=20.06~56.13,P<0.001)、灭活菌丝处理(FAF=467.65~1 355.97,P<0.001)、DS与灭活菌丝处理产生的交互效应(FDS×AF=23.44~71.12,P<0.001)对各因子mRNA表达的影响差异均有统计学意义。单独效应分析显示,不经灭活菌丝处理时,DS处理和不处理对各因子mRNA的表达均无影响(P>0.05);经灭活菌丝处理时,DS处理较不处理各因子mRNA表达水平明显降低(F=40.31~126.81,P<0.001)。见表2。
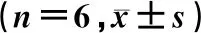
表2 各组细胞TNF-α、IL-1β、IL-6和Nrf2 mRNA表达水平比较
2.4 DS对AF小鼠模型角膜炎的作用
体内实验裂隙灯观察显示,感染后的第1天,DS组与对照组的角膜炎严重程度无明显差异(图3A、B);感染后的第3天,与对照组相比,DS组小鼠角膜混浊面积减小,溃疡程度减轻(图3C、D)。HE染色结果显示,与对照组相比,DS组的炎症细胞明显减少,组织结构更加有序(图3E、F)。重复测量设计的方差分析显示,时间、组别、时间和组别的交互作用对小鼠角膜炎症临床评分的影响差异有显著性(F时间=51.05,F组别=11.99,F时间×组别=8.39,P<0.001);单独效应结果显示,两组小鼠感染第1天临床评分差异无显著性(P>0.05),感染后的第3天DS组小鼠较对照组临床评分显著降低(F=18.27,P<0.001),对照组和DS组感染后第3天较第1天临床评分均有所升高(F=50.41、9.02,P<0.001)。见表3。平板菌落计数实验显示,DS组感染角膜中的AF数量较对照组显著减少(图3G、H);对照组和DS组的菌落计数结果分别为411.40±29.59、76.00±7.14,两组比较差异有统计学意义(t=8.78,P<0.05)。

A、B:对照组和DS组小鼠感染后第1天的裂隙灯图像;C、D:对照组和DS组小鼠感染后第3天的裂隙灯图像;E、F:对照组和DS组小鼠感染后第3天的HE染色观察,放大倍数400倍;G、H:对照组和DS组小鼠感染后第3天的角膜真菌负荷照片。

表3 小鼠AF性角膜炎模型临床评分比较
重复测量设计的方差分析显示,F时间=51.05,F组别=11.99,F时间×组别=8.39,P<0.001。单独效应分析显示,与对照组比较,*F=18.27,P<0.001;与第1天比较,#F=50.41、9.02,P<0.001。
3 讨 论
FK是一种致盲性角膜疾病,其难治性可能与致病真菌毒力和机体过度的免疫反应有关[17]。真菌分生孢子黏附于角膜上皮后,孢子开始萌发并且逐渐形成菌丝,发育中的菌丝通过自身的生长穿过上皮层并进入基质层,对角膜造成物理损伤[18]。此外,真菌还能够产生毒性因子(如磷脂酶和蛋白酶等),这些因子可以通过降解角膜组织提高真菌的侵袭性[19]。真菌侵袭角膜激活了由免疫细胞和促炎细胞因子组成的信号网络以清除病原体[20]。既往研究显示,过度的免疫反应不仅对病原体的清除没有帮助,反而会导致感染部位炎症细胞和细胞毒性物质的大量积累,从而造成组织损伤、预后不良[21]。因此,抗真菌联合抗炎治疗尤为重要。
DS是一种广泛存在于薯蓣科植物根茎中的天然甾体皂苷,具有抗真菌和抗炎作用[8-9]。本研究结果显示,16 mg/L的DS对RAW264.7细胞和小鼠角膜无毒性作用;体外抗真菌实验结果表明,DS通过破坏AF细胞膜、细胞器等结构,对真菌细胞造成不可逆的伤害,从而对AF起到明显的抑制作用。CHO等[11]研究显示,DS侵入真菌细胞膜后破坏膜内结构,导致真菌细胞死亡,从而发挥抗真菌活性。本文研究结果与其一致。为探究DS的体外抗炎作用,本文采用qRT-PCR方法检测了DS对AF诱导的小鼠巨噬细胞炎症反应的影响,结果表明,DS可以显著抑制TNF-α、IL-1β及IL-6mRNA的表达。TNF-α、IL-1β及IL-6是参与角膜抗真菌免疫反应的重要促炎细胞因子,主要由活化的单核细胞产生,介导急性炎症反应,促使免疫细胞产生更多的炎症因子,从而对角膜组织造成更严重的破坏[22-23]。DS抑制这些促炎因子的基因表达,说明其可以抑制炎症、缩短病程。Nrf2是重要的抗氧化调节因子,它可以通过阻断TNF-α、IL-1β、IL-6等促炎因子的基因表达抑制巨噬细胞的炎症反应[24]。既往研究表明,Nrf2在促进角膜伤口愈合中起重要作用,激活的Nrf2在外伤性角膜疾病中可以发挥良好的保护作用[25]。本研究结果显示,DS组Nrf2mRNA水平相较于对照组明显升高,说明DS可能通过提高Nrf2的表达抑制炎症反应,减轻角膜受到炎症反应的伤害。
为进一步验证DS的作用,本文建立了AF性角膜炎小鼠模型并进行了体内实验。结果显示,与对照组相比,DS组小鼠角膜炎严重程度明显得到改善,临床评分显著降低,说明DS可以有效降低小鼠角膜炎症指数,改善感染所引起的角膜溃疡。此外,HE染色结果也表明,DS可以减少炎症细胞的浸润、减轻小鼠角膜的炎症反应。WANG等[26]研究显示,DS可以减轻LPS诱导的急性肺损伤所导致的炎症反应,本研究结果与其一致。本文平板菌落计数结果显示,DS组菌落数明显少于对照组,表明DS在体内可发挥抗真菌作用,抑制AF的生长。
综上所述,DS通过抗真菌和抗炎作用改善AF性角膜炎。其可能机制为:①DS通过破坏菌丝结构、减少真菌负荷抑制AF的生长,减弱AF的毒力作用;②DS通过增强Nrf2的表达、调控促炎因子水平以及抑制炎症细胞浸润起到抗炎作用。