Anle138b对oAβ1-42诱导海马神经元突触毒性作用影响
孙琳,王炳超,朱天立
(青岛大学基础医学院生理学教研室,山东 青岛 266071)
阿尔茨海默病(AD)是一种以记忆丧失、认知障碍以及痴呆的行为和心理症状为特征的神经退行性疾病[1-2]。β淀粉样蛋白寡聚体(oAβ)在细胞内蓄积和神经元过度兴奋是 AD早期的两个重要事件[3]。oAβ的主要形式为oAβ1-40和oAβ1-42,并且后者的毒性最强。对AD神经元功能障碍和毒性的最早解释之一是由ARISPE等[4]提出的通道假说,该假说假设不受调控的β淀粉样蛋白(Aβ)离子通道会导致离子稳态的丧失(主要是通过升高细胞内钙离子),最终触发神经元功能障碍和细胞死亡[5]。二苯基吡唑化合物Anle138b是一种低聚物调节剂,其毒性低,口服生物利用度高,血-脑脊液屏障通透性好[6]。Anle138b能够阻断Aβ通道并挽救淀粉样变性小鼠模型的疾病表型,是治疗AD非常有希望的新型药物,但是该药在原代海马神经元的细胞模型上研究较少。本研究应用单细胞膜片钳技术检测自发性兴奋性突触后电流(sEPSCs),分析Anle138b对慢性oAβ1-42诱导的海马神经元细胞突触毒性作用影响,为AD新型药物的开发提供可行的思路。现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1实验动物 选择出生24 h之内的SD乳鼠40只,由青岛大任富城畜牧有限公司提供。
1.1.2主要实验试剂及仪器 葡萄糖酸钾、二甲基亚砜(DMSO)、KCl、NaCl、MgCl2、4-羟乙基哌嗪乙磺酸(HEPES)缓冲液、乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、Mg2ATP、NaGTP以及KOH均购自美国Sigma公司;DMEM/F12培养基、胰蛋白酶购自美国Hyclone公司;青霉素-链霉素购自中国北京索莱宝科技有限公司;B27无血清添加剂购自美国Gibco公司;Anle138b、人源Aβ1-42粉末、六氟异丙醇(HFIP)、荷包牡丹碱(Bicuculline)均购自中国MCE公司;CO2细胞培养箱;玻璃微电极拉制仪;防震台;三维微操纵器;膜片钳放大器;倒置荧光显微镜。
1.1.3主要溶液配制 ①海马神经元细胞培养液:在无菌操作台中,将10 mL神经元专用添加物B27、5 mL青霉素-链霉素溶液加入500 mL的DMEM/F12基础培养液中,混匀后分装于50 mL离心管中,置4 ℃冰箱中保存。②oAβ1-42:将Aβ1-42粉末和HFIP置于冰上,取1 mg的Aβ1-42和222 μL的HFIP装入离心管中,涡旋混匀,室温孵育1 h直到液体澄清。将Aβ1-42-HFIP分装到4个无菌的EP管中,放到通风橱挥发过夜,至EP管底部产生透明的Aβ1-42-HFIP膜, -80 ℃冰箱保存。使用前加入11 μL DMSO涡旋混匀,再加入539 μL PBS涡旋混匀,置于4 ℃冰箱中直立孵育24 h后,4 ℃、1 400 r/min离心10 min,取上清即为oAβ1-42,分装保存于-20 ℃冰箱中。③电极内液:将130 mmol/L葡萄糖酸钾、10 mmol/L HEPES、2 mmol/L浓度MgCl2、1 mmol/L EGTA、2 mmol/L Mg2ATP、10 mmol/L KCl、500 μmol/L NaGTP溶液混匀,用1 mol/L KOH 调节pH值为7.3,分装后-20 ℃储存备用。
1.2 实验方法
1.2.1实验分组及处理 参考本实验室方法培养原代海马神经元细胞[7],细胞发育成熟后分为对照组(A组,不进行任何处理)、Anle138b组(B组,50 nmol/L Anle138b处理2 d)、oAβ1-42组(C组,100 nmol/L oAβ1-42处理7 d)、oAβ1-42+Anle138b组(D组,100 nmol/L oAβ1-42+50 nmol/L Anle138b共处理7 d)、oAβ1-42+Anle138b 2 d组(E组,100 nmol/L oAβ1-42处理7 d,在oAβ1-42处理最后2 d加用50 nmol/L Anle138b),各组处理结束后进行单细胞膜片钳记录。
1.2.2单细胞膜片钳记录海马神经元细胞sEPSCs幅值、频率和半衰减时间 细胞外液37 ℃水浴锅中温浴后,将各组细胞培养液更换为细胞外液。在显微镜下找到胞体饱满、边界清晰、表面无凹陷的细胞做好标记,点击“offset”,进行单细胞膜片钳记录。将抛光好的玻璃电极(电阻为5~10 MΩ)注入合适体积的电极内液,使用三维微操纵器控制电极慢慢接近细胞,直到接触到细胞表面,方波越来越低,电阻有所增加。此时可以观察到电极尖端和细胞都清晰可见并且细胞表面被电极压出“酒窝”。释放正压,给电极负压轻轻吸吮细胞,使电阻迅速增加至1 GΩ,待封接电阻稳定于1 GΩ、1 min后,给予少量负压破膜。破膜完成后进行串联电阻及膜电容补偿,在电压钳模式下观察sEPSCs的变化,记录采用gap free模式,钳制电压为-70 mV,记录前加入Bicuculline(20 μmol/L),在Igor pro软件上选择程序进行实验记录。用Igor pro软件采样,clampfit软件分析数据。
1.3 统计学处理

2 结 果
各组海马神经元细胞sEPSCs幅值、半衰减时间比较差异无统计学意义(F=2.215、1.043,P>0.05)。各组sEPSCs频率比较差异有统计学意义(F=15.490,P<0.001),两两比较显示,oAβ1-42组细胞sEPSCs频率较对照组明显增加(q=6.507,P<0.001),oAβ1-42+Anle138b组和oAβ1-42+Anle138b 2 d组细胞sEPSCs频率较oAβ1-42组明显降低(q=9.517、9.471,P<0.001),其他组间比较差异无显著性(P>0.05)。见表1。
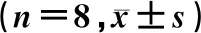
表1 各组细胞sEPSCs幅值、频率、半衰减时间比较
3 讨 论
随着社会经济的发展及人类寿命的不断增加,AD的患病率不断升高,预计到2050年AD的患病人数将达到1.0亿~1.3亿人[8-9]。虽然目前有多种假说,但是AD的分子病因学仍然不清楚。有研究表明,oAβ是AD主要的毒性物质[10]。oAβ可以通过突触驱动机制导致超兴奋性的产生和传播[11],对大鼠和小鼠模型的初级神经元产生毒性作用,抑制海马突触长时程增强,并导致记忆障碍[12-14]。oAβ是由淀粉样蛋白前体蛋白(APP)经过β-分泌酶和γ-分泌酶异常加工和Aβ积累产生的[15-16]。oAβ主要包括oAβ1-40和oAβ1-42两种形式,其中以oAβ1-42毒性最强[17]。有研究表明,oAβ能够破坏细胞膜,导致离子通道的形成[10]。oAβ形成离子通道以后导致神经细胞内钙离子代谢异常,改变了细胞内钙离子的动态平衡,最终导致神经毒性[18-19]。因此,寻找一种Aβ离子通道小分子阻断剂将会为AD的治疗提供一种新的思路[20]。而Anle138b能够在不改变膜嵌合抗体齐聚物结构的情况下阻断Aβ离子通道的活性,并且Anle138b是首个被报道能够在oAβ形成离子通道后将其阻断并改善Aβ病理的化合物[5,21]。但是该药物在海马神经元细胞突触上的研究非常少,能否在Aβ通道形成前后均降低慢性oAβ1-42诱导的突触毒性作用以保护海马神经元细胞仍不清楚。
本文研究应用单细胞膜片钳技术检测海马神经元细胞sEPSCs幅值、频率、半衰减时间3个指标,结果显示,Anle138b对海马神经元细胞突触功能不产生影响,oAβ1-42处理7 d会诱导原代培养的海马神经元细胞突触的sEPSCs频率增加从而产生神经毒性作用,而Anle138b能降低oAβ1-42通道形成前后所导致的频率升高,但是各组的幅值和半衰减时间差异无统计学意义。说明Anle138b不仅可以预防oAβ1-42诱导的海马神经元细胞突触毒性,还可以消除慢性oAβ1-42诱导的已经形成的海马神经元细胞突触毒性。提示oAβ1-42诱导海马神经元细胞突触毒性的机制可能为:海马神经元细胞突触前膜离子通道形成后导致钙离子稳态失调,突触前膜递质释放增多,对突触产生毒性[22]。已有研究证明海马神经元细胞突触前膜释放的神经递质是谷氨酸[23],而这个过程可以被Anle138b所阻断。动物模型研究结果显示,Anle138b对帕金森病(PD)、多系统萎缩病、阮病毒和AD等蛋白聚集相关疾病治疗有效[24-27]。关于Anle138b抑制PD的发病进展机制已在健康志愿者中测试成功,目前正在PD病人中进行Ⅰb期测试(NCT04685265)[28]。
综上所述,Anle138b可以降低oAβ1-42诱导的海马神经元细胞突触毒性作用,其可能的机制是减少突触前膜神经递质释放,并且Anle138b不仅可以预防慢性oAβ1-42诱导的突触毒性作用,还可以消除慢性oAβ1-42诱导的突触毒性作用。因此,Anle138b类小分子阻断剂可能在AD的治疗中有非常大的潜力,值得进一步研究。