二穗短柄草SPL家族基因的鉴定、系统发育和表达分析
王淑婷,朱 婷,马浩森,李小鹏,牛 娜,马翎健
(1.西北农林科技大学农学院,陕西杨凌 712100; 2.渭南市农资农产品质量检测中心,陕西渭南 714000)
基因家族由结构和功能相似的多个基因组成,在特定的生物体中扮演着重要的角色。目前,在真核生物中已经发现了各种基因家族,如bHLH[1]、TCP[2]和Prx[3]等。SPL家族基因(AmSBP1和AmSBP2)在金鱼草的花分生组织中首次被发现,后在多种植物中被鉴定出。SPL蛋白均含有一个高度保守结构域(也称为SBP结构域),由两个独立的锌指结构组成,其中包含Zn-1(Cys3His或Cys4)和Zn-2(Cys2HisCys)[6-7];每个锌指位点由4个氨基酸残基结合一个锌离子,在维持蛋白质构象稳定方面发挥重要作用[8]。在SBP结构域的C末端,有一个保守的核定位信号重叠在第二个锌指结构上,将SBP蛋白引导到细胞核中,调节下游基因的转录[9]。
目前,SPL家族基因已经在拟南芥[10-11]、水稻[7]、大豆[12]、矮牵牛[13]、棉花[14]、烟草[15]、泡桐[16]、藜麦[17]和水曲柳[18]中得到研究。但还没有关于二穗短柄草SPL家族基因的报道。
研究表明,SPL家族基因由miR156/157调控,在植物生长和生理的各个方面发挥着作用[11,19-20];在拟南芥17个SPLs中,有11个含有miR156/157识别位点[23-24]。Schwab等[25]发现,拟南芥中过表达miR156使多个SPLs的表达下调,这些SPLs都含有miR156/157识别位点,而其他没有该识别位点的SPLs不受影响;突变5个AtSPL3的miR156/157识别位点碱基后,AtSPL3的转录水平显著提高。在番茄中,大部分SPL基因在茎尖、花序和果实中高表达,而miR156/157在这三个组织中的表达较低, 表明miR156/157与SPLs的表达水平呈负相关。SPL基因参与植物的信号转导,如AtSPL8可抑制促进种子萌发和根生长的下游基因的表达[27];VvSBP3和VvSBP5参与葡萄的低温反应[28]。二穗短柄草基因组较小,与粮食作物如小麦、大麦和水稻关系密切[29]。目前,关于拟南芥和水稻SPL家族基因的功能研究较多,但其在二穗短柄草中的信息还不清楚。本研究拟对二穗短柄草中的SPL家族基因进行鉴定,分析其基因结构、基序、顺式元件、系统发育、基因复制、GO注释和表达模式等,并对其功能进行预测,为粮食作物功能基因的发现与利用提供参考。
1 材料和方法
1.1 二穗短柄草中SPL基因的鉴定
从Ensembl plant数据库(http://plants.ensembl.org/)下载二穗短柄草的全基因组数据,包括基因组序列文件和蛋白序列文件。从PFAM数据库(http://pfam.xfam.org/)下载SBP结构域 (PF03110);使用HMMER 3.0程序将SBP结构域作为查询序列,在二穗短柄草中寻找包含SBP结构域的蛋白质;以水稻和拟南芥的SBP蛋白序列为查询序列,利用BLASTP程序对二穗短柄草蛋白序列进行检索。分析HMM和BLASTP的结果,鉴定出BdSPL蛋白。利用NCBI-CDD网络服务器(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和PFAM数据库对候选的BdSPL蛋白进行鉴定。共得到17个BdSPL蛋白,其相应基因依次命名为BdSPL1~BdSPL17。从ExPASY服务器(https://web.expasy.org/compute_pi/)[30]获得BdSPL蛋白质的理论等电点(PI)和相对分子质量(MW),并使用Cello Web服务器(http://cello.life.nctu.edu.tw/)预测这些蛋白质的细胞定位。
1.2 BdSPL蛋白的系统发育分析
使用CluastX 2.0软件[31]对二穗短柄草、水稻和拟南芥的SPL蛋白氨基酸序列进行比对,利用MEGA 8.0软件的邻接法(Neighbor-Joining)构建系统发育树,bootstrap参数设置为1 000[32]。
1.3 BdSPL基因的结构及保守基序分析
利用Gene Structure Display Server (http://gsds.gao-lab.org/)对其基因结构和编码序列(CDS)进行分析[33]。利用MEME v4.9.0 (http://meme-suite.org/tools/meme)分析BdSPL蛋白的保守基序,基序最佳氨基酸数10~250,最大基序数量设置为15个[34]。
1.4 二穗短柄草、水稻、小麦和玉米的SPLs共线性分析
利用MCScanX[35]软件检测二穗短柄草与水稻、玉米、小麦之间的SPL区域。使用Circos 0.67比较BdSPL与上述物种之间的共线性关系[36]。比较共线基因对的CDS和蛋白质序列,使用KAKS_Calculator软件计算KAKS比率[37]。用Wang[3]的方法计算共线基因对的发散时间(T)。
1.5 SPL的GO注释及其与其他蛋白质相互作用分析
二穗短柄草中SPL蛋白的GO注释来自PLAZA数据库(https://bioinformatics.psb.ugent.be/plaza/versions/plaza_v5_dicots/)[38]和Plant Transcriptional Regulatory Map数据库(http://plantregmap.gao-lab.org/)。使用ArenanNet V2[39]和Cytoscape软件[40]构建BdSPL与其他二穗短柄草蛋白之间的相互作用网络。
1.6 BdSPLs的启动子分析
从Ensemblplant数据库下载BdSPL基因上游1.5 kb的DNA序列,提交到PLACE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),预测启动子区域的顺式调控元件[41]。
1.7 BdSPLs的基因表达分析
从SRA数据库 (https://www.ncbi.nlm.nih.gov/sra)中获得17个BdSPL基因在九种组织[42]和不同植物激素处理下[43]的数据,分析其表达模式。
将二穗短柄草Bd21的种子铺在有滤纸的培养皿中,使水轻微没过种子,发芽3~5 d。将泥炭土、蛭石、营养土按照1∶1∶1的比例充分混匀,装到培养盆(10 cm×10 cm×8.5 cm)中。挑选长势一致且健壮的二穗短柄草幼苗移栽至培养盆中,每个培养盆3株,于16/8 h昼夜光周期、23 ℃、相对湿度55%~60%的温室培养;3~5 d浇水并施肥一次,在抽穗期采集根、叶、茎和花序进行SPL基因表达分析。
同上述方法将二穗短柄草在铺有滤纸的培养皿培养至3周龄,分别用200 mmol·L-1NaCl、100 μmol·L-1GA、100 μmol·L-1ABA和20%PEG600处理液没过幼苗根部,并用相应处理液喷湿茎和叶;同时设低温(-4 ℃)处理[44],均保持2 h后用流水冲洗幼苗;将所有样品用液氮速冻,于-80 ℃保存备用。
使用艾科瑞公司的 RNA 提取试剂盒(AG21019)提取上述材料的总RNA;使用Evo M-MLV RT-PCR试剂盒(Accurate Biology,中国湖南)合成cDNA,使用 PrimerPremier 5.0软件设计17个BdSPL基因的qRT-PCR 特异性引物(表1)。使用艾科瑞公司的Pro Taq HS预混型qPCR试剂盒(含ROX)(AG11718)参照说明书用QuantStudioTMReal Time PCR仪进行实时定量PCR。BdUBC18为参考基因,相对表达量通过2-ΔΔCT方法计算。

表1 qRT-PCR所用引物Table 1 Primers used for the qRT-PCR
2 结果
2.1 二穗短柄草SPL家族基因的鉴定和染色体定位
所得17个编码SBP蛋白的基因(表2)。在二穗短柄草的5条染色体上分布不均,其中6个分布在第3染色体上,占35%,第1、2、4染色体上均有3个,有2个位于第5染色体上。
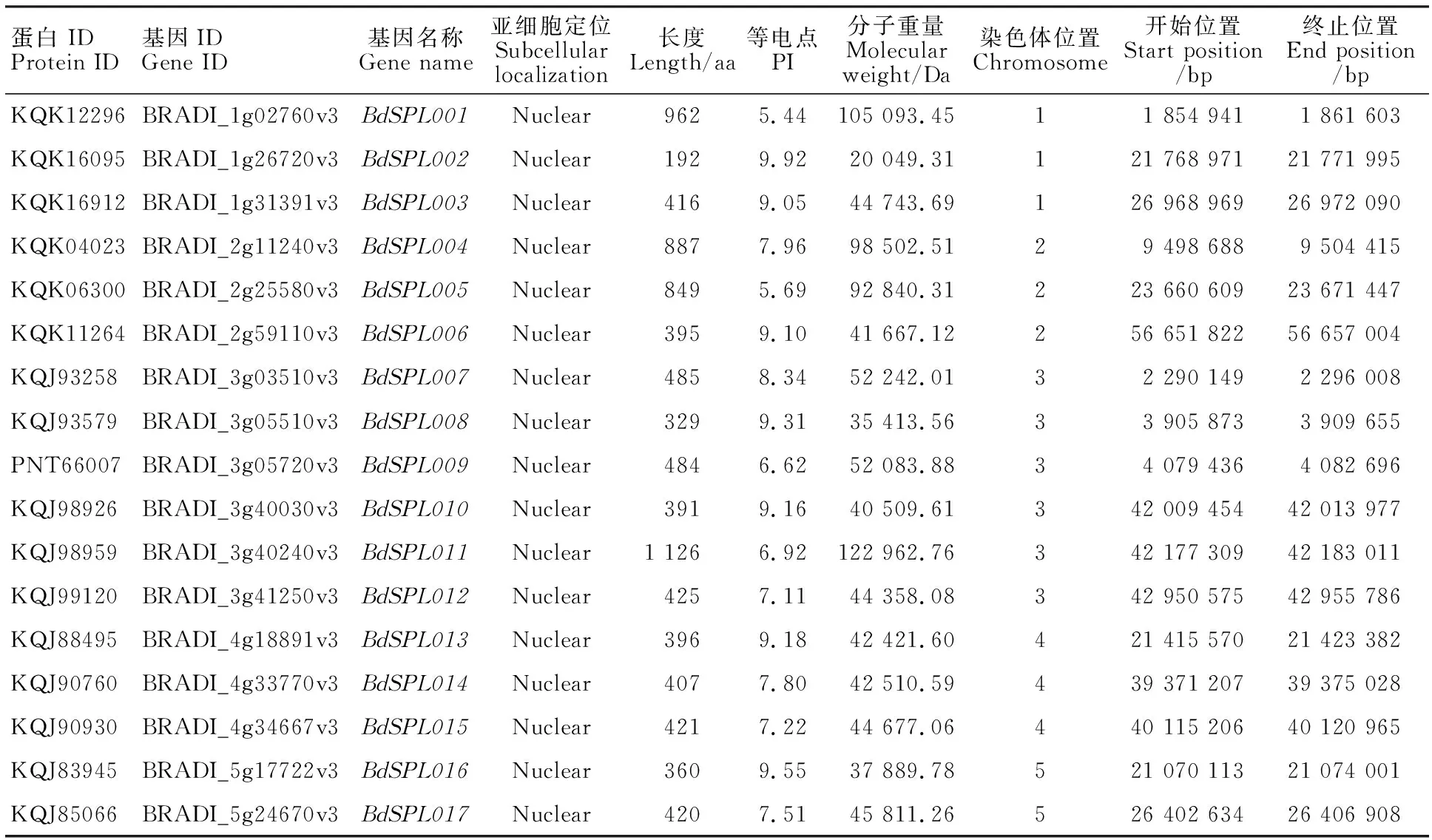
表2 二穗短柄草SPL基因家族的特征Table 2 Characteristic features of SPL gene family in B. distachyon
亚细胞定位预测发现,所有的二穗短柄草SPL蛋白定位在细胞核中。17个成员的氨基酸长度为192~1 126 aa,其中最长的是BdSPL011,最短的是BdSPL002。相对分子量20.05~122.96 kDa,等电点5.44~9.92。
2.2 BdSPLs的序列比对及系统发育分析
在17个BdSPL蛋白中,均有约76个氨基酸组成的SBP结构域(图1),其C末端有两个锌指结构,为Cys-His或Cys-Cys-His-Cys,以及一个NSL位点。
用 MEGA6.0构建二穗短柄草SPL蛋白与拟南芥、水稻 SPL蛋白的系统进化树(图2)。根据遗传变异度将这52个SPL划分成7组;其中D组和F组的SPL最多。二穗短柄草的17个SPL均匀分布在除E组外的其他6个组里。进化树中进化枝相近SPL可能来自同源基因,例如,A组中的BdSPL012和OsSPL016可能是同源基因。同一组中,二穗短柄草与水稻的SPL遗传变异度更小,说明二者关系更近。
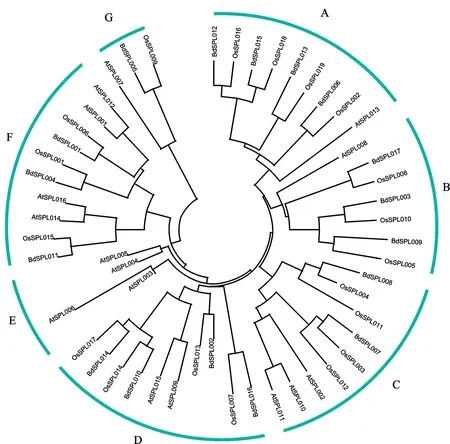
图2 二穗短柄草、拟南芥和水稻SPL系统发育树
2.3 BdSPL的基因结构和保守基序分析
基因结构分析结果(图3)表明,17个BdSPL基因的外显子数为2~11,58%的BdSPL基因含有3个外显子,图2中同组BdSPL基因结构相似。

图3 BdSPLs基因结构和保守基序分析
17个BdSPL基序分析(图3)表明,两个基序(motif 1, motif 2)包含在所有BdSPL蛋白中,推测motif 1和motif 2是SBP结构域的重要构成部分。图2中F组的BdSPL蛋白具有最多的基序数,蛋白质最长;不同组有其特定的基序,例如,motif 3、9、10和11仅存在于F组和G组的BdSPL蛋白中;motif 7存在于F组亚家族的BdSPL001、004和011中。推测同一组成员具有相似的功能。
2.4 二穗短柄草与水稻、小麦和玉米的SPL基因共线性分析
在二穗短柄草(图4A)中检测到6对基因复制事件,其中5对与片段复制事件有关,1对为串联复制事件。这表明片段复制事件对BdSPL的进化起主要作用。所有BdSPLs的Ka/Ks均小于1;复制事件的发散时间约为76 Mya。
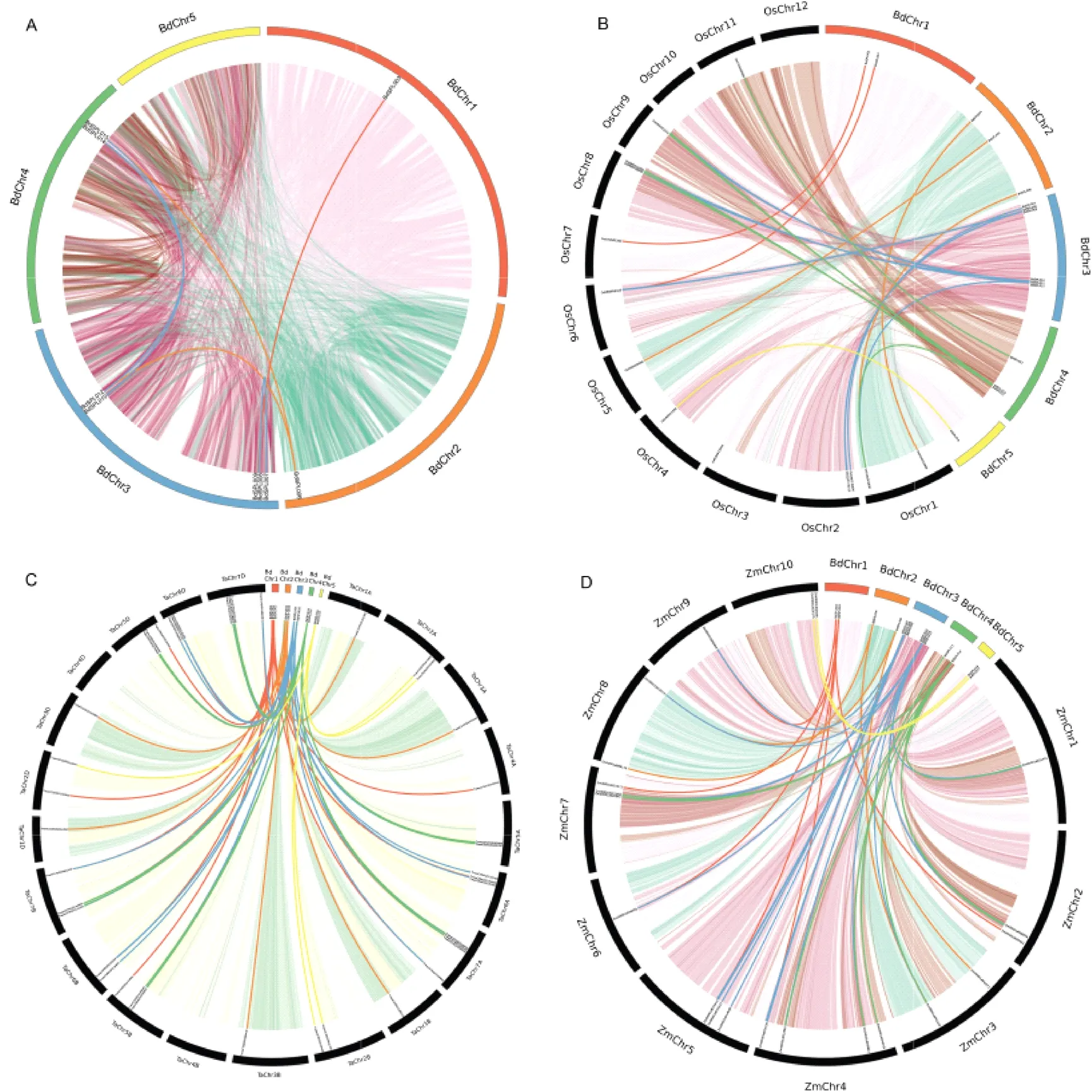
A: 二穗短柄草基因组中的重复基因对;B、C、D: 二穗短柄草与水稻、小麦、玉米间的共线性;浅色背景代表四个物种整个基因组中的共性区块,深色线条代表BdSPLs的共线基因对。
在其他3个物种中检测到125个基因与BdSPL基因是共线的,其中,水稻有23个(图4B),小麦有62个(图4C),玉米有40个(图4D)。这表明与水稻和玉米相比,小麦与二穗短柄草SPL基因相似性更高。除BdSPL012/Os01t0922600、BdSPL015/Os01t0922600、BdSPL006/TraesCS7A02G260500等10对基因的Ka/Ks值大于1外,其余115对基因的Ka/Ks值均小于1。BdSPLs与水稻的分化时间约为53 Mya,早于小麦的45 Mya,晚于玉米的57 Mya。这表明BdSPL基因经过了纯化选择,其中Ka/Ks>1的基因对在进化过程中起着重要作用。
2.5 BdSPLs的GO注释及与其他蛋白质相互作用分析
GO注释显示(图5),17个BdSPL蛋白共得到22个GO注解,其中14个与生物过程有关,2个与分子功能有关,6个与细胞组分有关。在细胞组分中,17个BdSPLs与细胞和细胞器组成有关,不到30%的BdSPLs参与膜的形成。在分子功能中,17个BdSPLs均与DNA结合,不到10%的BdSPLs具有转录调节功能。在生物过程中,超过60%的BdSPL蛋白参与了二穗短柄草的生长和发育,包括发育过程、代谢过程和生物过程。不到40%的BdSPLs能对环境压力作出反应。这说明BdSPL蛋白参与各种生理过程。
构建BdSPLs与二穗短柄草中其他蛋白之间的相互作用网络(图6),共检测到678个相互作用的蛋白分支,每个BdSPL与至少4个其他蛋白发生15次相互作用。其中,47%的BdSPLs与至少61个蛋白相互作用,如BdSPL006、007和008,表明这些SPL蛋白在蛋白网络的调节中发挥重要作用。将与BdSPL蛋白相互作用的其他蛋白的序列提交到CDD数据库,发现多数为AP2和MADS超家族。据报道,AP2家族在激素调节和花发育中具有重要作用[45]。推测BdSPL蛋白与AP2家族的蛋白相互作用调节植物的花发育。

BdSPLs蛋白标记为红色,其他蛋白标记为蓝色。
2.6 BdSPLs基因的启动子分析
为了确定BdSPL基因中包含的顺式作用元件,我们分析了这些基因上游启动子部位的1.5 kb DNA序列。结果(图7)表明,BdSPL基因启动子区域包含多种顺式元件,可分为激素和胁迫反应元件、光响应元件和植物生长发育元件三类。其中,有47%属于光反应元件。59%的基因含有G-box,推测BdSPL基因可能受光调控;88%的BdSPL基因含有与脱落酸反应相关的Abre元件,推测其参与ABA代谢途径的调节;大约58%的BdSPL基因含有ARE、CGTCA-Motif、TGACG-Motif三种元件,推测其参与厌氧诱导和MeJA介导的反应。此外,启动子序列中还有一些与植物生长发育相关的元件,如CAT-box、O2-Site和HD-ZIP-1。推测BdSPL基因在调节植物生长发育、光调节和激素反应等生理过程中发挥作用。
2.7 BdSPLs基因的表达分析
为了确定BdSPL基因的组织特异性表达模式,通过SRA数据库分析其在二穗短柄草的9个组织(叶片、早期花序、出苗花序、花药、雌蕊、授粉后5 d的种子、授粉后10 d的种子、植物胚胎和胚乳)的转录数据,并绘制了热图。结果(图8A)表明,同一亚族的BdSPL基因具有相似的组织表达模式;其中BdSPL009、-010、-014、-017等12个基因在花序早期和萌发组织中高表达,推测其与花的发育过程有关。BdSPL001、-004、-006等8个基因主要在雌蕊中表达,BdSPL001、-004、-008和-011在授粉后5 d的种子中表达。只有少数基因在授粉后10 d的叶片、种子、植物胚胎或胚乳中表达水平较高,如BdSPL004、-005和-010。推测BdSPLs主要参与花的发育。
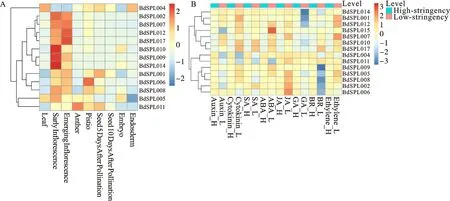
图8 BdSPLs基因在9种组织(A)、8种植物激素和胁迫(B)下的表达谱
通过SRA数据库分析了14个BdSPLs在8种植物激素高低水平处理下的表达数据(图8B)发现,与低浓度激素处理相比,BdSPL基因在高浓度下的表达一致。例如,BdSPL001、-009和-014在高浓度激素下有较高的表达水平;在低浓度条件下,BdSPL001和-014被细胞分裂素、ABA和生长素等6种植物激素上调,并被GA下调;BdSPL009在生长素、ABA和GA处理下高表达,但在BR处理下表达很低。这表明BdSPLs对低浓度激素处理更敏感。在低浓度植物激素处理下,大多数基因上调,BdSPL015在ABA处理下高表达,BdSPL002、-005和-006在JA处理下高表达,BdSPL005、-007和-012在乙烯处理下高表达而BdSPL002、-006、-008、-009、-012和-014等大多数基因被BR或GA处理下调。由此认为,BdSPLs可以正向调节JA和乙烯途径,负向调节GA和BR途径。
2.8 BdSPLs基因的表达分析
为了研究BdSPLs的功能,采用qRT-PCR技术检测17个BdSPLs在四个组织(根、叶、茎和花序)的表达模式。从图9A发现,大多数BdSPL基因在花序中的表达高于根、茎和叶;除了BdSPL006、-008、-009和-012外,其余13个基因在花序中有高水平表达,进一步证明BdSPLs与花的发育密切相关。BdSPL001、-003和-005等14个BdSPLs基因在叶中的表达高于根和茎,表明这14个基因参与了叶的发育。BdSPL006和BdSPL012基因在茎中高表达,表明这两个基因可能影响茎的发育。
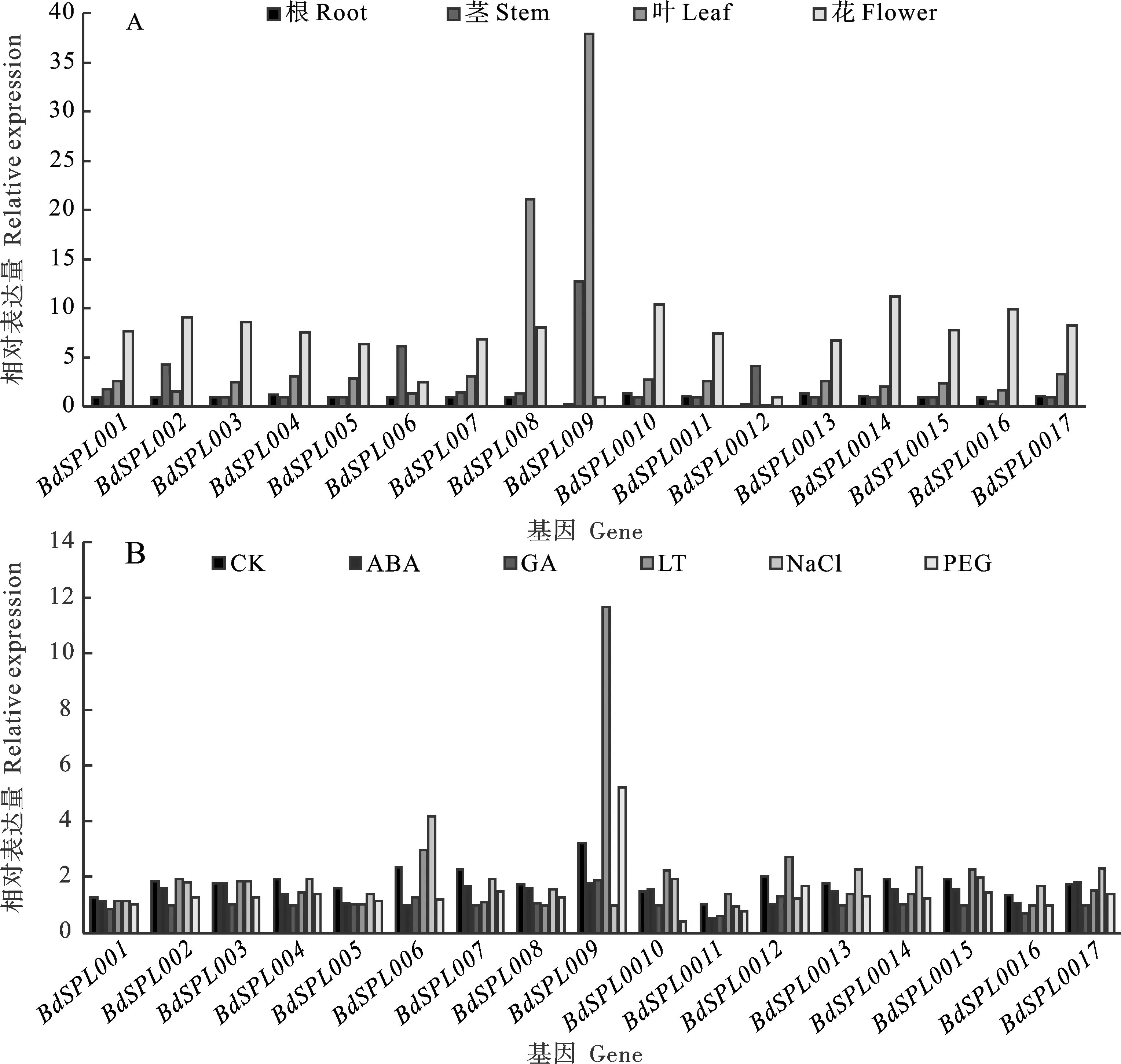
图9 17个BdSPLs基因在4个组织(A)和5种不同处理(B)下的相对表达水平
分析胁迫、温度、激素5个不同处理下17个BdSPLs的表达水平(图9B)发现,约有50%的BdSPLs在所有处理下呈下调趋势。例如,GA处理下所有BdSPLs的表达均下调,ABA处理下85%的BdSPLs表达下调,PEG处理下94%的BdSPLs表达下调,低温下,BdSPL004、-005、-007、-008、-013、-014、-016和-017共8个基因表达降低。有少数BdSPLs基因表达上调,如BdSPL005、-013、-014和-016在盐处理下表达上调,BdSPL009、-011和-012在低温处理下高表达,BdSPL006、-010和-015在盐和低温处理下均表达上调。这些结果表明,BdSPLs对GA和ABA处理及干旱处理可能有负调控作用。
3 讨论
3.1 二穗短柄草中SPL家族基因的特征
本研究采用比较基因组学的方法,从二穗短柄草全基因组中获得了17个BdSPL基因,多于拟南芥(16)[11],但少于玉米(31)[46]、水稻(19)[47]和荞麦(24)[48]。17个SPL蛋白序列长度、分子量及等电点均存在较大的差异,亚细胞定位其均在细胞核中,这与上述植物的结果一致,推测其功能保守。系统发育树将二穗短柄草、拟南芥和水稻的SPL基因分为7个组,同一组中同源性较高的基因可能具有相似的功能,如B组二穗短柄草BdSPL003和水稻OsSPL010具有较高的同源性,而水稻OsSPL010已被证明参与逆境胁迫响应及水稻生长发育过程[49],推测BdSPL003参与二穗短柄草逆境胁迫和生长发育。鉴定到17对二穗短柄草和水稻的同源SPL基因,但没有鉴定出二穗短柄草和拟南芥间的SPL同源基因对,这表明BdSPL基因与水稻的同源性高于拟南芥。本研究发现5对BdSPL基因归因于片段复制事件,只有1对BdSPL基因经历了串联复制事件,这与Liu等[48]结果一致。共线性结果表明,BdSPLs与小麦的同源基因比水稻和玉米的同源基因更多。
3.2 BdSPLs的结构
基因结构包括外显子和内含子,Xu[50]认为,内含子和外显子通过获取、丢失、插入或缺失进化。基因的结构不仅是影响基因功能的主要因素,也是了解基因家族进化的重要基础。本研究发现,BdSPL基因有2~11个外显子,大部分基因含有3个外显子。推测BdSPL基因在进化过程中因为内含子/外显子的插入和缺失导致其结构和功能产生差异,多数BdSPL基因有3个外显子,表明BdSPL基因较保守。Guo[51]认为,生物体中染色体融合或重组的原因之一是基因组进化过程中内含子/外显子数量的变化,这些变化改变了基因的功能。在本研究中,BdSPL基因内含子或外显子的数量不同,也影响了二穗短柄草SPL基因的生物学功能。
在本研究中,在BdSPL蛋白中发现了15个基序。Motif 1和motif 2主要编码SPL结构域,不同的亚族含有特定的保守基序,这与水稻[47]研究结果一致。特有的基序增加了SPL蛋白功能的多样性,特定的保守基序是其功能的关键。
3.3 BdSPL基因的潜在功能
在本研究中,大多数BdSPL基因在花序中高表达,表明BdSPL基因可能对花的发育过程中具有重要作用。Chao[52]报道了AtSPL1基因可以通过调节营养生长期下游靶基因的表达增强花序的耐热性;Liu[48]发现AtSPL2、-9、-10、-11、-13和-15促进了苦荞从营养生长到生殖生长的转化,并调控其花和茎的发育;Cui[53]报道AtSPL9缩短了植物的开花时间,调节侧根的生长。同源基因一般具有相似的功能。在本研究中,进化分析结果表明,AtSPL1和AtSPL12与BdSPL001、-004和BdSPL014高度同源;AtSPL2、-10和-11与BdSPL007、-008高度同源;AtSPL9、-15与BdSPL010、-014和-016密切相关;AtSPL13与属于A组的BdSPL基因高度同源。许多与上述AtSPL基因同源的BdSPL基因在花序中的表达水平高于其他三个组织,表明BdSPL基因可能参与花的发育。此外,在茎中低表达的BdSPL006和-012基因与AtSPL13同源,表明这两个基因可能参与了茎的发育。
通过基因芯片和miRNA测序发现,植物中很多microRNA基因响应生物和非生物胁迫,而SPL基因作为microRNA156的靶基因,也在响应环境胁迫中发挥着关键作用[54]。本研究发现,SPL基因在苗期的表达水平都很低。Wu[55-56]和Wang[57]报道miR156在苗期的表达水平最高,随着植物从苗期向成熟期转变,其表达水平逐渐降低。AtSPL3和AtSPL9的表达水平在苗期较低,在整个营养生长期逐渐升高。因此,推测miR156在苗期抑制SPL基因的表达。17个BdSPL基因均在GA和ABA胁迫下下调,表明BdSPL基因在GA和ABA介导的植物生长中起负调控作用。在PEG、盐和低温处理下,不同BdSPL基因或上调或下调。Cui[53]发现盐和干旱处理下调了AtSPL9的表达,推迟了拟南芥的开花。本研究发现,BdSPL010、-014和-016基因与AtSPL9有很高的同源性,推测这3个基因延缓开花时间。

