携带miR-122a的间充质干细胞来源外泌体对糖尿病性心肌病的作用研究
亚森江·买买提, 郭自同, 买迪娜依·斯热吉丁, 余小林, 刘小方, 程 慧
(新疆维吾尔自治区人民医院, 新疆 乌鲁木齐 830001)
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是一种心肌特异性微血管并发症,由心脏组织中对胰岛素代谢作用的抵抗(例如胰岛素抵抗)、代偿性高胰岛素血症和高血糖共同促进产生[1]。目前,虽然有治疗DCM的治疗策略,但国内外的治疗主要为控制血糖和血脂,缺乏针对受损心肌组织的有效药物或策略[2]。因此,了解临床症状,识别早期和高敏感性的诊断生物标志物,阐明潜在的致病机制,以及开发新的DCM靶向干预措施,对于改善患者的预后和预防疾病的发生和发展至关重要。在正常条件下,心肌细胞的自噬可以通过降解并回收细胞内废物和受损细胞器来维持心肌细胞能量稳态。然而自噬受损会导致心脏功能障碍,引发心力衰竭[3]。外泌体中包含microRNA和mRNA,是一种重要的生物基因传递系统,可由多种类型的细胞分泌产生,包括免疫细胞(B 细胞、T 细胞、肥大细胞、树突细胞)、神经元细胞、上皮细胞、内皮细胞、胚胎细胞、癌细胞和间充质干细胞等[4]。其中,骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSC)来源的外泌体(简称BMSC-Exos)具有修复受损组织、较低免疫原性以及易于储存和运输等优点,在治疗DCM等糖代谢异常疾病中广泛的应用。miR-122a是在肝脏中表达的miRNA,参与胆固醇和脂肪酸代谢。据报道,miR-122a的过表达显著提高细胞保护性自噬水平,上调自噬标记物LC3Ⅱ/LC3Ⅰ、Beclin1的表达[5],然而,miR-122a是否可以通过激活心肌细胞自噬治疗DCM仍不清楚,间充质干细胞来源的外泌体是否可以递送miR-122a发挥作用仍需进一步研究。在本实验中,通过将miR-122a转染至小鼠BMSC-Exos中,并用于治疗高脂高糖饮食联合STZ诱导DCM 模型小鼠,观察其对DCM小鼠的治疗作用,并评估心肌细胞自噬水平,旨在为DCM的临床药物开发提供一定的参考意义。
1 材料与方法
1.1实验动物:30只C57/B6小鼠均购自北京唯尚立德生物科技有限公司,实验动物生产许可证号 SCXK(京)2021-0010,SPF级,体质量18g~20g,共计30只。所有小鼠均饲养在统一的动物房内,自由进食饮水,保持动物房室内温度21~25℃,12h昼夜温控。适应性喂养7d后进行实验。
1.2主要试剂和仪器:链脲佐菌素(Streptozocin,STZ;货号:S0130)购自美国Sigma公司;α-MEM培养基(货号:MEL08)、DMEM低糖完全培养基(货号:MBS2567505)购自武汉艾美捷科技有限公司;胎牛血清(货号:164210)购自武汉普诺赛生命科技有限公司;0.25% 胰酶消化液(货号:C0201)、RIPA裂解液(货号:P0013B)和BCA蛋白浓度检测试剂盒(货号:P0009)购自上海碧云天生物技术有限公司;Exosome Purification Column 外泌体纯化柱(货号:41212ES);Lipofectamine 2000(货号:11668-027)、miR-122a模拟物和miR-NC质粒均购自美国Invitrogen;CD63(货号:ab1318)、CD81(货号:ab219209)、LC3Ⅱ(货号:ab232940)、LC3Ⅰ(货号:ab128025)、Beclin1(货号:ab302669)、γH2AX(货号:ab81299)、内参GAPDH(货号:ab8245)以及HRP标记的二抗(货号:ab6721)购自美国abcam;ECL化学检测液(货号:PE0010)购自北京索莱宝科技有限公司;ROS(货号:ml092661)、IL-1β(货号:ml028595)、IL-6(货号:ml063159)和TNF-α(货号:ml002095)的ELISA试剂盒购自上海酶联生物科技有限公司。TRIzol试剂(货号:R0016)、逆转录试剂盒(货号:AORT-0020)购自美国GeneCopoeia;全数字彩色多普勒超声诊断仪(DW‐PE582)购自大为医疗(江苏)有限公司;Bio-Rad ChemDoc高灵敏度化学发光成像系统(货号:ChemiDoc)购自美国Bio-Rad。
1.3实验方法
1.3.1BMSC的分离、培养及鉴定:小鼠经异氟醚吸入麻醉后脱颈处死,分离其完整的后肢,浸入75%酒精中消毒,无菌下剔除黏附于股骨和胫骨的软组织,暴露出骨髓腔,使用α-MEM培养基反复冲洗髓腔,收集冲洗液,使用细胞筛网以去除其他组织,1200g室温离心5min,弃上清,保留沉淀,用含10%胎牛血清的α-MEM培养基重悬细胞,转到培养皿中,在温度37℃,含有5% CO2恒温细胞孵育箱培养,待细胞融合度达80%~90%,用0.25%胰酶消化细胞进行细胞传代,倒置显微镜下观察细胞形态较为均匀,培养5d后,细胞呈纺锤形,且螺旋状排列。在培养10d时观察到细胞数目明显增多,分布均匀,纺锤形明显。取第4代BMSC用于后续实验。
1.3.2细胞转染:取第4代BMSC,将细胞分为miR-122a和miR-NC组,调整细胞浓度为1×106/mL,接种于10cm的细胞培养皿,37℃、体积分数为5%CO2培养箱内培养24h,观察细胞80%融合后开始转染,严格按照说明书采用Lipofectamine 2000将miR-122a和miR-NC转染至BMSC细胞中。将转染后的细胞在37℃,体积分数为5% CO2培养箱内培养4~6h后,加入8mL含体积分数为10%无外泌体血清的DMEM低糖完全培养基培养48h。显微镜下观察细胞状态并拍照,分别收取上清液及细胞样本进行后续实验。
1.3.3外泌体提取及鉴定:将转染后细胞培养上清液以5000g离心10min去除细胞碎片,3000g离心10min以去除死细胞,4℃以12000g离心60min,弃上清,用PBS均匀吹打,4℃以15000g离心2min,保留上清液,该上清液中富含外泌体颗粒。将收获的外泌体颗粒粗品转入Exosome Purification Filter(EPF)柱上室中,于4℃以5000g离心10min,离心后收集纯化后的外泌体颗粒,电镜显微镜观察外泌体形态,并使用Western blot检测其CD63、CD81的表达,步骤参考1.3.4。
1.3.4Western blot检测蛋白表达:加入RIPA裂解液提取心肌组织样品,BCA法测定上清液中蛋白浓度,加入蛋白上样缓冲液,沸水浴煮沸10min。按照SDS-PAGE凝胶试剂盒说明将蛋白样品加至胶孔中,电泳100min后利用湿转法进行转膜,5%脱脂牛奶室温封闭1h,加入一抗CD63(1∶1000)、CD81(1∶1000)、LC3Ⅱ(1∶1000)、LC3Ⅰ(1∶1000)、Beclin1(1∶1000)、γH2AX(1∶1000)以及内参GAPDH(1∶2000),4℃孵育过夜。缓冲液清洗一抗,加入HRP标记的二抗(1∶5000),室温孵育二抗2h,再次洗涤。ECL化学检测液浸润PVDF膜1min,置于化学发光成像系统中成像。
1.3.5DCM模型的建立与分组给药:将30只C57/B6小鼠平均分为3组:对照组、miR-122a组和miR-NC组,每组10只。参考文献诱导DCM模型。miR-122a组和miR-NC组给予高脂高糖饮食饲养,分别于第5、6周时经腹腔注射STZ(80mg/kg),对照组腹腔注射等量枸橼酸钠缓冲液,每周检测血糖和体重变化。分别于第7、8周,miR-NC组尾静脉注射BMSC-Exos-miR-NC(200μg/kg),miR-122a组尾静脉注射BMSC-Exos-miR-122a(200μg/kg)进行治疗,实验第12周时处死小鼠。
1.3.6检测各组小鼠心功能指标:实验第12周时,将小鼠以3%水合氯醛麻醉,左侧卧位,采用全数字彩色多普勒超声诊断仪DW‐PE582检测舒张末期室间隔厚度(IVSd)、左舒张末期后壁厚度(PWd)、左室短轴缩短率(LVFS)、每搏输出量(SV)、心排出量(CO)、左室舒张末期内径(LVDd)、左室收缩末期内径(LVDs)和左室质量(LVM)。
1.3.7HE检测心肌组织病理水平:收集小鼠心肌组织并用4%多聚甲醛固定过夜,然后进行10% EDTA脱钙、石蜡包埋和切片(切割约5μm)。使用不同纯度乙醇对5μm切片进行脱蜡和再水化,然后用苏木精和伊红染色。切片经乙醇脱水,再经二甲苯透明10min。将已透明的切片滴上树胶,盖上盖玻片封固,显微镜下观察心脏病理结构。
1.3.8ELISA检测心肌组织ROS、IL-1β、IL-6和TNF-α水平:利用ELISA试剂盒标准流程,严格按照说明书检测心肌组织上清液中ROS、IL-1β、IL-6和TNF-α水平。根据标准品浓度对应吸光度制作标准曲线,并根据样品吸光度计算样品相应浓度。
1.3.9qRT-PCR检测基因的表达水平:使用Trizol试剂提取细胞中的总RNA,酶标仪检测RNA浓度和纯度,按照逆转录试剂盒和qRT-PCR试剂盒实验说明,依次进行逆转录和qRT-PCR实验。qRT-PCR反体系:cDNA模板2ng,上下游引物各0.4μL,SYBR Primix Ex TaqTM 5μL,ddH2O补充至10μL。qRT-PCR反应条件:95℃(30s)预变性后,变性95℃(7s),退火55℃(30s),72℃(15s),40个循环周期。扩增结果根据2-△△Ct法计算mRNA的相对表达量。qRT-PCR引物序列:CAPDH-F,5-AATGGGCAGCCGTTAGGAAA-3,CAPDH-R,5-GCGCCCAATACGACCAAATC-3;miR-122a-F,5-GCTGTGGAGTGTGACAATGG-3,miR-122a-R,5-GCCTAGCAGTAGCTATTTAGTGT-3。

2 结 果
2.1过表达miR-122a BMSC构建:qRT-PCR结果显示,与BMSC-miR-NC(1.09±0.19)比较,BMSC-miR-122a(13.36±2.32)中miR-122a表达升高(t=10.02,P=0.012),见图1。说明过表达miR-122a的BMSC构建成功。
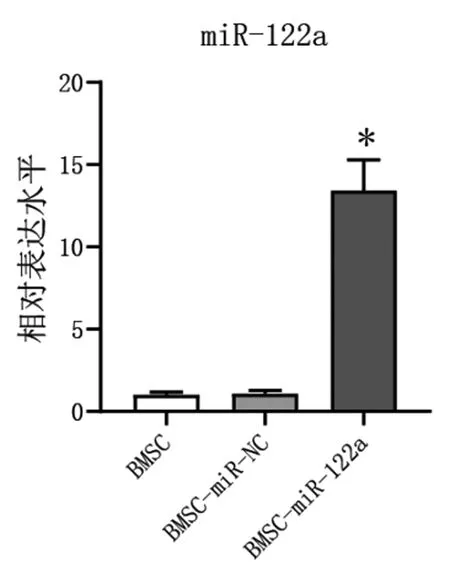
图1 三组细胞中miR-122a表达
2.2携带miR-122a BMSC-Exos鉴定:电镜显微镜观察显示,外泌体呈现圆形颗粒状形态,粒径集中在100nm附近,见图2A。Western blot结果显示,与BMSC细胞比较,BMSC-Exos-miR-NC和BMSC-Exos-miR-122a中CD63和CD81蛋白表达升高,见图2B。此外,与BMSC-Exos-miR-NC(1.00±0.05)比较,BMSC-Exos-miR-122a(7.42±1.67)中miR-122a表达升高(t=6.78,P=0.023),见图2C。
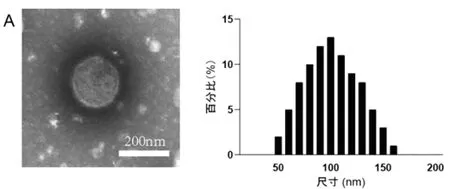
图2 携带miR-122a的外泌体鉴定
2.3携带miR-122a BMSC-Exos改善DCM心功能指标:各组小鼠心功能检测结果显示,与对照组(0.57±0.10)(0.59±0.06)(27.68±1.04)(28.33±1.67)(12.33±0.99)(3.01±0.44)(2.08±0.13)(47.33±2.67)比较,miR-NC组小鼠IVSd(0.42±0.08)(t=6.98,P=0.026)、PWd(0.41±0.09)(t=6.13,P=0.033)、LVFS(21.99±1.65)(t=7.28,P=0.018)、SV(21.37±1.42)(t=6.97,P=0.022)、CO(9.34±0.88)(t=3.90,P=0.045)显著降低,LVDd(3.50±0.17)(t=5.47,P=0.038)、LVDs(2.84±0.19)(t=6.53,P=0.030)、LVM(58.89±2.34)(t=7.65,P=0.017)显著升高。与miR-NC组比较,miR-122a组IVSd(0.53±0.07)(t=10.88,P=0.011)、PWd(0.54±0.05)(t=4.41,P=0.042)、LVFS(27.11±1.89)(t=6.60,P=0.029)、SV(26.99±2.00)(t=6.49,P=0.031)、CO(11.80±1.12)(t=5.77,P=0.036)显著升高,LVDd(3.10±0.09)(t=4.38,P=0.041)、LVDs(2.13±0.14)(t=5.39,P=0.039)、LVM(51.23±1.89)(t=7.01,P=0.020)显著降低,见图3。

图3 三组小鼠心功能
2.4携带miR-122a BMSC-Exos缓解DCM心肌细胞损伤:HE结果显示,对照组小鼠心肌组织形态正常,未见炎性细胞浸润,心肌纤维排列整齐。miR-NC组小鼠心肌组织形态异常,心肌纤维断裂。miR-122a组小鼠心肌组织形态恢复,心肌纤维断裂恢复,见图4。Western blot结果显示,与对照组(0.17±0.02)比较,miR-NC组小鼠心肌组织γH2AX蛋白表达水平(1.17±0.07)显著升高(t=6.53,P=0.030);与miR-NC组比较,miR-122a组小鼠心肌组织γH2AX蛋白表达水平(0.38±0.11)显著降低(t=5.57,P=0.037),见图5。
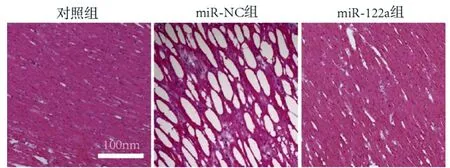
图4 三组小鼠心肌组织病理

图5 三组小鼠心肌组织γH2AX表达
2.5携带miR-122a BMSC-Exos降低DCM炎症水平:ELISA结果显示,与对照组(2159.12±33.98)(21.80±2.99)(38.74±2.11)(102.99±1.21)比较,miR-NC组小鼠心肌组ROS(3154±29.08)(t=6.69,P=0.024)、IL-1β(40.80±4.81)(t=6.61,P=0.025)、IL-6(70.25±5.90)(t=5.98,P=0.034)和TNF-α(189.77±10.11)(t=3.21,P=0.046)水平显著升高;与miR-NC组比较,miR-122a组小鼠心肌组织ROS(2350.23±29.76)(t=7.33,P=0.018)、IL-1β(28.70±3.77)(t=7.091,P=0.020)、IL-6(54.30±5.88)(t=6.07,P=0.033)和TNF-α(126.03±10.24)(t=6.91,P=0.022)水平显著降低,见图6。

图6 三组小鼠心肌组织炎症水平
2.6携带miR-122a BMSC-Exos恢复DCM心肌细胞自噬水平:Western blot结果显示,与对照组(1.41±0.13)(0.81±0.05)比较,miR-NC组小鼠心肌组织LC3Ⅱ/LC3Ⅰ(0.23±0.07)(t=7.11,P=0.019)、Beclin1(0.33±0.08)(t=4.67,P=0.040)蛋白表达水平显著降低;与miR-NC组比较,miR-122a组小鼠心肌组织LC3Ⅱ/LC3Ⅰ(0.73±0.06)(t=10.66,P=0.010)、Beclin1(0.57±0.08)(t=8.33,P=0.014)蛋白表达水平显著升高,见图7。

图7 三组小鼠心肌组织自噬水平
3 讨 论
目前临床上的非药物治疗、药物治疗和手术治疗均不能从根本上治疗DCM等心脏疾病,因此,基于BMSC的细胞及细胞器疗法引起了人们越来越多的关注。作为一种细胞外囊泡,外泌体具备良好的生物相容性、稳定性以及较低的毒性,已经成为组织工程和再生医学的重要工具。例如BMSC-Exos可通过调节小胶质细胞M1/M2表型减轻脑缺血再灌注损伤诱导的神经炎症和细胞焦亡。此外,来自缺氧BMSC-Exos携带的microRNA-98-5p可通过激活PI3K/Akt信号通路抑制心肌缺血再灌注损伤,这表明了BMSC-Exos对于心肌功能性疾病具有潜在的治疗作用。
微小RNA(miRNA)可在转录后水平调节基因表达。当给予miR-122治疗可以通过靶向Fibulin-1(一种与细胞外基质重塑有关的分泌蛋白)来逆转糖尿病性心肌病中的心脏肥大和纤维化,强化心脏功能[6],表明miR-122a在心脏功能重塑中起关键作用。本实验通过提取小鼠BMSC,转染miR-122a后,通过提取BMSC-Exos,鉴定miR-122a的表达,并用于治疗DCM。结果发现携带miR-122a BMSC-Exos改善了DCM小鼠的心功能指标,缓解了心肌细胞损伤,促进了心肌组织形态恢复,抑制心肌纤维断裂,降低了心肌炎症细胞浸润和炎症因子的表达水平,说明携带miR-122a BMSC-Exos对DCM具有较好的治疗作用。
自噬是影响心脏形态发育的关键过程,可保护心肌细胞应对多种应激刺激。然而,自噬紊乱会导致心脏损伤,引发心脏性疾病,例如心肌病、心肌肥大和缺血/再灌注损伤。据报道,持续的高血糖和胰岛素信号传导受损可以通过增强心肌细胞中的mTOR信号进一步抑制心脏自噬[7]。此外,糖尿病患者体内过度的心肌炎症也会通过损害心脏自噬而导致DCM。同时,摄入高脂肪和精制碳水化合物的饮食会导致心脏胰岛素代谢信号受损、氧化应激和心脏纤维化[8]。而miR-122a可通过抑制PI3K/Akt/mTOR通路诱导肝细胞自噬介导的细胞凋亡[9]。在本研究中,在给予高脂高糖饮食饲养,腹腔注射STZ诱导小鼠DCM后,通过检测小鼠自噬相关蛋白(LC3Ⅱ/LC3Ⅰ、Beclin1)的表达,初步发现DCM小鼠心肌细胞自噬水平降低,这与前人研究结论一致。而使用携带miR-122a BMSC-Exos治疗后,小鼠心肌组织LC3Ⅱ/LC3Ⅰ、Beclin1蛋白表达水平升高,说明携带miR-122a BMSC-Exos可以提高DCM小鼠的心肌细胞自噬能力。
综上所述,本研究在高脂高糖饮食联合STZ诱导小鼠DCM模型中,心肌细胞自噬水平降低,而携带miR-122a的BMSC-Exos可通过恢复心肌细胞自噬水平,降低炎性水平和细胞损伤,改善DCM的疾病症状。本研究从恢复DCM患者心脏自噬的角度,揭示携带miR-122a的BMSC-Exos对于心脏功能的改善作用,为DCM的临床治疗提供新的治疗思路。

