鹅源阪崎杆菌分离鉴定及相关耐药与毒力基因检测
路振香, 俞亚楠, 朱贺云, 张树承, 王龙豪,王梦侥, 郭伟娜, 刘 畅, 李贺侠, 张 宁
(1.安徽科技学院 动物科学学院,安徽 凤阳 233100;2.安徽省和县动物疫病预防与控制中心,安徽 和县 238200;3.南京市栖霞区动物卫生监督所,江苏 南京 210046)
阪崎杆菌(Enterobactersakazaii)曾被称为“黄色色素泄殖腔肠杆菌”,直到Farmer等人对阪崎杆菌的研究发现该菌与阴沟肠杆菌存在一定程度的差异,才更名为阪崎杆菌[1],也称为克罗诺杆菌。克罗诺杆菌隶属于肠杆菌科,为人和动物肠道内的兼性厌氧革兰阴性杆菌,该属中临床感染最常见的致病菌就是阪崎杆菌[2]。出生时体重偏低的新生儿和6 个月以下婴儿(断奶前)是阪崎杆菌感染的高危人群,其他年龄段的人群也可感染该菌,如免疫力低下的成年人。患者常发菌血症、阑尾炎、败血病、骨髓炎、肺炎、脾脓肿、伤口感染和尿路感染等[3-4]。该菌作为一种重要的条件性致病菌广泛分布于自然界,如在奶粉、肉类、蔬菜、谷类等多种食品,昆虫以及家庭和工厂环境中均检出过该菌[5-6]。现阶段对阪崎肠杆菌的研究主要是在婴幼儿乳制品生产监控方面,该菌在动物致病方面的报道较少[7-8]。
本研究拟对送检的精神不振、食欲下降、腿软、排黄白或者黄绿色稀粪为主要症状,以心包炎、腹膜炎、气囊炎、肠道广泛性出血、肾脏肿大等为主要病理变化的25日龄病死鹅进行病原菌的分离鉴定、药敏试验及耐药基因、毒力基因检测,为该病的实验室诊断提供参考资料,为养殖户用药给予指导,并对其耐药机制和致病机理进行初步探讨。
1 材料与方法
1.1 材料
1.1.1 送检动物 8只25日龄疑似感染阪崎杆菌病死鹅。
1.1.2 主要试剂 Premix TaqTM和DL2000 DNA Maker均购自Takara Bio宝生物工程(大连)有限公司。
1.1.3 药敏纸片 庆大霉素、头孢哌酮、恩诺沙星等细菌药敏试纸盒(扩散法)由杭州滨河微生物有限公司生产,批号:20210815。
1.1.4 供试动物 6只32~36 g昆明小鼠(动物合格证编号为No.2023050403),雌雄随机,由安徽科技学院实验动物中心提供。
1.2 方法
1.2.1 病原菌的分离培养、纯化及镜检 暴露病死鹅肝脏和心脏,用灼烧后的手术刀分别在肝脏、心脏上穿刺,用无菌接种环蘸取穿刺处组织液,分别划线接种于血琼脂、麦康凯琼脂、LB琼脂平板,37 ℃下培养18~24 h。对培养的典型菌落进行纯化、革兰氏染色,镜检。
1.2.2 分离菌生化试验 将分离菌分别进行吲哚形成试验、糖类发酵试验、甲基红试验、VP试验。
1.2.3 分离菌DNA模板制备、PCR扩增及琼脂糖凝胶电泳 采用分离纯化后的LB琼脂平板上过夜培养的分离菌的DNA模板。由通用生物系统(安徽)股份有限公司合成16S rRNA上、下游引物,并扩增16S rRNA基因序列。上游引物序列27F:AGAGTTTGATCCTGGCTCAG,下游引物序列1492R:GGTTAACCTTGTTACGACTT。PCR反应体系、扩增条件及琼脂糖凝胶电泳按照李珂等[9]方法进行。
1.2.4 分离菌16S rRNA的PCR产物测序、同源性分析 PCR产物由通用生物系统(安徽)有限公司测序后,将测序结果在NCBI网站blast比对,确定该分离菌种属。
1.2.5 分离菌体外药敏试验 分离得到的菌株接种到LB营养肉汤,待生长至对数期后,用涂布棒将其涂布到营养琼脂培养基上,用无菌眼科镊夹取药敏试纸片均匀贴到培养基表面,37 ℃下培养12~18 h。
1.2.6 分离菌耐药基因的PCR扩增及琼脂糖电泳 根据路振香等[10]方法,针对磺胺类耐药基因sul1、卡那霉素耐药基因aadA1、β-内酰胺酶类耐药基因blaterm-1、头孢菌素类耐药基因baCMY-2、喹诺酮耐药基因qnr,分别进行5种耐药基因的PCR扩增及琼脂糖凝胶电泳。
1.2.7 分离菌毒力基因的PCR扩增 分离菌的分子生物学鉴定结果显示,该分离菌为阪崎杆菌,参照Cruz等[11]方法,检测该菌ompX、cpa、hly和sip等4种毒力基因,即ompX(outermembraneproteinX),为阪崎杆菌毒力决定因子之一;hly(hemolysin)为该菌的溶血素基因;cpa(cronobacterplasminogenactivator)为阪崎杆菌血浆纤溶酶原激活物基因;sip(siderophore-interactingprotein)为该菌的一种致病基因。毒力基因引物序列见表1,PCR反应体系为25 μL:12.5 μL Mix、1 μL上游引物、1 μL下游引物、2 μL细菌DNA模板,8.5 μL超纯水。PCR扩增条件:95 ℃下预变性5 min;95 ℃下变性40 s,58.5 ℃下退火50 s,72 ℃下延伸40 s,共30个循环;72 ℃下终延伸10 min。

表1 毒力基因PCR引物序列
1.2.8 分离菌致病性试验 将6只体质量在32~36 g的小鼠随机分成对照组与试验组,每组3只,试验组小鼠每只腹腔接种在LB液体培养基中已经培养20 h的分离菌的培养物0.2 mL(约5×108CFU/mL),对照组小鼠每只腹腔接种0.2 mL LB液体培养基,将接种后的小鼠分别隔离饲养,每日上午、下午及晚上观察记录小鼠的精神状态、采食量、发病、死亡等情况,连续观察7 d,及时对死亡小鼠进行病原菌的分离培养。7 d后对未死亡小鼠进行剖检和细菌分离培养。
2 结果与分析
2.1 致病菌的分离培养及染色结果
从送检的病死鹅肝脏组织中分离到1株革兰氏阴性、中等大小、单个存在的球杆菌(图1)。该菌培养特性见表2。

表2 分离菌培养特性
2.2 分离菌生化试验
该分离菌能发酵葡萄糖、乳糖、蔗糖及甘露醇,既产酸又产气;甲基红及吲哚形成试验结果均为阴性;VP试验结果为阳性。
2.3 分离菌16S rRNA序列PCR产物琼脂糖电泳凝胶结果及进化树构建
经过对分离菌的16S rRNA序列的PCR扩增产物琼脂糖凝胶电泳,扩增出与预期大小一致的DNA片段(图2)。
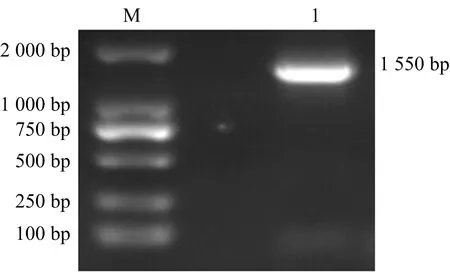
图2 分离菌16S rRNA基因序列扩增琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of 16S rRNA gene sequence amplified fication 注:M为DL2000 DNA marker;1为分离菌。
将该分离菌的测序结果在Gene Bank上进行同源性比对,该菌与Gene Bank上登录号为NR_074902阪崎杆菌的同源性超过99%,因此,该菌为阪崎杆菌,另外从Gene Bank上选取9株与该分离菌同源性较高的阪崎杆菌构建进化树(图3)。
2.4 分离菌体外药敏试验
从表3可以看出,该菌对庆大霉素、头孢呋辛、氟苯尼考、复方新诺明、安普霉素等耐药,对沙拉沙星、痢特灵、头孢噻呋钠等中度敏感,对头孢哌酮敏感。建议养殖户使用头孢哌酮进行治疗,第2天死亡大幅度减少,鹅群疫情很快得到控制。
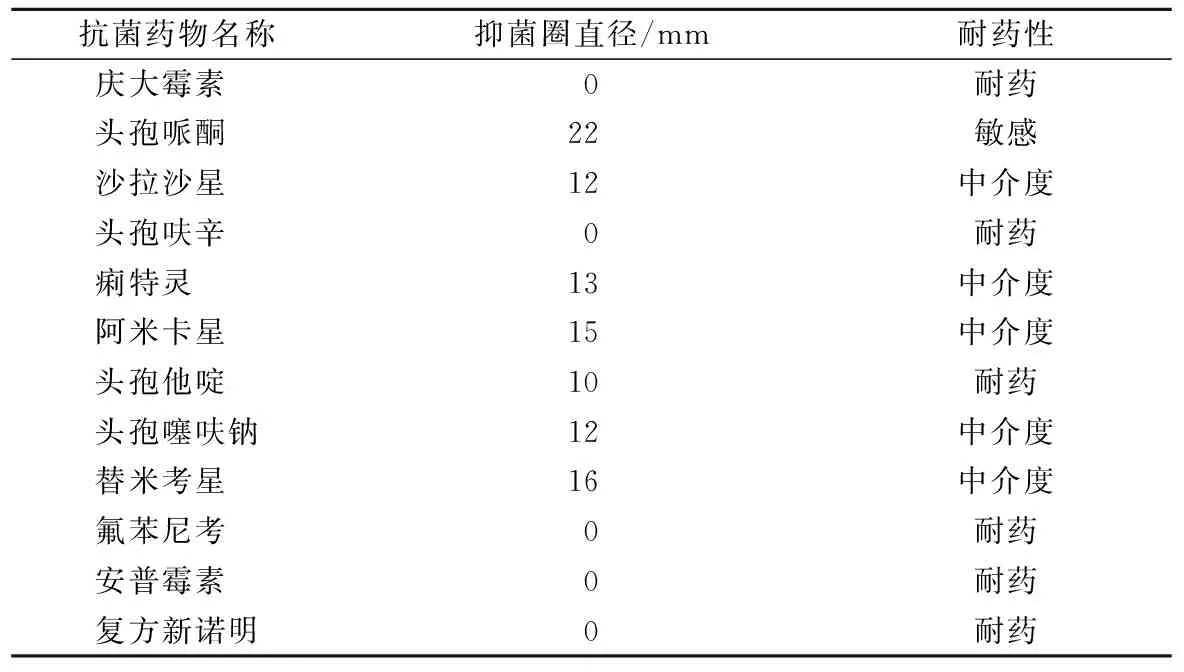
表3 分离菌体外药敏试验
2.5 分离菌耐药基因的PCR扩增结果
从图4可知,该菌含有磺胺类耐药基因sul1、卡那霉素耐药基因aadA1、β-内酰胺酶类耐药基因blatem-1-2和喹诺酮耐药基因qnr。该菌不含头孢菌素类耐药基因baCMY-2。
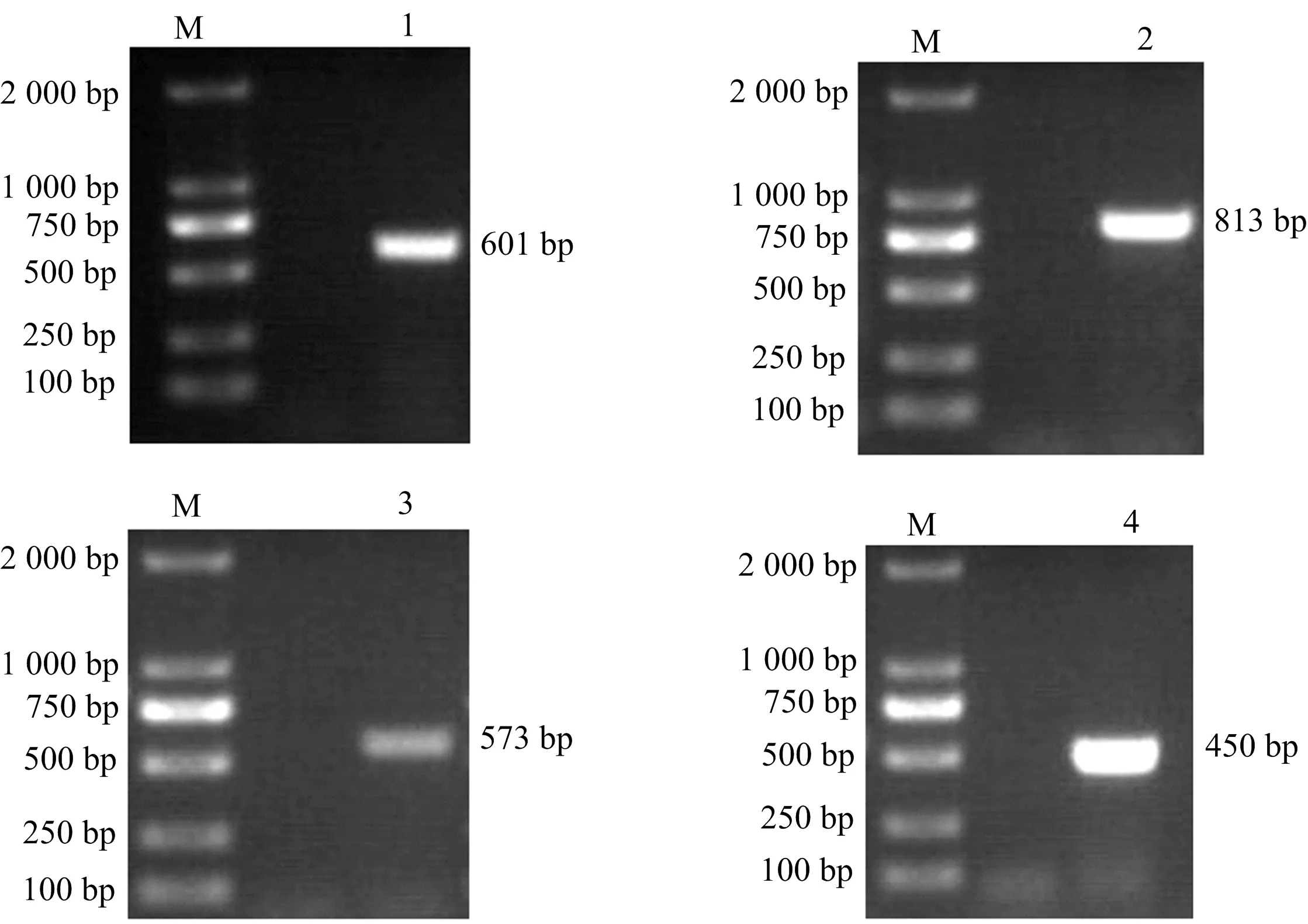
图4 分离菌耐药基因PCR产物电泳图Fig.4 Electrophoretic map of PCR products of drug resistance genes of isolated bacteria注:M为DL2000 marker;1为blatem-1;2为sull;3为aadAl;4为 qnr。
2.6 分离菌毒力基因的检测
从图5可知,该菌含有ompX、cpa和sip等3种毒力基因。ompX(outermembraneproteinX)为阪崎杆菌毒力决定因子之一,该基因与其对宿主细胞的侵袭力密切相关。
2.7 分离菌致病性试验
试验组小鼠于接种后第2天全部死亡,从死亡小鼠的肝脏中分离到该分离菌,剖检死亡鼠,主要病理变化是肝脏肿大,腹腔及空肠内有黄色粘稠液体。对照组小鼠均正常存活,第7天处死对照组小鼠后剖检,各脏器均未见异常。
3 结论与讨论
从送检的病死鹅肝脏组织中分离到1株革兰氏阴性、中等大小、单个存在的球杆菌,对其16S rRNA序列同源性分析结果显示,该菌为阪崎杆菌。药敏试验结果显示,该分离菌株耐药性强,对试验所选用的多数抗菌药物都不敏感,建议养殖户使用敏感的头孢哌酮舒巴坦进行治疗,鹅群疫情3 d后得到控制。耐药基因扩增结果显示,该菌除了不含头孢菌素类耐药基因baCMY-2外,其他4种耐药基因都含有,该结果与药敏试验结果一致。李秀娟等[12]的研究发现,阪崎杆菌对多种抗生素敏感,且每个菌株的耐药性有差异。近年来,由于抗菌药物的不规范、不合理使用,该菌耐药性问题也越来越严重,多重耐药菌株不断出现[13]。因此,对细菌性疾病的治疗,最好进行药敏试验,选择敏感的药物进行治疗,在使用抗菌药物时应要按照疗程和药物说明书标示的剂量合理用药,尽可能降低细菌耐药性的产生,减少盲目用药,最大程度地降低养殖成本。毒力基因PCR扩增结果显示,该菌含有ompX、cpa和sip等3种毒力基因。ompX为阪崎杆菌毒力决定因子之一,参与对宿主细胞的侵袭,能够抵御宿主细胞的防御机制;cpa为阪崎杆菌血浆纤溶酶原激活物,能够帮助阪崎杆菌抵抗补体依赖性血清的杀伤力以及对纤溶酶原有活化作用;sip为阪崎杆菌的一种致病基因与其致病性密切相关。动物感染试验表明,感染小鼠于接种后的第2天全部死亡,因此,该菌对小鼠的致病性强,可能与该菌含有的毒力基因密切相关[14-15]。
本试验送检的病死鹅来自安徽省滁州市某养殖户饲养在当地一个水塘中的鹅群,鹅群发病的原因可能是由于水源被阪崎杆菌患者的粪便污染而引起的,由此可知,对于水禽养殖场所要经常进行消毒,以防止肠道传染病的发生。

