猪苓多糖对二乙基亚硝胺诱发肝细胞癌早期炎症改善作用
张钦元, 谢 斌, 张从军
(1.安徽医科大学第一附属医院 肿瘤科,安徽 合肥 230032;2.安徽省六安市人民医院 肿瘤科,安徽 六安 237008)
根据每年全球癌症发病率报告,2020年全球肝癌发病率位居第6位,在癌症导致死亡率中肝细胞癌位于第3位,肝细胞癌(Hepatocellular Carcinoma,HCC)在原发性肝细胞癌中占比达到85%~90%[1]。HCC临床早期一般无明显症状,一旦发现多为晚期,错过手术切除治疗时机,导致五年存活率较低,只有18%左右[2]。HCC的发生一般经历肝脏组织炎症至肝脏组织纤维化,再至肝脏组织硬化,最终发展成为肝细胞癌。已证实亚硝胺具有诱发人类肝脏癌变的致癌作用[3]。亚硝胺在环境中广泛存在,腌鱼、腌肉、奶酪、奶粉、酒精饮料和烟草烟雾等都有其存在。食品及食品添加剂、农用化学品或药品残留中的亚硝酸盐、在胃酸性环境下与胺作用可转化为亚硝胺[4]。二乙基亚硝胺(Diethylnitrosamine,DENA)具有肝毒性和诱导原发性肝细胞癌作用[5-6]。诱发HCC形成的大小鼠模型,其形成机制和特征与人类HCC形成过程相似。肝细胞损伤、坏死及增生是DENA诱导原发性肝细胞癌公认的机制[7-8]。DNA加合物(Adducts)是DNA片段与致癌化学物质结合形成的复合物,DENA在肝脏中被细胞色素P450酶(CYP450),特别是CYP2E1生物激活,通过核苷酸烷基化机制产生DNA加合物,DNA加合物诱导肝细胞基因突变导致癌症起始,这个生物激活过程随后导致氧化应激和细胞损伤,这是引发癌变的关键步骤[5, 9-12]。一氧化氮(Nitric oxide,NO)具有影响脱氧核苷酸和DNA合成的作用[13]。DENA在肝组织诱导NO产生,抑制DNA的合成,导致核苷酸缺乏[14]。核苷酸缺乏促进癌症早期阶段的基因组不稳定性[15],在所有的实体瘤和白血病中都有DNA双链断裂和染色体不稳定表现[16-17]。探寻一种药物抑制CYP2E1活性和NO的产生,阻止DENA对脱氧核苷酸合成的影响,保证DNA正常合成,进而维持染色体的稳定,达到预防和阻断致癌物亚硝胺诱发HCC的发生和发展具有重大的医学价值。
猪苓多糖(Polyporusumbellatuspolysaccharides,PUPs)是从中药猪苓中提取具有多种生物学活性的多糖类物质。研究发现PUPs可通过调节细胞周期、调节免疫细胞功能、影响癌细胞相关信号通路等机制发挥抗肿瘤作用。PUPs对膀胱癌、胃癌、结肠癌、肺癌和乳腺癌等都有一定治疗作用。另外PUPs还具有一定的护肝作用[18]。PUPs是否具有改善DENA诱导HCC作用,国内外还鲜见报道。本研究通过复制DENA诱发大鼠HCC动物模型,确立PUPs对DENA诱导HCC的改善作用,为PUPs在化学预防DENA诱导HCC中的应用提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 试验动物 45只雄性SD大鼠购于安徽医科大学动物实验中心,适应性饲养1周后体质量为180~200 g,给予标准饮食和自由饮用自来水。试验动物经安徽医科大学伦理委员会批准(批准号:15130)。
1.1.2 试验药品 DENA购自西格玛(上海)贸易有限公司;PUPs(90%,高效液相色谱测定)购自河南龙腾生物工程有限公司;其他化学药品均为分析纯,购于国药集团药业股份有限公司。
1.2 试验方法
1.2.1 试验设计和给药方法 将试验大鼠随机分为3组,对照组(n=15,腹腔注射生理盐水);DENA组(n=15,腹腔注射200 mg/kg·BW);DENA+PVPs组(n=15,腹腔注射200 mg/kg·BW DENA后,PUPs灌胃给药300 (mg/kg·BW)/d至第8周),在最后一次给药后24 h处死所有大鼠。采集大鼠的血液、肝脏进行生化指标、病理、炎症细胞因子水平及与免疫抑制有关蛋白表达水平分析。
1.2.2 血清收集和组织标本处理 大鼠称量体质量后,用3%苯巴比妥钠按照腹腔注射50 mg/kg·BW麻醉大鼠30 min后,从大鼠眼眶静脉丛取血,取血后在37 ℃下温浴1 h后,4 ℃ 3 000 r/min离心10 min取上清,收集血清液置于4 ℃冰箱,备用。大鼠脱臼处死后,称取肝脏质量,计算肝脏质量与体质量比。肝组织分别进行4%多聚甲醛固定,石蜡包埋。组织加生理盐水1∶5(g∶mL)冰浴10 min后,匀浆,匀浆液在4 ℃条件下5 000 r/min离心10 min,收集上清液,置于4 ℃冰箱,备用。
1.2.3 血清和肝组织生化指标检测 按照试剂盒(上海抚生实业有限公司)操作方法检测大鼠血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)活性。用ELISA试剂盒(上海梵态生物科技有限公司)按照操作说明书检测肝组织上清液甲胎蛋白(AFP)浓度。
1.2.4 肝脏组织HE染色和免疫组化分析 将石蜡包埋的肝脏组织切成4 μm厚的肝组织切片,进行苏木精和曙红(HE)染色,在显微镜下观察肝脏病理变化。另取肝组织切片脱蜡后,用3%过氧化氢室温条件下孵育5~10 min,消除内源性过氧化物酶的活性。然后进行抗原修复,再用5% PBS稀释的胎牛血清封闭,室温条件下孵育10 min,滴加1∶100倍比稀释的CYP2E1多克隆抗体(Nordic BioSite公司),37 ℃下温浴1~2 h或4 ℃冰箱中过夜, 滴加适量辣根过氧化酶标记的二抗工作液,37 ℃下孵育30 min,滴加DAB和底物混合物孵育3~15 min,用苏木精复染,用无水乙醇脱水和二甲苯透明后封片,在光学显微镜下观察。
1.2.5 肝组织炎症细胞因子和NO水平检测 取肝组织上清液,用ELISA试剂盒(武汉赛培生物科技有限公司)按照试剂盒操作说明书操作步骤检测白细胞介素-1β(IL-1β)和肿瘤坏死因子-alpha(TNF-α)浓度。按照一氧化氮检测试剂盒(碧云天生物技术有限公司)说明书的操作步骤检测肝组织NO浓度(Griess法)。
1.2.6 统计分析 本研究数据以“平均值±标准误差”表示,不同组间两两比较采用单因素方差分析(ANOVA),两两比较检验后,进行Post Hoc检验,P<0.05表示差异显著。
2 结果与分析
2.1 PUPs对DENA诱导肝细胞癌早期肝质量g/100 g体质量及肝脏病理影响
从图1可以看出,DENA导致肝质量与体质量比,明显增大,证明DENA使肝脏发生炎症后肿大。但PUPs具有改善DENA导致的肝细胞肿大作用。从图2可以看出,对照组肝脏组织肝索、肝血窦、中央静脉明显可见。DENA组肝脏组织中肝索不是非常明显可见,中央静脉充血,肝血窦间出现浅红色淀粉样染色,小叶间血管出现大量巨噬细胞和其他炎性细胞,呈现明显肝硬化症状。肝细胞水肿导致胞浆疏松化,细胞核周围呈现透明化。PUPs组肝组织中肝索、中央静脉充血明显改善,肝血窦间没有淀粉样染色,肝细胞核周围透明化染色明显改善,证明细胞水肿明显减轻。这也说明图1中DENA出现干质量与体质量比明显变大的原因。
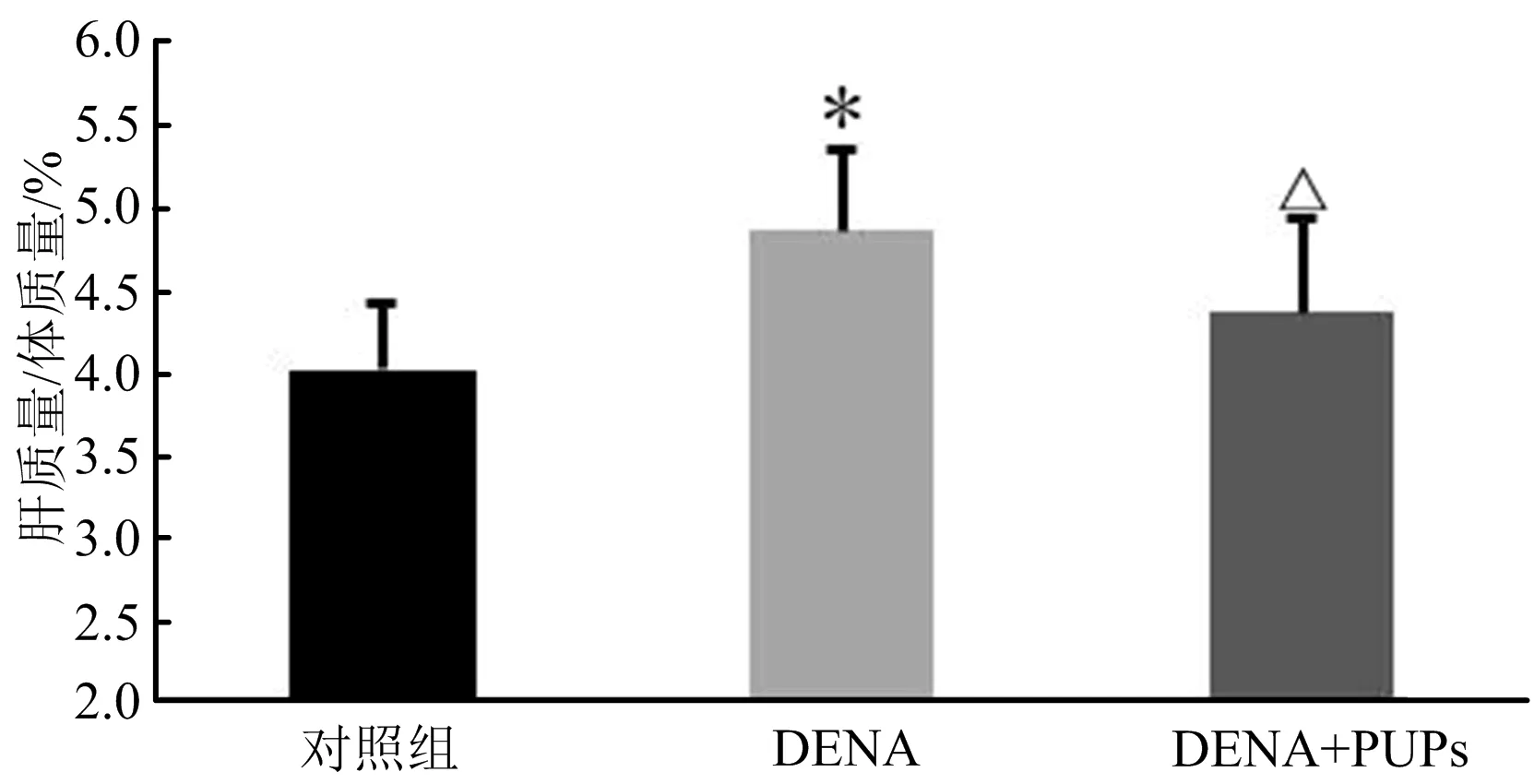
图1 PUPs对DENA诱导肝细胞癌早期肝质量/体质量的影响Fig.1 Effect of PUPs on liver weight/body weight of DENA induced early hepatic cellular cancer注:*表示DENA组与对照组相比P<0.05;△表示DENA+PUPs组与DENA组相比P<0.05。下同。
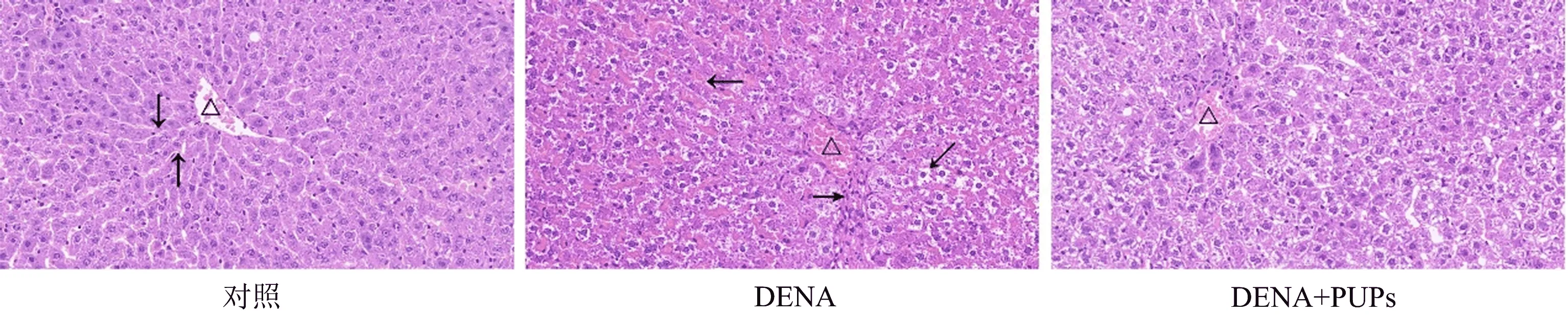
图2 PUPs对DENA诱导肝细胞癌早期肝组织细胞病理的影响(HE染色400×)Fig.2 Effect of PUPs on DENA-induced hepatocellular carcinoma in early stage (HE stain 400×)注:对照组HE染色肝组织的肝索(↓)肝血窦(↑)中央静脉(△)明显可见,DENA组肝血窦出现淀粉样染色(←),说明肝组织硬化,肝小叶间血管有大量巨噬细胞和其他炎性细胞(→),肝细胞外出现透明染色(),说明肝细胞水肿。
2.2 PUPs对DENA诱导肝细胞癌早期肝功能酶和肝细胞癌标志物的影响
从表1可以看出,大鼠腹腔注射DENA(200 mg/kg·BW)8周后肝功能严重损伤,血清AST和ALT水平与对照组大鼠相比显著升高,在腹腔注射DENA(200 mg/kg·BW)后,给予PUPs (300 mg/kg·BW)/d灌胃8周后,大鼠血清AST和ALT活性与正常组大鼠相比仍然比较高,但显著低于DENA组大鼠。DENA组肝细胞癌标志物甲胎蛋白水平显著高于对照组大鼠,灌胃猪苓多糖大鼠肝组织中甲胎蛋白水平与对照组相比明显偏高,但较DENA组明显降低。说明猪苓多糖对DENA诱导的肝功能损伤具有改善作用,对一定DENA诱发的肝细胞癌具有化学保护作用。
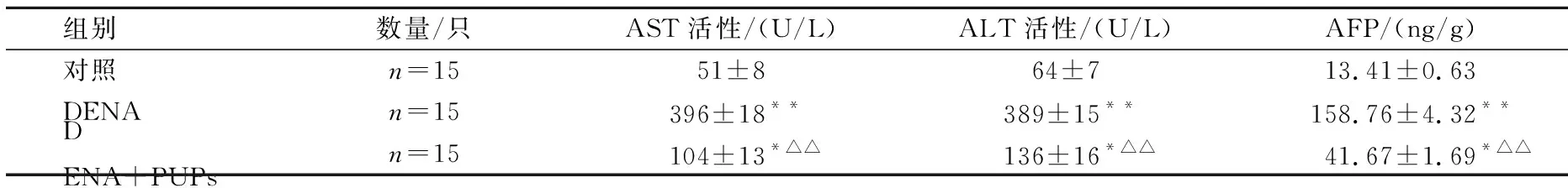
表1 PUPs对给予DENA大鼠血清AST、ALT活性和AFP水平的影响
2.3 PUPs对DENA诱导肝细胞癌早期炎症细胞因子和效应分子NO水平的影响
从表2可以看出,大鼠腹腔注射DENA(200 mg/kg BW)8周后,肝组织炎症细胞因子IL-1β、TNF-α水平和NO水平比正常组明显升高,PUPs具有下调DENA诱导肝组织炎症细胞因子升高作用。

表2 PUPs对给予DENA大鼠肝组织炎症细胞因子IL-1β、TNF-α和效应分子NO水平的影响
2.4 PUPs对激活DENA酶CYP2E1在肝细胞癌早期组织表达水平和肝细胞DNA损伤影响
免疫组化结果显示对照组肝组织中只有少量阳性深棕色染色(图3),表明CYP2E1表达水平低;在腹腔注射DENA后,肝组织有大量的棕色,表明CYP2E1的表达水平明显升高;PUPs可下调DENA活化的酶CYP2E1在肝组织中的表达水平,与DENA组比较,肝组织棕色明显减少,但比对照组CYP2E1表达水平高,说明PUPs具有下调肝组织CYP2E1表达水平作用。CYP2E1水平的升高会激活DENA,产生氧化应激和细胞损伤,与肝细胞DNA发生加成作用,导致细胞核内DNA发生断裂。DNA断裂是诱发肝细胞癌的关键步骤。
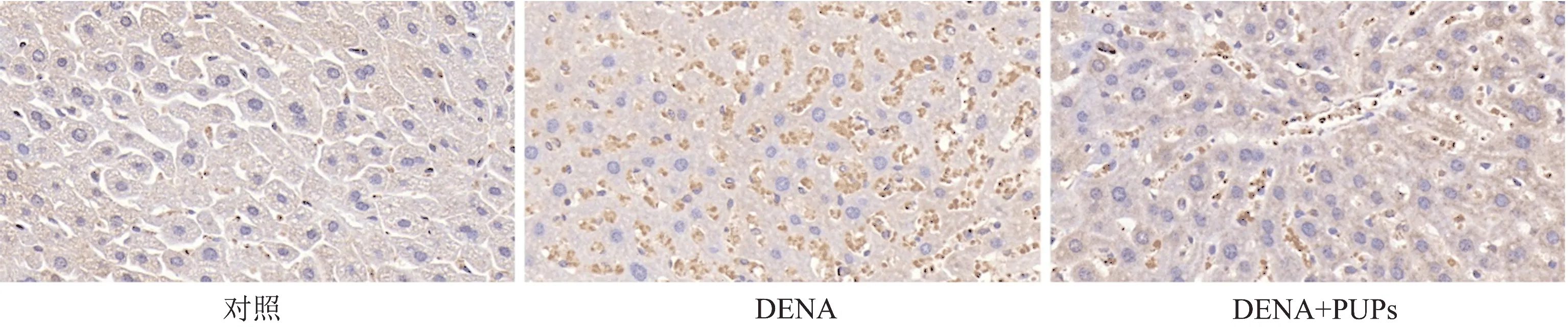
图3 PUPs对激活DENA酶CYP2E1在肝组织表达水平影响(免疫组化400×)Fig.3 Effects of PUPs on the expression level of activated DENA enzyme CYP2E1 in liver tissues (IHC 400×)
3 结论与讨论
饮食中的致癌物亚硝胺在肝脏中通过氧化应激导致慢性肝细胞炎症触发肝细胞损伤,进一步导致肝功能衰竭、肝硬化、肝细胞增生,最终导致肝细胞癌的发生。抑制亚硝胺对肝脏的损伤作用,对肝细胞癌的发生和发展具有化学预防作用[19]。前期研究发现多糖具有增强大鼠肝组织抗氧化功能[20],减轻肝脏炎症反应。研究发现肝损伤与IL-1β细胞毒有关,IL-1β的肝毒性是由于坏死而不是细胞凋亡,TNF可通过TNF受体1(TNFR1)死亡途径诱导肝细胞凋亡[21]。TNF-α和IL-1β联合作用能产生协同效应造成对肝细胞的损伤[22-23]。本研究发现DENA能升高肝组织TNF-α 和IL-1β水平(表2),诱导肝脏组织出现大量促进炎性的巨噬细胞(图2)。PUPs具有降低由DENA诱导的TNF-α 和IL-1β高水平表达(表2),进而改善由DENA造成的肝损伤(表1)和炎症造成肝组织肿胀引起肝质量和体质量比增大(图1、2),改善肝组织由炎性细胞造成的病理变化(图2),降低肝细胞癌标志物AFP在肝组织的表达水平(表1),对肝细胞癌的发生发展具有化学预防作用。肝细胞色素P450酶,尤其是肝组织中CYP2E1在DENA生物激活中起关键作用,DENA的活化导致DNA片段与致癌化学物质结合形成复合物的加成作用。DENA经肝脏代谢活化成亲电活性产物与DNA结合,DNA复制无法正常进行,导致DNA损伤,损伤的DNA不能有效地修复,进一步导致癌症的发生[9]。另外,研究发现NO与DNA损伤具有相关性,NO对癌症的产生具有双重作用[24],本研究发现PUPs具有降低DENA诱导肝细胞NO的表达水平(表2),改善DENA诱导肝细胞发生纤维化和硬化作用(图2)。总之,本研究发现PUPs可以明显改善DENA诱导肝细胞炎症,进而化学预防HCC的发生和发展。

