便秘对帕金森病冻结步态的影响
周涌涛
首都医科大学宣武医院,北京 100053
帕金森病(Parkinson’s disease,PD)是老年人群中常见的神经系统变性疾病,65 岁以上人群中的发病率为1.67%[1],PD患者中后期会出现运动并发症导致生活能力下降,给患者本人和社会造成巨大的负担[2]。冻结步态(freezing of gait,FOG)是PD 患者常见的运动并发症之一,临床表现为行走启动或转身时双脚如同冻结在地上,不能抬起或前行,或行走时突然表现犹豫不决、不敢行走,PD-FOG 是引起病人跌倒、导致骨折的主要原因之一[3]。FOG机制尚不清楚,目前多数研究认为FOG 与黑质多巴胺神经元变性加重有关。我们利用18F-AV133 PET-CT和18F-FDG PET-CT 研究PD-FOG 患者,发现黑质纹状体系统和大脑皮质各个区域葡萄糖代谢的变化与PD-FOG的发生有关[4],其他研究还认为视觉中枢、脚桥核和认知相关的皮层参与FOG 的发生[5-6]。PD-FOG多采取左旋多巴替代治疗和康复锻炼,由于其危险因素尚不清楚,因而缺乏早期预防的手段。
PD-FOG 的危险因素主要包括较长病程、姿势不稳/步态障碍(postural instability/gait disorder,PIGD)型和黑质多巴胺转运体的减少[7],目前尚无阻断和延缓PD 进展的治疗方法,因此这些危险因素并不能进行干预。便秘是PD 常见的非运动症状,美国运动障碍病协会在2015 年和2019 年均将其作为PD 前驱期研究性诊断标准之一和危险因素[8-9],Braak 等[10]认为PD 发病可能源于肠道病变,之前研究也发现便秘与PD 患者黑质多巴胺转运体的减少显著相关,且与PD 运动并发症显著相关[11]。近期研究发现便秘是PD-FOG 的危险因素,本研究搜集宣武医院住院PD 患者的临床资料,分析便秘与FOG 之间的关系,通过分析便秘和FOG与炎症蛋白、ADL、UPDRS-Ⅲ、MMSE、HAMA 及HAMD 之间的关系,确定便秘影响FOG 的可能机制。由于便秘可通过药物和非药物治疗得以缓解,因此也为PD-FOG 的早期干预和治疗提供新的思路。
1 对象与方法
1.1 研究对象收集2015-05-26—2022-01-08 在首都医科大学宣武医院神经内科住院且诊断为PD 的1 135 例患者,其中272 例FOG 患者,男151例,女121 例,发病年龄(62.97±0.64)岁;863 例非FOG 患者,男489 例,女374 例,发病年龄(60.09±0.40)岁。纳入标准:(1)符合中国运动障碍病协会制定的原发性PD 诊断标准[12];(2)急性多巴胺负荷试验有效率>30%或长期应用左旋多巴替代治疗有效。排除标准:(1)其他原因所致的帕金森综合征、多系统萎缩、进行性核上性麻痹等患者;(2)存在认知障碍或其他疾病不能完成UPDRS、ADL 量表者;(3)严重全身疾病和DBS 手术者。所有参与者均签署知情同意书。
1.2 研究方法所有患者由专科医师进行详细的资料采集、神经系统检查及量表评估。对患者日常生活能力、运动功能、认知功能、抑郁和焦虑进行如下评估:(1)基本临床资料:性别、年龄、发病年龄、起病形式和既往史等;(2)采用ADL 量表对PD 患者日常生活能力进行评估;(3)采用Hoehn-Yahr 分级评估PD 患者病情严重程度,UPDRS-Ⅲ评估PD 患者运动功能;(4)对PD患者认知功能采用MMSE进行评估;(5)对PD 患者抑郁、焦虑状况采用HAMA 和HAMD量表进行评估。
1.3 冻结步态和便秘的判定及外周血补体和免疫球蛋白测定冻结步态判定:(1)出院诊断中有“冻结步态”诊断;(2)临床病史中有起步、转身,经过窄的门口、道路或行走过程中出现犹豫不能前行、脚步如同冻结在地面上一样的表现;(3)临床检查中有冻结步态的描述;(4)UPDRS 评估第14 项“行走时冻结”的得分≥1分,同时参考第29项“步态”的得分≥1分[13]。便秘的诊断标准参照ROME-Ⅳ的标准诊断功能性便秘,并排除占位性病变或其他器质性病变引起的便秘。利用ELISA法测定外周血中免疫球蛋白和补体的水平[14]。
1.4 统计学处理采用SPSS 20.0 对数据进行统计学分析。计数资料采用卡方分析,调整性别、年龄等因素,采用非条件Logistic回归模型进行分析。计量资料分析利用方差分析,年龄和性别调整采用协方差分析。补体C3与ADL、UPDRS-Ⅲ之间的相关性采用相关和协相关分析。P<0.05 为差异有统计学意义。
2 结果
2.1 2组人口统计学及临床资料分析共收集1 135例临床诊断为PD的住院病人,其中272例FOG患者和863 例非FOG 患者,宣武医院帕金森病房住院PD患者中FOG发生率为23.96%。发病年龄>49岁发生FOG的风险较≤49岁的PD患者高2.20倍(OR=2.20,95% CI:1.39~3.50,P<0.05),FOG 患者的病程较非FOG 患者显著更长[FOG 与非FOG:(5.90±0.32)a 比(3.63±0.13)a,P<0.05],PD-FOG 患者ADL 评分低于非PD-FOG 患者[PD-FOG 与非PD-FOG:(73.01±0.99)分比(82.00±0.47)分,P<0.05]。PD-FOG 患者的UPDRS-Ⅲ评分显著高于非PD-FOG患者[PD-FOG与非PD-FOG:(39.20±1.39)分比(30.48±0.68)分,P<0.05]。根据Hoehn-Yahr分级,住院患者中FOG的发生率随着病情加重而增加(Hoehn-Yahr 分级Ⅰ、Ⅱ、Ⅲ、Ⅳ与Ⅴ分别为5.49%、16.36%、43.03%、68.97%、63.16%)。此外,MMSE、HAMA 和HAMA 在PD-FOG和非PD-FOG之间差异也存在统计学意义(P<0.05)。见表1。
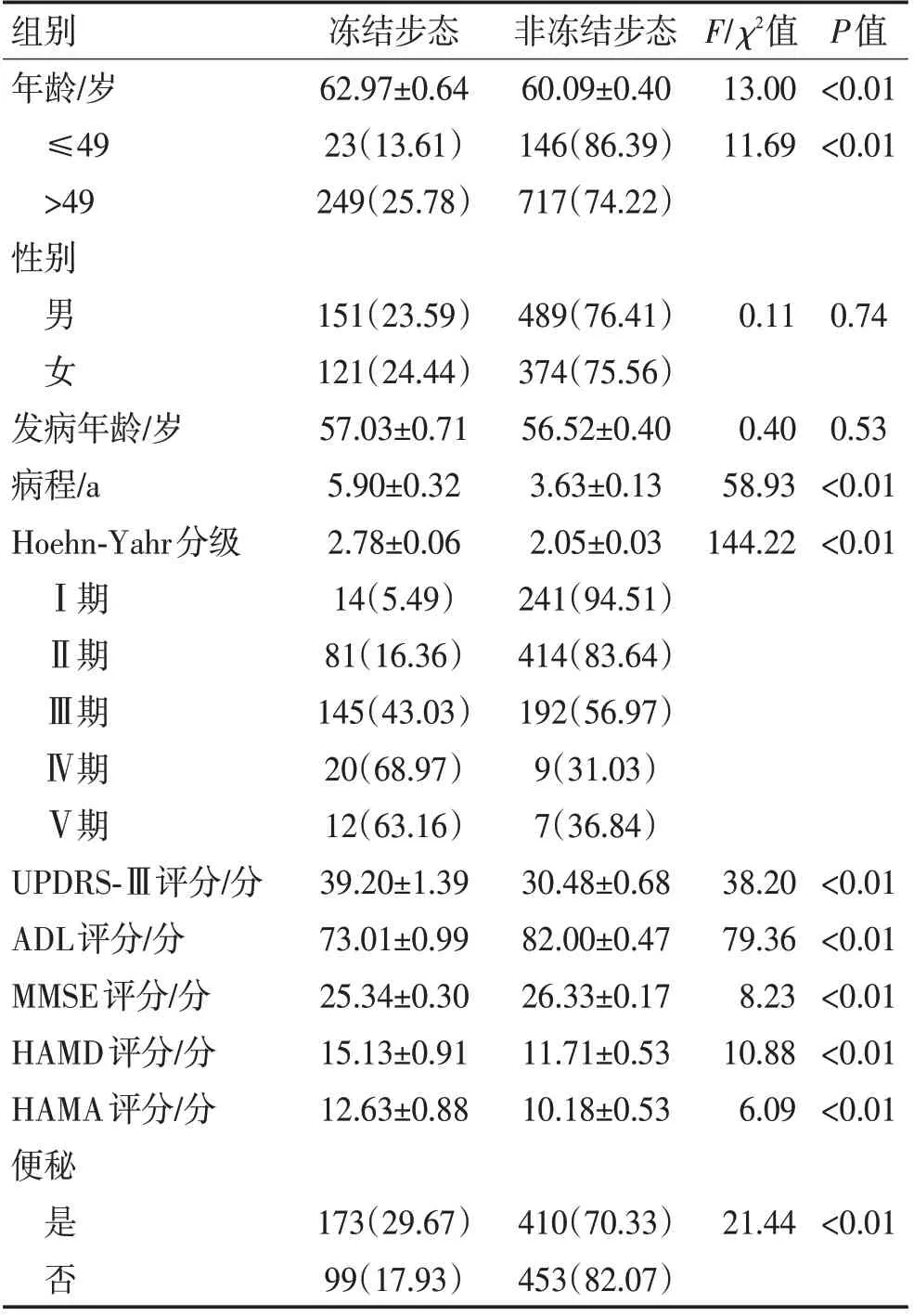
表1 受试者基本临床资料 [n(%)]Table 1 The basic clinical material of the subjects [n(%)]
2.2 便秘增加PD 患者发生FOG 的风险便秘在住院PD 患者中的发生率为51.36% 。 依据UPDRS-Ⅲ和ADL 评分标准,相较于不伴便秘的PD 患者,伴便秘PD 患者运动功能的损害更为严重[FOG 与非FOG:(35.55±0.91)分比(29.49±0.85)分,P<0.05],生活能力下降更为显著[FOG与非FOG:(77.29±0.65)分比(82.50±0.58)分,P<0.05]。住院PD 伴便秘患者较不伴便秘患者FOG 发生率显著升高(PD 伴便秘与PD 不伴便秘:63.60%比36.40%,P<0.05),便秘能够显著增加FOG 发生的风险(OR=1.93,95% CI:1.46~2.56,P<0.05)。利用Logistic 回归模型调整性别和年龄的影响后,便秘仍是FOG 发生的危险因素,可增加1.77 倍的风险(OR=1.77,95% CI:1.33~2.36,P<0.05)。见表2。
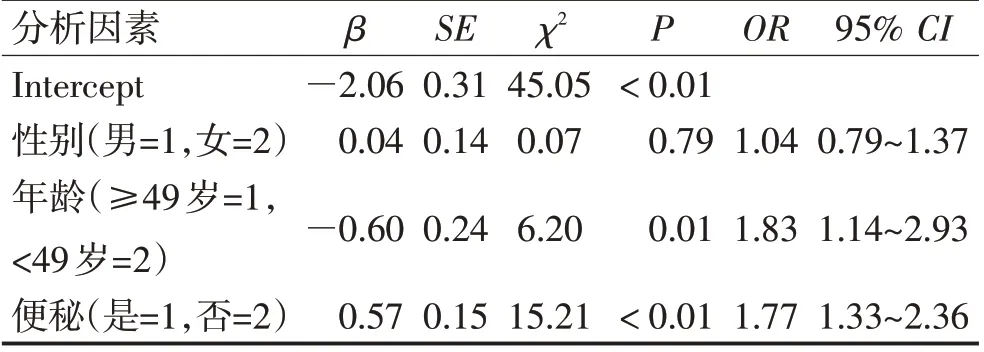
表2 利用非条件Logistic回归模型调整性别和年龄后便秘对FOG的影响Table 2 The influence of constipation on FOG of PD after adjusting age and sex by Logistic regression
2.3 便秘相关的免疫机制与PD-FOG 的发生检测住院患者外周血细胞因子和免疫球蛋白,发现伴便秘和(或)FOG 的PD 患者外周血的C3 水平显著升高(P<0.05),而C4、IgA、IgG、IgM 和CRP浓度在2 组之间无显著线性差异。进一步分析发现,伴便秘和FOG 的PD 患者与其他3 组患者相比,外周血C 浓度、UPDRS-Ⅲ评分、HAMA 及HAMD 评分均显著升高,ADL 和MMSE 评分均下降(P<0.05)。见表3。
表3 补体和免疫球蛋白在便秘组和FOG组中的水平比较 (±s)Table 3 Comparison of the levels of serum complements and immunoglobulins between two groups (±s)
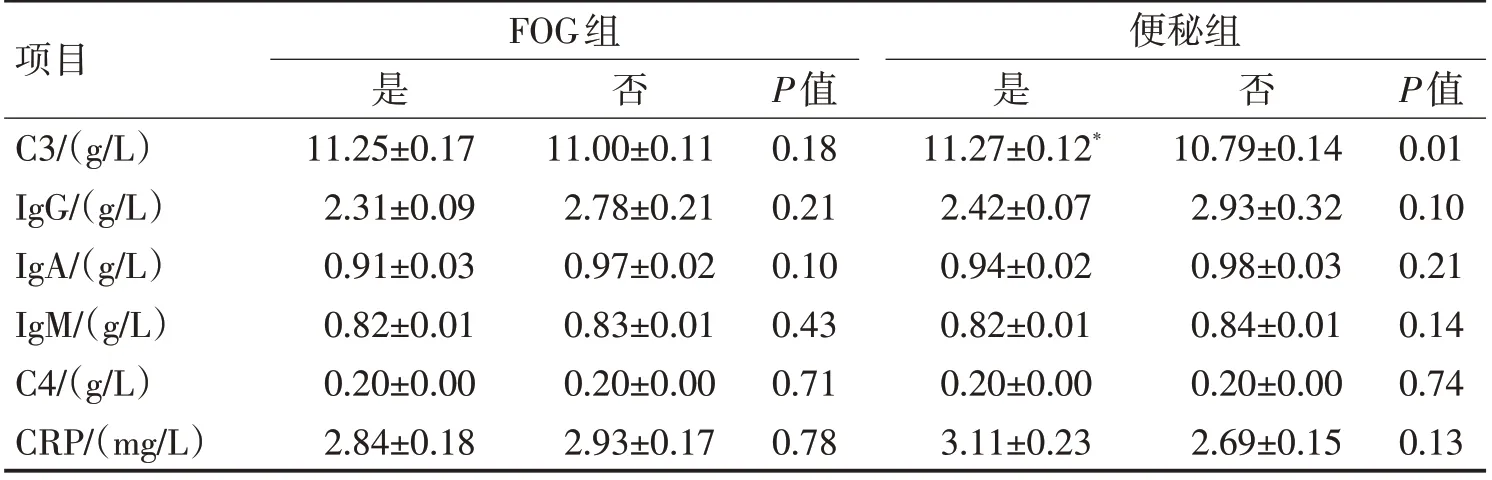
表3 补体和免疫球蛋白在便秘组和FOG组中的水平比较 (±s)Table 3 Comparison of the levels of serum complements and immunoglobulins between two groups (±s)
项目C3/(g/L)IgG/(g/L)IgA/(g/L)IgM/(g/L)C4/(g/L)CRP/(mg/L)FOG组是11.25±0.17 2.31±0.09 0.91±0.03 0.82±0.01 0.20±0.00 2.84±0.18否否11.00±0.11 2.78±0.21 0.97±0.02 0.83±0.01 0.20±0.00 2.93±0.17 P值0.18 0.21 0.10 0.43 0.71 0.78便秘组是11.27±0.12*2.42±0.07 0.94±0.02 0.82±0.01 0.20±0.00 3.11±0.23 10.79±0.14 2.93±0.32 0.98±0.03 0.84±0.01 0.20±0.00 2.69±0.15 P值0.01 0.10 0.21 0.14 0.74 0.13
2.4 补体C3与ADL、UPDRS-Ⅲ、MMSE、HAMA及HAMD 评分的相关性利用相关和偏相关分析发现,住院PD 患者外周血补体C3 与ADL、MMSE 评分存在较弱的负相关(与ADL 和MMSE 评分相关系数r 分别为—0.07、—0.08,P<0.05),与UPDRS-Ⅲ和HAMD 评分存在显著正相关(与UPDRS-Ⅲ和HAMD 评分相关系数r 分别为0.15、0.22,P<0.05),补体C3 与HAMA 评分无显著相关性(P>0.05)。见表4。
表4 便秘对PD-FOG患者C3、ADL、UPDRS-Ⅲ、MMSE、HAMA及HAMD评分的影响 (±s)Table 4 Influence of constipation on C3,ADL,UPDRS-Ⅲ,MMSE,HAMA and HAMD scores in PD-FOG (±s)
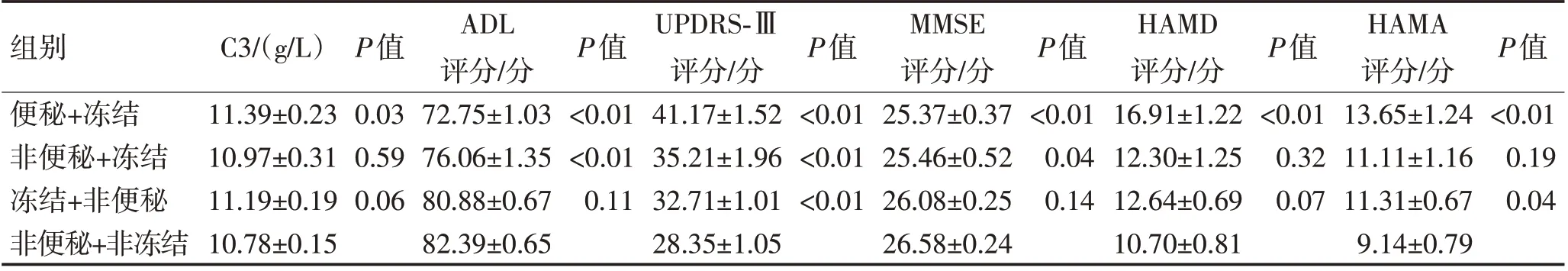
表4 便秘对PD-FOG患者C3、ADL、UPDRS-Ⅲ、MMSE、HAMA及HAMD评分的影响 (±s)Table 4 Influence of constipation on C3,ADL,UPDRS-Ⅲ,MMSE,HAMA and HAMD scores in PD-FOG (±s)
组别便秘+冻结非便秘+冻结冻结+非便秘非便秘+非冻结C3/(g/L)11.39±0.23 10.97±0.31 11.19±0.19 10.78±0.15 P值0.03 0.59 0.06 ADL评分/分72.75±1.03 76.06±1.35 80.88±0.67 82.39±0.65 P值<0.01<0.01 0.11 UPDRS-Ⅲ评分/分41.17±1.52 35.21±1.96 32.71±1.01 28.35±1.05 P值<0.01<0.01<0.01 MMSE评分/分25.37±0.37 25.46±0.52 26.08±0.25 26.58±0.24 P值<0.01 0.04 0.14 HAMD评分/分16.91±1.22 12.30±1.25 12.64±0.69 10.70±0.81 P值<0.01 0.32 0.07 HAMA评分/分13.65±1.24 11.11±1.16 11.31±0.67 9.14±0.79 P值<0.01 0.19 0.04
3 讨论
冻结步态是PD 常见的运动并发症,严重影响患者的生活能力,可引起跌倒并导致残疾。研究认为,导致PD-FOG 的危险因素主要有PIGD型、多巴胺转运体的减少和较长的病程,但这些危险因素是不可干预的,有研究认为便秘与黑质多巴胺转运体的减少显著相关,是PD-FOG 的危险因素,但存在较大的争议。由于便秘是可干预因素,因而明确与PD-FOG 的关系并进行临床管理,对于PD-FOG 的早期预防并进行干预具有重要的临床意义。
本研究发现住院PD 患者中冻结步态的发生率为23.96%,高于之前报道,可能与研究样本量较小有关(1 135 例与167 例)[13]。国内外报道的PD-FOG 的发生率为7%~63%,存在较大差异的原因与研究选择群体及样本量、地域和种族差异有关[15-18]。本研究发现,PD-FOG 组较非PD-FOG 组病程更长、UPDRS-Ⅲ评分升高及ADL 评分下降,表明PD-FOG 患者具有更为严重的运动功能障碍和日常生活水平降低,这与国内外其他研究发现较长病程是PD-FOG 的独立危险因素和导致生活能力下降的结论一致。本研究还发现PD-FOG 患者较非PD-FOG 患者的HAMA 评分显著升高,提示PD-FOG 患者焦虑更加严重;PD-FOG 患者较非PD-FOG 患者的MMSE 评分显著降低,提示其认知损害更为严重。研究发现PD-FOG 患者较非PD-FOG 患者视觉中枢和边缘皮层区域的损害更为严重,与PD-FOG 认知功能下降有关[19]。
便秘是PD 常见非运动症状,是前驱期PD 发生的危险因素,与病情的进展密切相关[20-22]。本研究发现便秘可增加1.93 倍PD-FOG 发生的风险,调整性别和年龄的影响后,便秘仍可显著增加FOG 的风险至1.77 倍,表明便秘是PD-FOG 独立的危险因素。伴便秘的PD-FOG 患者UPDRS-Ⅲ、HAMA 和HAMD 评分显著升高,ADL 和MMSE评分显著降低,表明便秘加重了PD-FOG 患者的运动功能和认知功能损害,出现更为严重的抑郁、焦虑,导致其日常生活能力的下降。前期利用示踪剂18F-AV133 和18F-FDG PET-CT 研究伴便秘PD 患者的黑质纹状体系统多巴胺变化和各个皮层区域葡萄糖代谢变化,与不伴便秘PD 患者相比,伴便秘PD 患者的黑质纹状体多巴胺水平显著降低[12],包括颞叶内侧面在内的多个皮层区域代谢降低,提示与伴便秘PD-FOG 患者的运动功能下降、认知功能损害以及焦虑程度加重有关。
进一步分析便秘对外周免疫的影响,发现伴便秘PD 患者外周血中补体C3 水平显著升高,而其他免疫蛋白,如C4、CRP、IgG、IgA 和IgM 在2组间无统计学差异。Parker 等[23]研究发现,通过移植年轻大鼠粪便中的有益菌群到老年大鼠肠道中,补体C3 介导的慢性炎症可使老年大鼠肠道、眼睛及大脑中老化相关的标记物发生逆转,结合之前研究表明,在PD 患者中便秘可引起外周血补体C3 介导的慢性炎症。本研究发现,在PD 患者中,补体C3 浓度与UPDRS-Ⅲ、HAMD 评分存在显著正相关,表明便秘引起的C3 水平异常参与了运动功能和认知功能的损害,其机制可能为便秘导致肠道菌群异常,有益菌群减少和有害菌群增加,导致致病毒素如LPS 增加和代谢产物如短链脂肪酸减少,引起外周和中枢的慢性炎症,导致小胶质细胞激活引起黑质多巴胺神经元的减少。还有一种可能是,肠道神经丛内的α-synuclein 的病理性聚集,沿着迷走神经逆行至延髓的迷走神经背核,从而启动了PD 的病理进展[24-26]。
尽管本研究的群体为住院病人,存在样本选择的局限性,但样本量大且病人群体分布于全国各地,能够一定程度上减少样本选择的偏倚。本研究发现PD-FOG 与运动功能和认知功能的损害显著相关,且降低患者的日常生活能力,因而如何发现PD-FOG 的可控性危险因素并进行治疗,对PD 患者的预后具有重大影响。 便秘是PD-FOG 的危险因素,可增加1.77 倍发生PD-FOG的风险。便秘可加重PD-FOG 的运动和认知功能损害,降低生活质量,与更为严重的焦虑显著相关。便秘可引起PD 患者C3 水平显著增高,表明C3 参与PD-FOG 的发生。我们推测伴便秘的PD患者可能更容易发生肠道菌群紊乱、致病因子增加和有益代谢产物减少,导致肠道通透性增加,致病因子进入血液循环引起外周和中枢的免疫反应,加重PD 病情进展,导致PD-FOG 的发生。PD 患者合理饮食、认知训练[27-28]、避免便秘等非运动症状的发生,可能会阻断或延缓PD 进展,减少PD-FOG 的发生。

