外源‘氨基酸-多肽’对盐胁迫下小麦种子萌发和幼苗生长的影响
刘蓉,吴望,谢俊峰,李川,胡云棵,吴瑜
(1.宜宾学院 农林与食品工程学部,四川宜宾 644000;2.中国科学院 成都生物研究所,四川成都 610041)
土地盐渍化是对植物生长发育产生不利影响的非生物胁迫之一,全世界可耕地土壤的盐渍化分布范围广[1],且在不断扩大.土壤的盐度过高会减弱植物的渗透调节能力;过量的Na+和Cl-进入植物细胞,会破坏细胞内稳态,造成离子的毒害作用;高盐环境下植物的光合色素含量也会急剧下降,减弱光合作用效率和强度;并通过以上的各种不良反应,在植物体内产生并积累大量的活性氧(ROS),使植物细胞内氧化还原失衡,从而损伤细胞[2].盐害造成植物的生理、生化反应失调以及代谢紊乱,严重抑制植物的生长,并最终影响作物的产量和品质[3].
小麦(TriticumaestivumL.)是世界上的三大粮食作物之一,对土壤中的盐分较为敏感[4].在盐度较高的土壤中小麦生长缓慢、发育延迟,品质和产量受到严重影响[5].因此,提高小麦的抗盐能力,使其在含高盐分的土壤中也能正常生长而不至于大量减产,这对解决世界粮食危机和维持粮食需求的可持续发展具有极其重要的意义.现在人们用来提高小麦抗盐性的方法主要有三种,即传统的育种方法(通过杂交选种的方式)、转基因技术和添加(施用)外源物质的方法.传统的育种技术虽然可靠但育种周期长,要选育出一个抗盐新品种至少要花费十年甚至更长时间,转基因技术虽然周期短,但是操作复杂且目前还存在许多的争议,而近年越来越多关于施用外源物质增强植物的抗逆性的研究有了突破性的进展,这与传统育种和转基因育种相比是最有效也是最经济的方法.
到目前为止,研究证实的能增强作物抗盐或抗逆能力、缓解盐害或逆境不利反应的外源物质主要有:甜菜碱[6]、水杨酸[7-8]、茉莉酸[9]、维生素(抗坏血酸、VB6等)[10-11]、植物、动物激素、低温[12-14]、糖类[15-17]、根际促生菌[5,18-19]、植物组织(叶片)提取液[20]、氨基酸-多肽[21-22]以及信号分子类(H2S、NO、CO)[23-25]等.这些外源物均在不同程度上促进了小麦或其他作物的生长,增强了作物耐盐或抵御其他不利生长环境的能力.其中氨基酸、多肽是动植物体内蛋白质的重要组成成分,并参与体内各种生理生化反应.植物中许多生理代谢均受氨基酸及多肽的影响和调节,二者可作为调控因子或信号分子调节或影响一些酶的合成和活性,进而调控某些基因的表达和细胞内氧化还原稳态[26],如脯胺酸(Pro)、精氨酸(Arg)、甲硫氨酸(Met)和谷氨酸(Glu),会直接或间接参与调节植物对各种生物或非生物胁迫的响应[27].前人研究发现,施加外源氨基酸能提高植物的抗逆能力,提高大麦的耐盐性[28]、增强玉米幼苗对重金属胁迫的适应性[22],以及提高植物的抗旱性[26].外源氨基酸能减缓高盐环境下植物细胞中K+的大量流失[28],喷施外源脯胺酸和苯丙氨酸能改善盐胁迫下玉米和蚕豆对土壤中K+、Na+和Ca2+的选择性吸收,促进植物对K+的吸收,限制Na+的吸收,维持最佳的K+/Na+比[29];同样脯胺酸在调节植物抵抗重金属胁迫中也起到了重要的作用[30],还可以作为植物体内的渗透调节物质和自由基的清除剂[31].除了脯胺酸以外,外源天冬氨酸、丝氨酸和丙氨酸也均能增强玉米幼苗的盐胁迫适应能力[32].Li[33]等发现外施γ-氨基丁酸能增强小麦幼苗的光合作用能力和抗氧化酶活性,减少叶片丙二醛含量和叶片电导率,从而减轻NaCl 对细胞的伤害,提高小麦幼苗的耐盐能力.虽有大量关于氨基酸能增强作物抗逆性的报道,但到目前为止,关于‘氨基酸-多肽’对盐胁迫下小麦生长发育和耐盐机理的研究却很少.因此本实验主要针对外源‘氨基酸-多肽’对提高小麦耐盐性及耐盐机理进行探究,以期为深入研究小麦的耐盐遗传机制打下基础.
1 材料和处理
1.1 实验材料和试剂
实验所用的小麦材料为盐敏感品种川育27,由中国科学院成都生物研究所提供.实验用的‘氨基酸-多肽’(简称多肽)水溶肥料由成都中科益农生物有限公司生产(有效成分为氨基酸和α 活性肽).小麦种子消毒用0.1% HgCl210 min,再用70%乙醇消毒5 min,最后用纯水反复冲洗5 次以上,小麦种子表面水分用滤纸吸干后用于发芽率测定实验和幼苗生长实验.
1.2 发芽率测定实验
将消毒后的种子分别用去离子水或多肽水溶液预处理5 h,然后按G1(对照)、G2(只添加多肽)、G3(100 mM NaCl)、G4(100 mM NaCl+多肽)、G5(200 mM NaCl)、G6(200 mM NaCl+多肽)分组分别将处理后的小麦种子放入培养皿中(30粒/皿),每天更换滤纸,每个处理重复三次,于23~25 ℃培养.
1.3 幼苗生长实验
将消毒后的种子用纯水浸泡5 h,后再把种子放入养皿中,25 ℃(黑暗)发芽24 h. 挑选发芽一致的种子转移至带孔塑料板,用改良的Hoagland’s 营养液培养(每2 天更换营养液),然后按G1-G6 分组,在营养液中逐渐添加50 mM NaCl 直至NaCl 处理浓度达到100 和200 mM 为止(每处理重复三次). 5天后在G2、G4 和G6 组的培养液中添加多肽,再培养10天后测定小麦幼苗各个生理生化指标. 所有的处理均在光照培养箱中培养(光照周期16 h/8 h,25 ℃/18 ℃,强度600 μmol·m-2·s-1,相对湿度65%.
1.4 ‘氨基酸-多肽’浓度的选择
在盐胁迫和非盐胁迫条件下,分别用1/200(0.5%)、1/400 (0.25%)、1/600 (0.17%) 和 1/800(0.125%)浓度梯度多肽处理小麦幼苗(第一叶完全长出),10 天后分别测定各处理浓度下小麦幼苗主根长、苗高和干/鲜重 等生物量指标.根据生物量指标的大小筛选出最佳的处理浓度,即1/600 (0.17%)浓度的多肽水溶液(表1),且后续实验均用1/600(0.17%)浓度的多肽溶液处理.
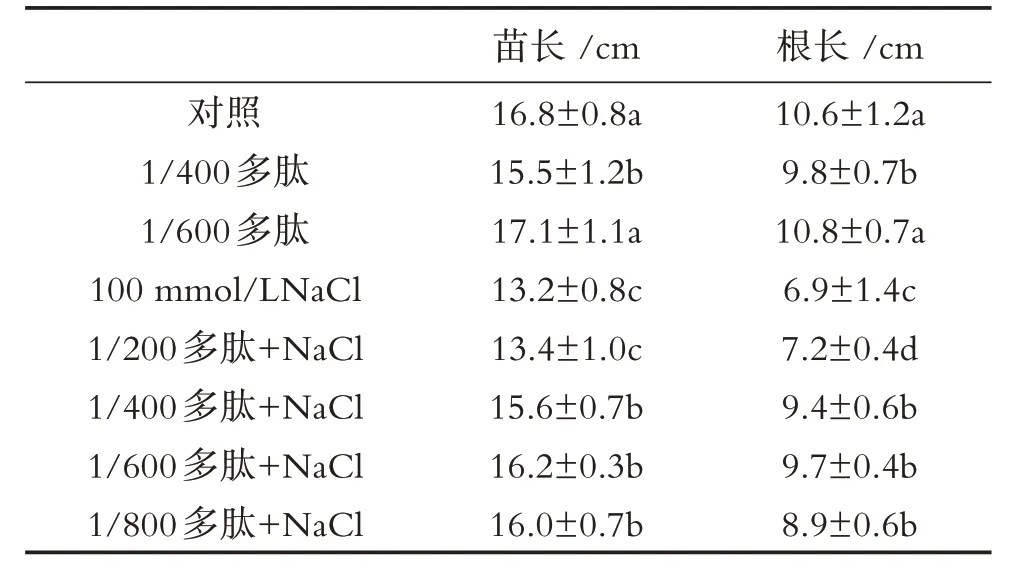
表1 氨基酸-多肽浓度筛选(7天)Table 1 Amino-polypeptide concentration screening (7 days)
1.5 发芽率和生物量测定
小麦种子萌发7 天后统计总发芽数量并计算其最终萌发率.随机选取幼苗生长实验中多肽处理10 天后的小麦幼苗10 株分别测定各组幼苗的苗高、苗重(干/鲜重)、根长和根(干/鲜重),然后计算各组小麦幼苗的相对含水量(RWC)[34]:
RWC=(鲜重-干重)/(饱和重-干重)×100%式中,干重指将材料放于75℃烘箱中48 h,直至衡重的重量;饱和鲜重指将材料浸泡于去离子水中24 h待植物叶片和根吸饱水至衡重的重量.
1.6 生理指标测定
随机选取多肽处理10 天后的小麦幼苗叶片,用纯水冲洗3~5 次,将表面擦干后用于各逆境生理指标含量的测定.
1)光合色素含量测定.参考Arnon 等方法[35],称取0.5 g小麦叶片,加95%乙醇10 mL充分研磨,然后用95%乙醇定容至50 mL,4000 r/min 离心10 min.用UV-2300 分光光度计测定A665、A649 及A470 值,计算叶绿素a(chla)、叶绿素b(chlb)和类胡萝卜素(car)的含量.
2)可溶性蛋白含量测定.参考Theerakulpisut等测定方法[36],称取0.5 g 新鲜叶片,用5 ml 蒸馏水研磨,后10000 r/min 离心10 min.取上清1 ml并加入5 ml G-250,静置5 min 后,于595 nm 波长下比色.测得OD 值后查标准曲线,算出叶片中可溶性蛋白含量.
3)抗氧化酶活性测定.取新鲜小麦叶0.5 g,加入5 mL(50 mM pH 7.8)磷酸缓冲液充分研磨(冰浴)后于4℃离心20 min,取上清液用于SOD、POD和CAT活性测定.重复三次.
SOD 酶活力测定方法参照Giannopolitis 等方法并稍作修改[37],于560 nm 比色测定OD值,然后计算SOD 活性.POD 酶活力测定参照Kochba 等的方法[38]稍作修改,于470 nm 波长下比色测定OD 值.CAT 酶活力测定参照Cakmak 等[39],240 nm 波长下测定OD值,计算CAT活性.
4)脯胺酸含量测定.参照Bates 等[40]方法,在520 nm 波长下测定OD 值,后查标准曲线计算脯胺酸含量.
5)丙二醛和H2O2含量测定.根据Rao 等[41]方法测定丙二醛(MDA)含量(稍作修改),分别测定450、532和 600 nm波长的OD值,计算丙二醛含量.
H2O2含量测定参考Shi等方法[42]并稍作修改,取0.5 g小麦叶,加入3 mL 3%(w/v) TCA,冰浴研磨,离心15 min.取1 mL 上清液加入1 mL 100 mM/L 磷酸缓冲液(pH 7.0)和2 mL 1M/L KI.测吸光值并查标准曲线计算H2O2含量.
6)α-淀粉酶活性的测定.α-淀粉酶活性的测定参考刘丽云等[43]用3,5-二硝基水杨酸法,并略作修改,在520 nm 波长下比色测定OD 值并查标准曲线计算酶活性.
7)实验结果的处理分析方法.所有数据均采用SPSS 20.0和Excel 2007结合分析.
2 结果与分析
2.1 种子的萌发率和小麦幼苗生物量变化
随着盐浓度的提高,川育27 的发芽率、苗高、苗(干/鲜)重、根长、根(干/鲜)重以及叶片相对含水量均显著降低,而在盐胁迫的同时外源多肽处理后,小麦种子的萌发率与单独盐处理(100 mM 和200 mM NaCl)相比提高了18%和21%,且小麦幼苗苗高、根长和苗根(干/鲜重)以及相对含水量和α-淀粉酶活性均显著增加(图1、表2).

图1 各处理组川育27幼苗形态Fig.1 The growth of wheat seedling
2.2 小麦幼苗光合色素含量变化
培养液中未添加NaCl 时,只添加1/600(0.17%)外源多肽与对照组间的叶绿素和类胡萝卜素含量无明显差别,用100 mM NaCl处理后川育27幼苗的叶绿素a、叶绿素b、总叶绿素(chla+b)含量和类胡萝卜素(car)含量分别降低了35%、43%、36%和18%;而200 mM NaCl 的处理小麦幼苗光合色素含量更低,分别降低了66%(叶绿素a)、69%(叶绿素b)、66%(总叶绿素)和39%(类胡萝卜素).在100 mM NaCl 胁迫下添加了外源多肽后小麦中的光合色素含量得到了显著提高,且与对照相近;200 mM NaCl 胁迫下,添加多肽的G6组的光合色素含量虽仍比对照低,但是却明显比未添加多肽的G5组高(图2).
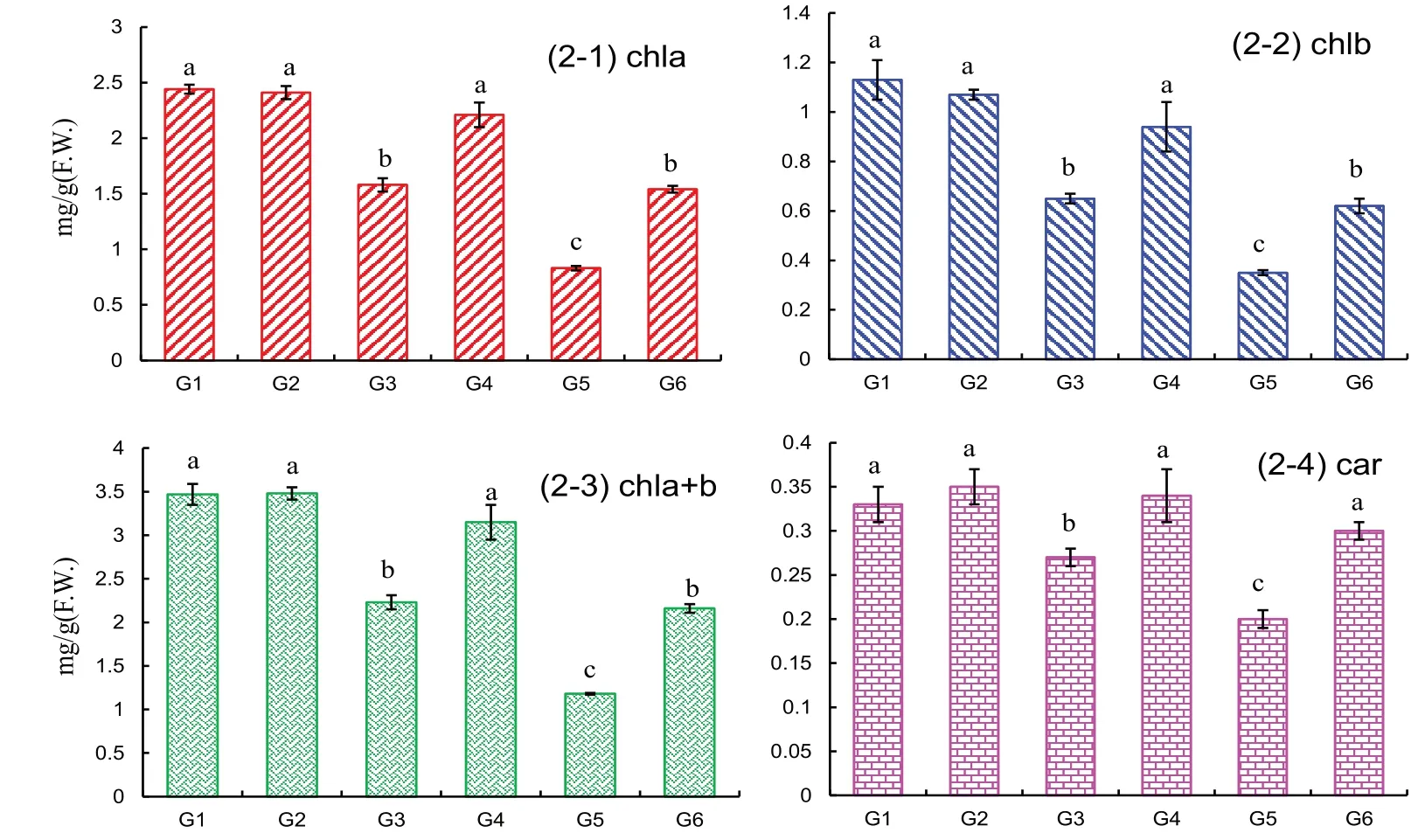
图2 川育27各处理组小麦幼苗叶片光合色素含量Fig.2 Effects of polypeptide on photosynthetic pigment content in Chuanyu 27 under saline and non-saline conditions
2.3 小麦幼苗中脯氨酸和可溶性蛋白含量变化
如图3-1 所示,随着添加的NaCl 浓度的不断提高,幼叶中脯胺酸含量也不断提高,且与对照相比100 mM NaCl 和200 mM NaCl 处理后小麦叶片中脯胺酸积累量显著增加.而与单独NaCl 处理组相比,施用外源多肽后脯胺酸的积累量更高,分别提高了57%和35% (图3-1).而可溶性蛋白含量却随NaCl浓度的增加而下降,但用外源多肽处理后小麦中可溶性蛋白得到提高(图3-2).
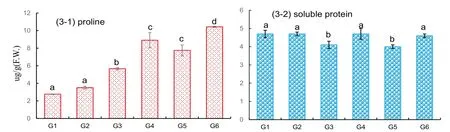
图3 川育27各处理组小麦幼苗叶片脯胺酸含量(3-1)和可溶性蛋白含量(3-2)Fig.3 Effects of polypeptide on proline and soluble protein content in Chuanyu 27 under saline and non-saline conditions
2.4 小麦幼苗中丙二醛(MDA)和H2O2含量变化
丙二醛是细胞膜脂过氧化的产物之一,可作为一种生理指标来衡量各种非生物胁迫给植物细胞膜造成的氧化损伤程度.在未添加外源多肽处理下,100 mM NaCl 和200 mM NaCl 处理组小麦的MDA含量增加了146%和179%,而添加多肽后小麦的MDA 含量与单独盐处理组比较则显著减少(略高于对照),分别减少了47%和48%(图4-1).只添加多肽的G2组和对照组的MDA 含量相差并不显著,G2组小麦幼苗MDA含量只比对照略低一点.
与对照相比,随着NaCl浓度的提高小麦叶片中H2O2含量急剧上升,100 mM NaCl 处理后小麦中H2O2含量增加了72%,而200 mM NaCl 处理的小麦H2O2含量与对照相比增加了近一倍(99%).在盐胁迫下处理多肽后小麦的H2O2含量显著减少,分别减少了16%(100 mM NaCl+ 多肽)和20%(200 mM NaCl+多肽).而只添加多肽处理组小麦中H2O2含量与对照基本相同(图4-2).
2.5 小麦幼苗中三种抗氧化酶活性的变化
盐胁迫能使小麦幼苗中的抗氧化酶活性显著增强,这其中也包括SOD、POD 和CAT 三种主要的抗氧化酶活性(图5).实验发现,与对照和单纯NaCl处理组相比,在盐胁迫或者非盐胁迫条件下,添加外源多肽均显著提高了SOD(图5-1)、POD(图5-2)和CAT(图5-3)的活性.在非盐生长条件下,添加多肽后小麦中SOD、POD 和CAT 活性与对照比分别增加了128%、30%、24%;在100 mM 和200 mM NaCl胁迫的同时添加多肽后小麦幼苗中三种酶活性分别增加了39%(SOD)、52%(POD)、66%(CAT)和38%(SOD)、20%(POD)、28%(CAT).而对于添加了多肽的三个处理组(G2、G4、G6)来说,不管是否处于盐胁迫的生长条件,以上三种酶的活性均比未处理多肽时的活性高,且差异显著(p<0.05).
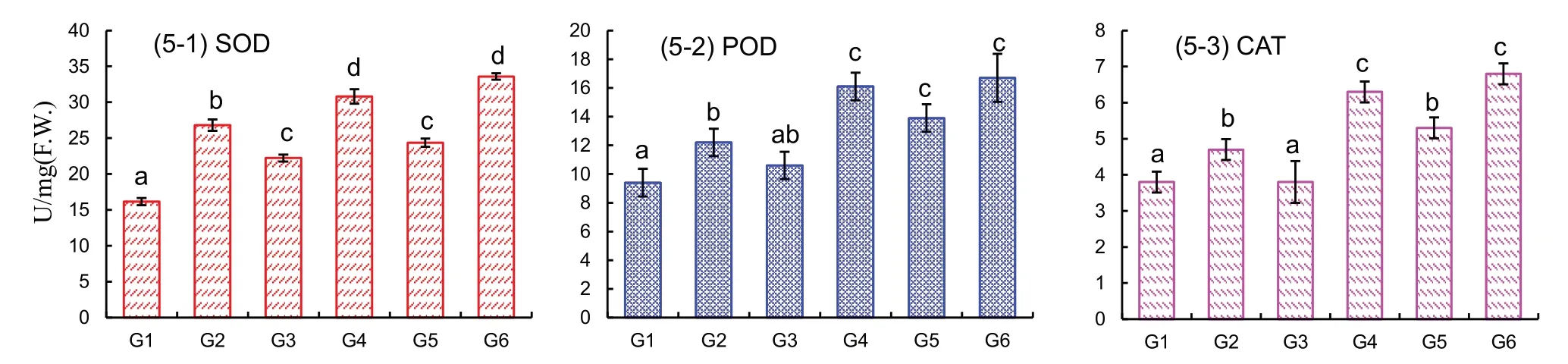
图5 川育27各处理组小麦幼苗中抗氧化酶活性SOD活性、POD活性和CAT活性Fig.5 Effects of polypeptide on SOD, POD, and CAT activities in Chuanyu 27 under saline and non-saline conditions
3 讨论与结论
种子的萌发期是植物生长发育过程中最关键的时期,容易受到外界环境的影响.处于萌发时期的种子对土壤中的盐含量十分敏感,持续盐胁迫会明显减少小麦种子萌发率和生物量[33].本实验用100 mM 和200 mM NaCl 分别处理小麦种子,其发芽率与未处理相比降低了22%和37%.用1/600(0.17%)多肽预处理后,小麦种子在两种盐胁迫浓度下发芽率得到显著提高,且多肽处理后的小麦种子中α-淀粉酶活性有所提高(表2).小麦种子在未发芽时,种子内不存在α-淀粉酶,它只在籽粒发芽时产生,且随着发芽时间的增长,其活性也随之增强[44].这说明外源多肽促进小麦种子萌发机理可能与多肽诱导提高小麦种子内α-淀粉酶活性有关,而种子内α-淀粉酶活性的高低与种子胚乳中的淀粉分解有关,小麦种子胚乳内储存的淀粉主要被淀粉酶水解成麦芽糖等单糖分子,为种子的萌发提供直接的能量物质[45-46],以满足种子萌发时所需的能量消耗,促进其萌发.由此表明施加多肽能提高小麦种子中的α-淀粉酶活性,因而有助于小麦种子的萌发,提高其萌发率.
同样在盐胁迫下用多肽处理后,小麦幼苗的鲜/干重、根的鲜/根重、幼苗高、根长以及相对含水量均与未处理幼苗相比均有显著提高(表2),且与王旭东等[47]对玉米幼苗喷施多肽-氨基酸液态肥,增加了幼苗根系长以及根茎叶干重的研究结果相一致.以上说明在高浓度盐环境中,外源多肽不仅能促进小麦种子的萌发,还能增加其生物量和相对含水量,这在一定程度上缓解了高盐浓度造成的小麦种子发芽率低、叶片水分缺失和幼苗生物量减少的负面效应.
叶绿素是植物光合作用必不可少的,同时也是反映植物是否适应非生物胁迫的生理指标之一.土壤中过量Na+积累会破坏植物细胞类囊体膜的结构和功能,使植物叶绿素含量和类胡萝卜素含量减少[48],从而使植物的光合作用效率降低,最终限制植物的正常生长和发育. 外源γ-氨基丁酸能缓解NaCl 胁迫造成的植物叶绿素的降解程度[33],吴英[49]等研制的多肽-氨基酸叶面肥料能提高大豆的抗逆性,增强作物的光合作用能力. 与前人研究结果相似,本实验也发现在100 mM 和200 mM NaCl 胁迫下,与对照相比,小麦(川育27)幼苗中叶绿素a、叶绿素b 和总叶绿素含量大幅度减少,而在其培养液中添加1/600(0.17%)外源多肽并培养10 天后,小麦叶片中叶绿素a、叶绿素b、总叶绿素含量和类胡萝卜素含量与单独盐处理相比均有显著提高(图2).王旭东等[47]用多肽-氨基酸液态肥浸种后玉米幼苗的叶绿素含量也有所提高.由此可以推断,外源多肽或氨基酸能影响植物叶片中叶绿素的合成或者通过某种机制减缓逆境下导致的叶绿素的降解程度,增强小麦幼苗的盐适应能力.
脯胺酸是植物的抗逆生长中的一种主要的渗透调节物[26].植物受到盐胁迫时细胞内迅速积累脯氨酸,分配胞质和液泡的电解质液以平衡因胁迫造成的水分亏缺,并能够防止质膜透性改变、稳定蛋白质结构、阻止蛋白质降解,对质膜的完整性具有保护作用.研究发现脯胺酸积累含量高的芥菜要比对照更耐盐[50].本实验中,脯胺酸含量随着盐浓度的提高而显著增加,在培养液中添加多肽后小麦幼苗脯胺酸含量增加(图3-1).逆境环境下植物体内的脯胺酸积累有利于维持渗透平衡[51],以减轻其对植物细胞造成的损伤,增强植物的逆境适应能力.在大量Na+存在条件下植物中的可溶性蛋白也是重要的渗透压调节剂,本研究所用的外源多肽对小麦幼苗可溶性蛋白含量产生较大的影响,在盐胁迫下添加多肽后可溶性蛋白的含量有所增加(图3-2).小麦细胞内脯胺酸含量和可溶性蛋白含量等可溶性小分子物质的积累,有利于小麦细胞在盐环境中维持渗透平衡,减少细胞在过量Na+的环境对Na+的大量摄入,有利于维持细胞内的Na+/K+平衡[29].结果说明外源多肽是通过诱导调节小麦幼苗体内的脯胺酸含量和可溶性蛋白含量,来提高幼苗细胞的渗透调节能力和小麦的盐适应能力.
植物在正常生长环境下,细胞内活性氧(ROS)的浓度低且对植物无害,但是当土壤中盐分过高时则会造成氧化胁迫.植物在胁迫环境下会产生单态氧(O2)、超氧化物(O2-)、过氧化氢(H2O2)和羟基(-OH)等活性氧(ROS)[52].本实验也发现在100 mM 和200 mM NaCl 存在情况下,幼苗中H2O2含量均明显比对照要高(p<0.05)(图4-2).这些在植物中产生和积累的活性氧(ROS)会破坏细胞膜系统,打乱细胞正常呼吸代谢,诱导发生脂膜过氧化作用[1]、蛋白质降解和DNA 突变等毒害反应损伤植物细胞.脂膜过氧化作用产生的物质,如丙二醛含量过高会增大细胞膜的透性,引起胞内物质外渗,对细胞膜造成伤害[53],因此MDA 的含量也代表了质膜受损害的轻重.本实发现,培养液中添加NaCl 10 天后小麦幼苗中的MDA 含量明显高于对照(图4-1),这与Zhang[5]等结果一致,盐浓度越高小麦幼苗受损伤的程度越大.而在盐胁迫的同时添加多肽后,这种情况得到了缓解,与单独盐处理相比添加多肽后的小麦幼苗体内MDA 含量显著减少(图4-1).这说明外源多肽能降低小麦幼苗中H2O2和MDA 的产生和积累,并因此提高了小麦的耐盐能力.而这种减少H2O2和MDA 含量的机制可能与多肽诱导增强小麦幼苗的抗氧化酶活性有关,可利用这些酶类清除植物体内多余的活性氧,减轻植物细胞因胁迫造成的氧化损伤[54],从而减少H2O2含量和MDA 的生成.
超氧化物歧化酶、过氧化氢酶和过氧化物酶是植物抵抗逆境生长的三种主要的抗氧化酶;其中超氧化物歧化酶和过氧化氢酶是植物活性氧代谢中的关键酶,并与其它保护酶类一起协同清除植物体内多余的活性氧自由基的作用[55],超氧化物歧化酶主要用于清除植物体内过量的O2-,并生成H2O2和O2,而过氧化物酶和过氧化氢酶则进一步将H2O2分解,最终生成H2O 和O2[56],以达到有效清除ROS、保护植物细胞不受氧化损伤的目的.本实验中在100 mM 和200 mM 盐环境下,多肽处理10 天后的幼苗中SOD、POD 和CAT 活性均得到明显增强(图5),且与之相对应的H2O2含量和MDA 含量也明显减少(图4).由此可说明多肽通过影响小麦幼苗的抗氧化酶系统,诱导和提高了幼叶中的抗氧化酶活性,从而能有效清除小麦幼苗在盐胁迫下产生的活性氧,减少细胞的过氧化反应,提高小麦的抗盐性.因此可以用外源添加氨基酸-多肽肥料等的方式来增强植物的抗逆能力,而不用借助传统育种或转基因技术,为开发新型氨基酸-多肽复合肥料做一些理论性参考.

