牛和小鼠早期胚胎发育过程中细胞谱系发育调控的比较
吴潇彤,史延,李爽,王少华,张坤
(浙江大学动物科学学院,浙江省奶牛遗传改良与乳品质研究重点实验室,浙江 杭州 310058)
长期经高强度选育的荷斯坦奶牛产奶性能已得到显著提升[1],但问题也随之而来,高产奶牛的繁殖效率比较低。影响奶牛繁殖效率的因素有很多,比如品种、环境、饲养管理、繁殖技术、疾病等[2],这些因素可能会导致受精失败、早期胚胎发育阻滞、遗传缺陷或流产。因此,对牛胚胎发育调控的研究有助于开发相关措施,提高奶牛繁殖效率。
哺乳动物的发育起始于高度分化的配子(精子和卵细胞)结合形成受精卵,历经6~7 次(以牛为例)有丝分裂后,单细胞的受精卵逐步发育成囊胚(受精后6~7 d,图1)。随后,囊胚到达子宫并在受精后19~21 d着床,进一步发育成胎儿。正常的早期胚胎发育是后续胎儿成功发育的前提(本文所指的早期胚胎发育阶段特指受精后胚胎发育到囊胚期的过程)。因此,早期胚胎发育过程中诱导胚胎分化的调控机制是目前早期胚胎发育研究的热点。
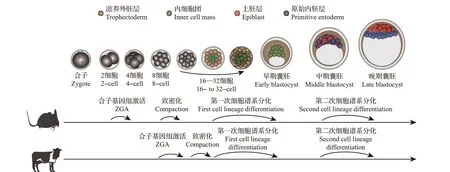
图1 小鼠和牛早期胚胎发育过程中的形态变化及关键生物学事件Fig.1 Morphological changes and key biological events during early embryonic development in mice and cattle
早期胚胎发育主要依靠母源mRNA 和蛋白质,直到合子基因组激活(zygotic genome activation,ZGA)的发生(小鼠为2细胞期,牛为8—16细胞期)。随后胚胎形态发生变化,卵裂球由先前的松散状态转变为互相压缩的紧实状态,即致密化。同时,细胞形成顶端-基底轴,胚胎极性由此建立[3]。细胞极性建立和不对称分裂对于胚胎后续的发育至关重要。在桑葚胚期,位于滋养外胚层(trophectoderm, TE)细胞基底膜区域的钠钾泵将含Na+的液体泵入TE 细胞外间隙,形成多个微腔,随着Na+不断积累,形成渗透梯度,液体持续泵入微腔,直至达到细胞外间隙的承受阈值,多个微腔破裂形成一个充满液体的囊胚腔[4],标志着囊胚的形成。在囊胚形成前后,早期胚胎大致发生2 次细胞谱系分化,最终形成3 种类型的胚层细胞——TE细胞、原始内胚层(primitive endoderm, PE)细胞、上胚层(epiblast, EPI)细胞。多种信号通路参与胚胎细胞谱系分化,如Hippo、Notch、Wnt、MEK/ERK通路等。本文从胚胎形态变化、转录因子以及细胞信号通路等角度,综述牛和小鼠早期胚胎发育过程中细胞谱系分化的调控。
1 早期胚胎发育过程中的胚胎形态变化
哺乳动物早期胚胎发育过程中形态变化相似,但发育进程差异较大,关键生物学事件如ZGA、致密化等发生的时间存在差异(图1)。
1.1 早期卵裂
精卵结合形成受精卵意味着早期胚胎发育的开始,随后受精卵不断进行细胞分裂,此过程称为“卵裂”。胚胎中卵裂球的分裂并不同步,因此在某些时刻胚胎中细胞数目为奇数。随着分裂不断进行,胚胎的细胞数目持续增加,但胚胎的体积变化不大[5],为后续的胚胎致密化奠定基础。此外,这一时期存在一个重要的生物学事件——ZGA。在ZGA 之前,合子基因组保持转录沉默,胚胎发育主要依靠母源mRNA 和蛋白质。合子基因组正常激活后,大量母源mRNA 降解,只有部分母源mRNA编码的蛋白质可以在这一时期之后少量表达。小鼠和牛发生ZGA的时间并不相同。在小鼠中,次要ZGA 发生在胚胎1 细胞S 期到2 细胞G1 期[6],此时合子基因转录水平较低且转录产物高度混杂[7];主要ZGA发生在2细胞晚期,此时大量合子基因被激活并且开始转录;而在牛中,ZGA发生在8—16细胞期[8](表1)。

表1 小鼠和牛早期胚胎发育时期和事件比较Table 1 Comparison of periods and events of early embryonicdevelopment between mice and cattle
1.2 致密化和极性化
胚胎在历经前几轮分裂后,迎来一个重要的形态变化——胚胎致密化。哺乳动物中胚胎致密化发生的时间存在差异,小鼠胚胎致密化发生在8 细胞期[9],而牛胚胎致密化发生在16—32 细胞期[10](表1)。
致密化发生前,小鼠胚胎的微绒毛在卵裂球上均匀分布。当小鼠胚胎发育至8 细胞期,微绒毛开始富集在细胞表面区域,此时,胚胎的顶端-基底轴开始形成。形成的顶端膜区域使卵裂球产生极性[3],并使其进行不对称分裂。子代通过不对称分裂获得顶端膜区域[11],细胞极性得以维持。在小鼠胚胎发育至16细胞期时,内部细胞表面的微绒毛分布稀疏,而外部细胞顶端膜区域的微绒毛分布密集[12]。在牛胚胎9—15 细胞期,部分卵裂球中微绒毛的分布出现极化,16细胞期之后细胞极化变得更加明显[13]。埃兹蛋白(ezrin, EZR)负责连接膜蛋白和肌动球蛋白[14]。有研究认为,EZR 参与微绒毛的形成:胚胎致密化发生前,EZR 在细胞表面均匀分布;致密化发生后,磷酸化的EZR 开始聚集在细胞的顶端膜区域,随着细胞不断分裂,在16 细胞期EZR 只在外部细胞中表达[15]。在小鼠胚胎中,顶端膜区域的形成在细胞谱系分化过程中发挥重要作用,但在牛胚胎中,抑制顶端膜区域的形成不会影响囊胚发育[16],说明早期胚胎发育过程中细胞谱系分化的调控机制具有物种特异性。
在胚胎的顶端膜区域,有大量蛋白酶激活受体(proteinase-activated receptors, PARs)复合体富集,包括PAR3、PAR6 和非典型蛋白激酶C(atypical protein kinase C, aPKC),在基底膜区域,有大量E-钙黏蛋白(E-cadherin,又叫CDH1)和PAR1 富集。CDH1 参与细胞-细胞接触点的黏着连接。在缺失CDH1 的胚胎中,外部细胞不能形成完整的上皮组织[17]。在分子水平上,富含CDH1 的丝状伪足从黏着连接和顶端膜区域的边缘向邻近细胞的顶端膜区域延伸并与邻近细胞紧密黏附[18]。在形态上,胚胎发生致密化时,卵裂球变得扁平,细胞界限变得模糊,细胞与细胞之间的接触增加[19]。在非极性细胞中,顶端膜蛋白aPKC的含量低于极性细胞,肌球蛋白的收缩性高于极性细胞[3],因此非极性细胞被周围的极性细胞向胚胎内部挤压。随着非极性细胞的内化,极性和非极性细胞收缩性的差异逐渐增大[3]。胚胎致密化和极性化为囊胚腔的形成奠定了基础。
1.3 囊胚腔的形成与扩张
细胞分裂和胚胎致密化持续进行,TE细胞持续压缩,上皮组织对机械力的感应持续增强,使细胞-细胞连接处逐渐成熟,即TE 细胞上皮组织逐渐成熟[20]。同时,基底膜区域的钠钾泵,即Na+/K+-ATP酶将液体泵入TE细胞外间隙,形成多个微腔[4]。液体持续泵入微腔使腔内浓度高于腔外,形成渗透梯度,而渗透梯度又促使液体继续泵入微腔,形成正反馈。当腔内液体累积达到微腔的承受阈值时,液体继续泵入微腔会使微腔破裂,大量微腔破裂合并形成一个囊胚腔,随后,破裂的细胞外间隙恢复密封状态,微腔再次形成,如此循环往复,囊胚腔随之扩张[20]。
2 关键基因与信号通路调控网络对胚胎细胞谱系分化的影响
早期胚胎大致经过2次细胞谱系分化形成3类细胞(TE细胞、PE细胞和EPI细胞)谱系。最终,TE细胞分化为胎盘,PE细胞分化为卵黄囊,EPI细胞分化为胎儿。在早期胚胎发育过程中,第一次细胞谱系分化的正常进行是第二次细胞谱系分化成功进行的前提。其中,胚胎极性建立和不对称分裂对第一次细胞谱系分化至关重要。针对第一次细胞谱系分化过程,科学家提出了多种假说。这些假说本质上相互关联,共同调控第一次细胞谱系分化并指导第二次细胞谱系分化。
2.1 “极性假说”
哺乳动物早期胚胎发育过程中,由单个细胞分裂而来且形态相似的细胞却拥有不同的细胞命运。细胞命运为何不同?细胞分裂方式为何不同?细胞位置为何有内外之分?基于这些疑问,科学家提出了多种模型。其中一个模型是“内-外假说”,该假说强调细胞所处位置是决定细胞命运的主要因素[21]。胚胎外侧细胞发育为TE 细胞,内侧细胞发育为内细胞团(inner cell mass, ICM)。另外一个模型是“极性假说”,该假说认为细胞极性的建立诱导细胞分化命运[11]。细胞极性形成后产生2种分裂方式,当细胞的分裂方向平行于顶端-基底轴时,发生对称分裂,产生2 个具有极性的子代细胞;而当细胞的分裂方向垂直于顶端-基底轴时,发生不对称分裂,产生1 个极性子代细胞和1 个无极性的子代细胞。
这些假说相互关联,协同决定细胞命运。例如,从ICM 分离出的细胞可以形成具有极性的TE细胞[22]。极性蛋白aPKC 和PAR3 可通过调节细胞间的紧密连接蛋白来影响胚胎细胞间的黏附性[23],其表达受阻会使外部细胞保持外侧位置的竞争力下降,从而发生内化。由此,胚胎致密化会增加细胞间接触,促进细胞黏附蛋白表达,从而促进细胞极化[24]。然而,细胞极化受阻会影响细胞的不对称分裂,引起细胞错误定位,使细胞分化过程混乱。胚胎顶端膜区域受损虽不影响牛囊胚形成,但会导致小鼠胚胎的TE细胞和ICM细胞分化失败[25],说明在牛胚胎中有其他途径参与调节细胞分化。
2.2 第一次细胞谱系分化
Hippo信号通路由胚胎致密化和顶端极性蛋白启动,如血管动蛋白(angiomotin, AMOT)和神经纤维瘤蛋白亚型2(neurofibromin 2, NF2),并且胚胎内部细胞和外部细胞会获得不同的Hippo 信号,产生不同的命运,说明细胞极性和不对称分裂影响Hippo通路的活性[26]。抑制AMOT不会影响牛囊胚发育[27]。在小鼠胚胎内部细胞中,AMOT 分布于细胞-细胞连接处,位于AMOT N 端结构域的第176位丝氨酸残基被大肿瘤抑制激酶1/2(large tumor suppressor kinase 1/2, LATS1/2)磷酸化后,会抑制肌动蛋白的活性,从而激活Hippo通路[28];而在外部细胞中,AMOT 位于细胞顶端膜区域,与肌动蛋白互作,抑制Hippo通路。哺乳动物不育系20样激酶1/2(mammalian sterile twenty-like kinase 1/2, MST1/2)和LATS1/2 是Hippo 信号通路的核心级联组件。在牛早期胚胎中,MST1/2 在细胞质中表达且功能冗余,在抑制细胞增殖、促进细胞凋亡方面发挥重要作用。同时,敲除Mst1/2会导致小鼠胚胎发育阻滞[29]。Lats1/2参与小鼠胚胎ICM的形成,并调控细胞分化命运[30]。
首先,Hippo 通路上游因子AMOT 等被激活,MST1/2 与 支 架 蛋 白SAV1(salvador family WW domain containing protein 1)和调节支架蛋白MOB1(MOB kinase activator 1)结合形成复合物,使LATS1/2磷酸化[31]。随后,磷酸化的LATS1/2使胚胎内部细胞中的Yes 相关蛋白(Yes-associated protein,YAP)/具有PDZ结合基序的转录共激活因子(transcriptional coactivator with PDZ-binding motif, TAZ)磷酸化。磷酸化的YAP/TAZ滞留在细胞质,不能作为转录共激活因子与内部细胞核中的TEA结构域转录因子4(TEA domain transcription factor 4, TEAD4)结合,内部细胞的多能性得以维持。Hippo 通路在胚胎外部细胞中则保持沉默,未被磷酸化的YAP/TAZ 进入细胞核与TEAD4 结合,促使外部细胞分化为TE 细胞。在小鼠胚胎中,敲低Lats1/2会导致内部细胞核中的YAP 表达升高[30]。TAZ 始终在细胞质表达[32],并且抑制YAP 表达不会影响囊胚发育[33]。在牛胚胎中,TAZ不仅持续在细胞质表达,还在囊胚期部分卵裂球的细胞核中表达,敲低TAZ不会影响牛囊胚率,但会使TE细胞数显著下降[34]。抑制YAP1会导致牛囊胚率下降[27]。因此,YAP 和TAZ作为连接LATS 激酶和下游转录因子TEAD4 的桥梁,发挥着至关重要的作用。
TEAD4是小鼠胚胎TE细胞分化的上游调控因子,却不是牛胚胎TE细胞形成和分化所必需的。在牛早期胚胎中,16 细胞期TEAD4转录本出现,桑葚胚期TEAD4大量表达[35],囊胚期TE细胞和ICM细胞中均有TEAD4表达,且TE 细胞中TEAD4mRNA 水平高于ICM 细胞[36]。利用RNA 干扰抑制TEAD4 表达时,胚胎仍能发育至囊胚[36],并且OCT4(organic cation/carnitine transporter 4)、NANOG(Nanog homeobox)、GATA3(GATA binding protein 3)和CDX2(caudal type homeobox 2)的表达均不受影响[35],说明在牛早期胚胎发育过程中有其他途径调控CDX2,如TFAP2C(transcription factor AP-2 gamma)就可以诱导CDX2表达[37]。
细胞通信网络因子2(cellular communication network factor 2, CCN2)由4个富含半胱氨酸的结构域组成:胰岛素样生长因子结合蛋白(insulin-like growth factor binding protein, IGFBP)结构域、血管性血友病C 型(von willebrand type C, vWC)重复序列、血小板反应蛋白(thrombospondin, TSP)重复序列和含有半胱氨酸基元的C 端(C-terminal, CT)结构域[38]。在牛胚胎中,敲低CCN2会导致TEAD4及多能因子OCT4和NANOG的表达显著下降,敲低TEAD4会导致CCN2的表达显著下降,说明TEAD4和CCN2相互作用,共同调节牛胚胎TE 细胞的分化[36]。
在小鼠早期胚胎中,抑制Tead4后,胚胎不能形成囊胚腔,Cdx2和Gata3表达下降,Oct4和Nanog未受影响[39]。在小鼠胚胎干细胞中,TEAD4仅在细胞质中表达,而在小鼠滋养外胚层干细胞中,细胞质和细胞核中均有TEAD4表达[40]。由此推测,TEAD4在内部细胞核中表达会阻碍TE细胞和ICM细胞的分离,影响囊胚形成;反之,内部细胞中TE 细胞分化相关的转录程序会遭到破坏,导致内部细胞向ICM 细胞分化[40]。由此可见,在牛和小鼠早期胚胎中,TEAD4的表达模式及对下游转录因子的调控存在差异。
TE细胞的标记基因CDX2在TE细胞的形成和维持中发挥重要作用。在牛胚胎中,ICM 细胞中CDX2的转录水平低于TE细胞[41],敲低CDX2后,TE细胞数、ICM 细胞数和总细胞数保持不变,多能因子SOX2(SRY-box transcription factor 2)和OCT4的表达和定位不受影响[42],TE 细胞标记基因IFNT(interferon-tau)和KRT8(keratin 8)的表达也不受影响[43],GATA3的表达下降。此外,敲低CDX2虽不影响牛囊胚形成,但会使囊胚发育延迟,以及使TE细胞上皮组织的完整性遭到破坏[43],说明CDX2对牛胚胎TE 细胞的形成虽不是必需的,但对维持TE细胞的完整性至关重要。有观点认为,牛基因位点在染色体区域的位置影响其在谱系分化过程中的表达,如在CDX2和NANOG高表达时期,其基因位点倾向于分布在染色体区域的外侧[44]。此外,YAP 在细胞中的定位与CDX2 的转录状态有关,且CDX2在细胞核中的表达滞后于YAP[45]。Wnt 家族成员3A(Wnt family member 3A, WNT3A)可能通过WNT-YAP/TAZ 信号通路激活和调节CDX2[46]。在小鼠胚胎中,敲除合子Cdx2不会影响囊胚发育,然而,敲除母源-合子Cdx2会造成TE细胞分化混乱甚至小鼠胚胎死亡[47],说明合子Cdx2不是TE 细胞形成所必需的,而母源Cdx2对TE 细胞的分化至关重要。有研究发现,在小鼠胚胎中,Cdx2和细胞极性相互作用可以调控细胞核的位置,比如,在进行不对称分裂的细胞中,细胞核位于细胞基底区域,而在进行对称分裂的细胞中,细胞核位于细胞顶端区域,CDX2表达升高,细胞核向顶端区域移动[48]。
H1FOO(H1 histone family member O, oocytespecific)是连接组蛋白1(linker histone 1, H1)的一个变体蛋白,其表达始于卵母细胞,ZGA 后被合子H1 取代[49]。连接组蛋白的氨基酸序列具有高度可变性,导致物种间H1FOO 序列存在差异。在小鼠胚胎中,敲低H1foo会使胚胎延迟进入2细胞期,但过表达H1foo并不影响胚胎发育[50]。在牛中,敲低H1FOO后,胚胎停滞在桑葚胚期[51],谱系分化因子CDX2、GATA3、KRT8和极性相关基因AMOT、EZR的表达均下降,抑制性染色质标记因子H3K9me3和H3K27me3 的含量上升,开放性染色质标记因子H4K16ac 的含量下降;过表达H1FOO后,牛的囊胚率下降约50%[50],说明H1FOO通过调节细胞分化和染色质结构参与牛早期胚胎发育调控。
Notch信号通路在物种间高度保守,并在细胞分化和凋亡等方面发挥重要作用[52]。在经典的Notch信号通路中,配体(Delta-like 1/3/4 和Jagged 1/2)和受体(Notch 1/2/3/4)结合,通过蛋白酶解激活Notch受体,释放Notch 胞内结构域(Notch intracellular domain, NICD)。随后,NICD进入细胞核与转录效应器RBPJ(recombination signal binding protein for immunoglobulin kappa J region)结合,招募其他共激活因子形成转录复合体,从而发挥调控作用[51]。在小鼠中,Notch 信号通路在4 细胞期被激活,并且只在TE细胞中活跃,说明Notch信号通路在第一次细胞谱系分化过程中发挥重要作用[53]。干扰Notch 信号通路会影响囊胚发育,促使SOX2表达下降[54]。有研究发现,在小鼠囊胚中,Notch 信号通路与Hippo信号通路共同调控CDX2 在TE 细胞中的特异性表达[53]:Notch、Hippo信号与CDX2上游的增强子结合,NICD/RBPJ 与SBNO1(Strawberry Notch homolog 1)结合,从而激活CDX2[55]。在牛胚胎中,NOTCH1mRNA 的表达在受精后显著上升,在2 细胞期达到峰值,随后逐渐下降,在桑葚胚期和囊胚期其表达均较低。RBPJ 在卵母细胞成熟和早期胚胎发育过程中持续表达,在8 细胞期之前,RBPJ 在细胞核和细胞质内均表达;在16细胞期及之后,RBPJ仅在细胞核中表达。敲低NOTCH1,牛的囊胚率显著下降,CDX2、TFAP2A和H1FOO表达下降。敲低RBPJ虽然不影响牛囊胚形成,但形成的囊胚较小,且总细胞数减少[51]。以上研究说明,Notch 信号通路通过调控H1FOO,参与牛卵母细胞成熟和早期胚胎发育过程调控。牛和小鼠胚胎第一次细胞谱系分化过程见图2。
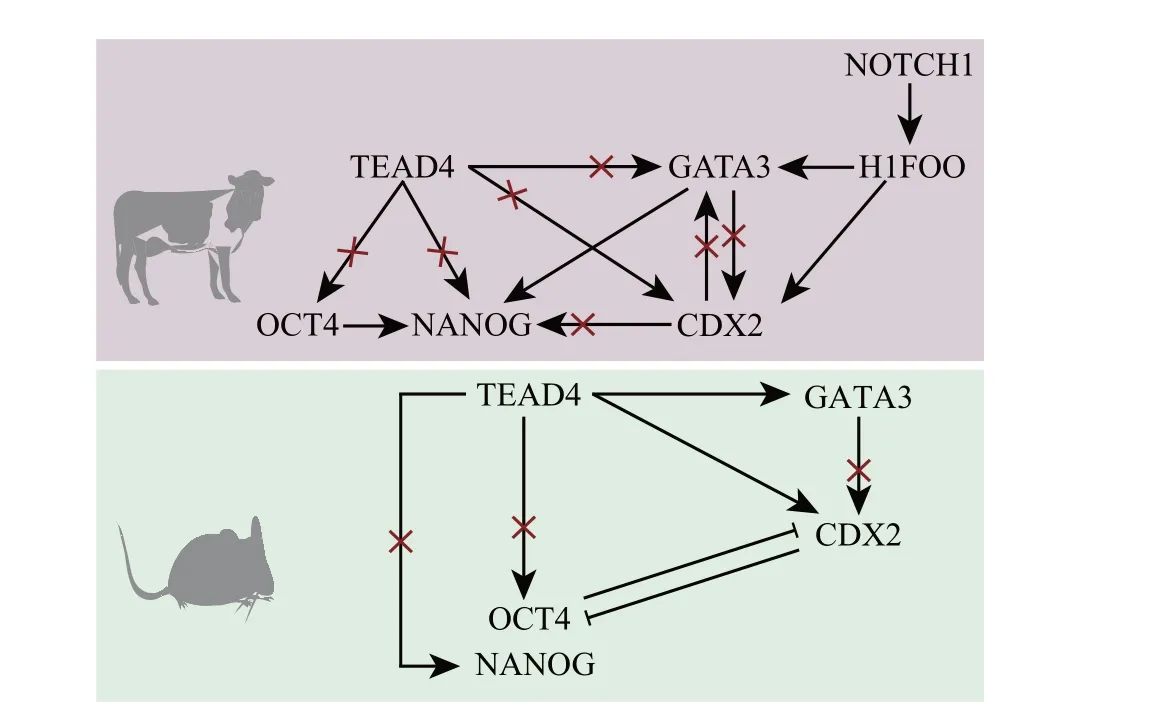
图2 小鼠和牛胚胎第一次细胞谱系分化Fig.2 First cell lineage differentiation in mice and cattle embryos
2.3 第二次细胞谱系分化
在第二次细胞谱系分化过程中,ICM细胞进一步分化为EPI细胞和PE细胞。EPI细胞表达大量多能因子,如NANOG、SOX2等,这些因子在维持细胞多能性方面起到至关重要的作用。PE 细胞表达大量促进与维持PE 细胞分化的因子,如GATA4/6、SOX17、PDGFRA(platelet-derived growth factor receptor alpha)等,这些因子相互作用共同调控EPI细胞和PE细胞的分化。
在胚胎内部细胞中,OCT4 对维持胚胎多能性和调节细胞分化起到重要作用。在牛卵母细胞中,OCT4转录本水平较低,ZGA后其表达水平升高,致密化阶段其转录水平急剧升高[56]。尽管ZGA 前期能检测到OCT4和SOX2转录本,但未能检测到相应蛋白[57],说明牛胚胎中OCT4与ZGA 的关联可能不密切。牛胚胎的TE 细胞和ICM 细胞中均有OCT4表达,且敲除牛合子OCT4后,胚胎仍能表达OCT4,表明母源OCT4在牛早期胚胎发育过程中对维持OCT4表达发挥一定作用[58],敲除OCT4后仍能形成囊胚,SOX2和GATA6的表达不受影响,NANOG和SOX17的表达被抑制[59]。在敲除OCT4的牛胚胎中表达外源成纤维细胞生长因子4(fibroblast growth factor 4, FGF4)时,NANOG 和SOX17 不能恢复表达[59],说明在牛胚胎中OCT4对维持EPI细胞多能性和PE 细胞分化发挥重要作用,CDX2 最初与OCT4共定位,但在囊胚期能观察到明显的谱系分离[60]。在小鼠早期胚胎中,OCT4 处于多能性调控网络的中心[58],OCT4 和CDX2 相互抑制以调控TE 细胞和ICM 细胞的分化。小鼠OCT4 存在TFAP2C 结合位点,可以抑制CDX2 的表达,而牛OCT4 不存在TFAP2C结合位点[61],说明OCT4在牛和小鼠胚胎中的功能存在差异。
在牛胚胎中,SOX2表达始于16细胞期,囊胚期时SOX2在ICM细胞中特异性表达。敲除SOX2后,在蛋白质水平上,NANOG 和OCT4 的表达均显著下降[62]。NANOG表达始于8—16细胞期[60],在早期囊胚中,NANOG 在TE 细胞和ICM 细胞中均有表达。敲除NANOG后,胚胎形成较小的囊胚腔,GATA6迁移至ICM 细胞中表达,SOX2和GATA6的表达下降,CDX2的表达不受影响[63],说明NANOG在TE细胞分化中无明显作用,但在EPI细胞、PE细胞的分化和多能性的维持方面发挥重要作用。在敲除NANOG的牛胚胎中,抑制促分裂原活化的蛋白激酶激酶[mitogen-activated protein kinase (MAPK)kinase, MEK]会导致胚胎死于囊胚期前,这与在小鼠胚胎中的情况相似[64];表达FGF4 不能完全恢复SOX17 的表达,这与在小鼠胚胎中的情况相反[64]。在牛早期胚胎中,NANOG和GATA6在ICM细胞中呈现“椒-盐”分布模式[58]。GATA6在牛胚胎的ICM细胞和TE细胞均有表达[65]。
在牛胚胎中,FGF 激活下游促分裂原活化的蛋白激酶(MAPK)诱导细胞分化[66]。敲低成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)后,牛胚胎中NANOG和GATA6的表达不受影响,HNF4A(hepatocyte nuclear factor 4 alpha)的表达显著下降,并且EPI细胞和PE前体细胞数目不受影响[67]。抑制牛卵母细胞FGF10表达会阻碍囊胚发育,限制卵丘扩大[68]。有研究发现,微RNA(microRNA, miRNA)在调控牛胚胎多能性方面发挥重要作用。例如,miR-218 直接调节CDH2和NANOG的表达,并且能在ICM细胞中调节NANOG以响应FGF 信号通路[69]。抑制牛胚胎的MAPK会促进内细胞团中NANOG的表达,抑制GATA6的表达,而SOX2和OCT4的表达不受影响[70]。双重抑制牛胚胎的MAP2K 和GSK3(glycogen synthase kinase 3)时,FGF4和NANOG的表达升高,PDGFRA和SOX1的表达降低,细胞类型由PE 细胞转变为EPI 细胞[71],说明MAP2K 和GSK3 可以促进细胞向PE细胞分化。
牛胚胎中SOX17表达始于16—32细胞期,最初,SOX17与NANOG共表达,在囊胚后期表达开始分离,抑制MEK 信号后,SOX17的表达在囊胚期下降[71]。激活Wnt 信号会 促 进ICM 细胞中OCT4、NANOG、SOX2和KLF4(KLF transcription factor 4)的表达,抑制TE 细胞中CDX2的表达[72],说明Wnt信号对细胞向EPI细胞分化起到一定作用。激活素A 促进囊胚发育,抑制NANOG和SOX2的表达,促进CDX2和GATA6的表达[73],说明激活素A 促使细胞向PE 细胞分化[73]。此外,在JAK/STAT3(Janus kinase/signal transducer and activator of transcription 3)通路中,磷酸化的STAT3 与SOX2、NANOG 在细胞核共定位,且JAK被抑制后SOX2的表达显著下降,ICM 细胞中未检测到磷酸化的STAT3[74],说明JAK/STAT3对于EPI细胞的分化起到重要作用。在小鼠胚胎中,PE细胞和EPI细胞的分化依赖于FGF/MAP信号,干扰ERK 会抑制GATA4/6 的表达[75]。敲低转录因子SMARCA5(SWI/SNF related,matrix associated,actin dependent regulator of chromatin,subfamily a,member 5),OCT4在TE细胞和ICM细胞中表达,且SOX17 和NANOG 的表达降低,EPI 细胞和PE 细胞的分化受到影响[76],说明SMARCA5对小鼠EPI细胞和PE 细胞的分化起到一定作用。牛和小鼠胚胎的第二次细胞谱系分化见图3,牛和小鼠早期胚胎发育生物学机制比较见表2。

表2 小鼠和牛早期胚胎发育生物学机制比较Table 2 Comparison of biological mechanisms at early embryonic development between mice and cattle
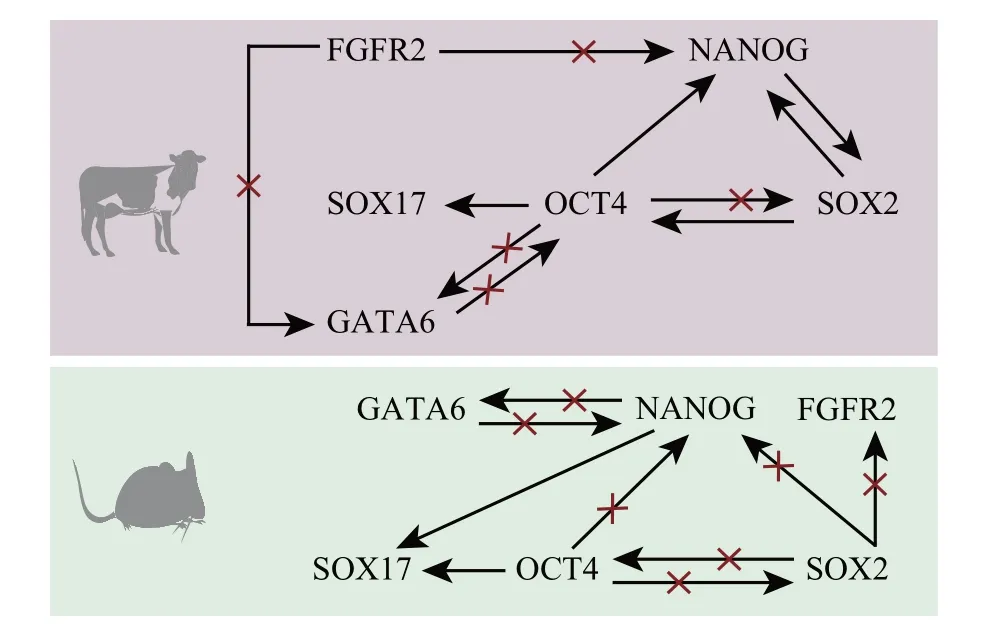
图3 小鼠和牛胚胎第二次细胞谱系分化Fig.3 Second cell lineage differentiation in mice and cattle embryos
3 结语
迄今为止,大部分关于哺乳动物胚胎发育的研究以小鼠为模型进行。由于存在种间差异,不同物种的胚胎发育模式存在差异。哺乳动物胚胎都要历经从受精卵到2 细胞、4 细胞、8 细胞、桑葚胚、囊胚等时期的形态转变,而各时期的持续时间、相同生物学事件的发生时期、转录因子的表达模式、转录因子的互作等在不同物种间存在差异。
哺乳动物早期胚胎发育是一系列动态变化的过程,包括物理变化和化学变化。物理变化指胚胎形态发生改变,主要与2个生物学事件相关,包括胚胎致密化和极性化以及囊胚腔的形成。化学变化指关键基因转录本的变化,合子基因组激活使胚胎内的基因表达发生剧烈变化,大部分母源基因降解,合子基因实现由沉默到转录爆发的转变,从而调控后续发育。胚胎发育受到多种因素的影响,如细胞微环境、细胞所处位置、细胞极性和机械力的感知等,这些因素可能相互作用共同调控胚胎发育,因而在分析某一现象时不能孤立看待某一因素。此外,由于种间差异,基于小鼠的研究不能完全照搬运用于其他物种,因此,有必要对其他物种的胚胎发育进行研究以及进行物种间胚胎发育比较,拓展对哺乳动物胚胎发育的认知。

