17β-雌二醇和维生素K2对人脐带间充质干细胞成骨分化的影响
白立恒,包图雅,史雪梅,曹贵方,宋永利,郭继彤,王东阳
1.内蒙古妇幼保健医院妇产科,内蒙古呼和浩特 010020;2.内蒙古医科大学基础医学院,内蒙古呼和浩特 010010;3.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;4.内蒙古大学生命科学学院,内蒙古呼和浩特 010070;5.内蒙古奕宏医学研究有限公司,内蒙古呼和浩特 010000;6.赤峰学院附属医院生殖医学科,内蒙古赤峰 024000
外伤、感染、肿瘤常常损伤骨组织导致骨不连、骨缺损等,骨组织虽然能够进行重塑和再生,但因骨自身生长缓慢会导致骨缺损和骨折延迟愈合。目前治疗骨缺损常选择手术治疗,手术后会导致新骨形成缓慢和术后并发症等问题[1]。间充质干细胞(mesenchymal stem cells, MSCs)的趋化和增殖作用能够促进骨骼发育形成,同时MSCs 在一定条件下可以分化为软骨细胞、成骨细胞,肌细胞等[2-3],通过分泌多种细胞因子改善体内炎症反应、促进关节周围血管再生[4]。骨髓间充质干细胞的取材有创且细胞增殖分化能力会随着人体老化而逐渐减弱[5]。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells, hUC-MSCs)具有更强的增殖和分化能力,作为骨组织工程的种子细胞更有优势。
雌二醇(β-Estradiol, E2)能够抑制破骨细胞活性使破骨细胞数量减少,通过促进成骨细胞增殖对绝经后引起的骨质疏松具有重要预防和治疗作用[6]。维生素K2(vitamin K2, VK2)通过加速谷氨酸残基羧化,促进MSCs 成骨分化增加骨骼的数量,对骨骼具有重要保护作用。基于以上的研究背景,本研究于2019年11月取内蒙古妇幼保健院一份脐带标本,并分离出hUC-MSCs,探讨了E2和VK2对hUC-MSCs 的成骨分化的作用,为骨损伤的治疗提供理论依据,现报道如下。
1 材料与方法
1.1 材料来源
选取本院的1 份脐带标本,经产妇同意,本研究已通过内蒙古医科大学伦理委员会批准,符合医学伦理标准。实验试剂:鼠抗人CD73、CD45、CD34、人类白细胞DR 抗原(human leukocyte antigen-DR,HLA-DR)(BD,美国),总RNA 极速抽提试剂盒(飞捷,上海),逆转录试剂盒、Green Taq Mix 试剂盒、高敏型化学发光检测试剂盒(诺唯赞,南京),17β-雌二醇、维生素K2(MCE,美国)。
1.2 方法
1.2.1 细胞的提取、培养与鉴定 取出脐带标本,杜氏磷酸缓冲盐溶液冲洗脐带组织至无血色,将脐带剪成大小约1~2 mm3的组织块放入离心管中。加入1 mg/mL 的I型胶原酶置于37 ℃摇床中持续消化,6 h后加入完全培养基终止消化;取上清液离心收集细胞。通过hUC-MSCs 成骨、成脂、成神经诱导分化培养基刺激干细胞分化,3 周后用茜素红、油红O、甲苯胺蓝染色,镜下观察。取P3 代hUC-MSCs,添加胰酶消化处理后用杜氏磷酸缓冲盐溶液重悬,制成密度为1×107个/mL 的细胞悬液。每1.5 mL 塑料离心管中取100 μl 细胞悬液装入并标记。室温下分别向细胞悬液中加入20 μl 经PE 标记的CD73、20 μl 经荧光素5-异硫氰酸酯(fluorescein isothiocyanate isomer, FITC)标记的CD45、CD34、HLA-DR。离心弃上清后用PBS 磷酸盐缓冲液清洗,上流式细胞仪检测,结果使用Cell Quest 软件分析。
1.2.2 实验分组 选择10-10mol/L E2、10-7mol/L VK2进行实验分组如下:对照组(control 组)只添加成骨诱导培养基;E2组加入成骨诱导培养基和10-10mol/L E2;VK2组加入成骨诱导培养基和10-7mol/LV K2;E2+VK2组加入成骨诱导培养基、10-10mol/L E2和10-7mol/L VK2,每组设置6 个复孔,24 h 后收集待用。
1.2.3 实时荧光定量聚合酶链式反应(reverse transcription-polymerase chain reaction, RT-PCR)检测目的基因的表达 收集P3 代hUC-MSCs 细胞,加入500 μL 的裂解液,提取细胞总RNA 并检测浓度,反转录后RT-PCR 检测成骨基因Runt 相关转录因子2(recombinant runt related transcription factor 2,RUNX2)、Ⅰ型胶原(type I collagen, COL1)的表达。RT-PCR 引物信息见表1,按照ChamQ Universal SYBR qPCR Master Mix 的操作步骤,以反转录cDNA产物为模板,通过使用基因特异性引物在iCycler iQTM5 实时定量PCR 检测系统上进行的RT-qPCR来测定cDNA 样品的拷贝数,每20 μL 反应重复3次,反应体系20 μL:cDNA 模板2 μL,SYBR qPCR Master Mix 10 μL,上游引物与下游引物各0.4 μL,ddH2O 7.2 μL。根据Genebank 中RUNX2、COL1 序列设计聚合酶链式反应(polymerase chain reaction,PCR)扩增引物,β-actin 作为内参。碱性磷酸酶(alkaline phosphatase, ALP)测定:上述四组细胞继续培养1 周消化悬浮后,离心5 min 收集细胞,加入无菌磷酸盐缓冲液与0.2%TritonX-100,静置10 min。根据试剂盒说明操作,测定ALP 活性。

表1 引物序列
1.3 统计方法
采用SPSS 22.0 统计学软件进行数据分析。符合正态分布的计量资料用(±s)表示,采用单因素方差分析(One-way ANOVA)。结果满足方差齐性时,两两比较采用最小显著差值法(Leastsignificant difference, LSD),不满足方差齐性时,两两比较采用Dunnett’s T3 法。P<0.05 为差异有统计学意义。
2 结果
2.1 hUC-MSCs 的分离培养及鉴定
采用酶消化法分离出hUC-MSCs,镜下观察细胞呈纺锤形,多角形或椭圆形等。3 d 后细胞形态开始转变为卵圆形、多角形及长梭形。hUC-MSCs经传代培养后显微镜下观察细胞分布均匀,形态单一,可见细胞进一步融合,见图1。成脂、成骨、成神经分化诱导21 d;①通过茜素红染色可见钙化结节形成,表明出现沉积矿盐,见图2;②油红O 染色后镜下可见胞浆被脂滴充满,见图3;③甲苯胺蓝染色后胞体中能够看到密集分布的尼氏体,见图4。

图1 显微镜下人脐带间充质干细胞的形态(100×)

图2 人脐带间充质干细胞成骨诱导后的形态和鉴定(茜素红染色400×)

图3 人脐带间充质干细胞成脂诱导后的形态和鉴定(油红O 染色400×)

图4 人脐带间充质干细胞成神经诱导后形态和鉴定(甲苯胺蓝染色400×)
2.2 不同药物对hUC-MSCs COL1 表达的影响
E2+VK2组、E2组、VK2组与control 组相比,COL1的表达增加,差异有统计学意义(相对表达量分别为 1.003、0.853、0.847、0.463,t=24.022、56.541、18.500,P<0.05)。E2组和VK2组两者比较,COL1 的表达差异无统计学意义(t=0.101,P>0.05)。E2+VK2组与E2组或VK2组比较,COL1 的表达上调,差异有统计学意义(t=23.468、13.930,P<0.05),表明联合作用更强。见图5。
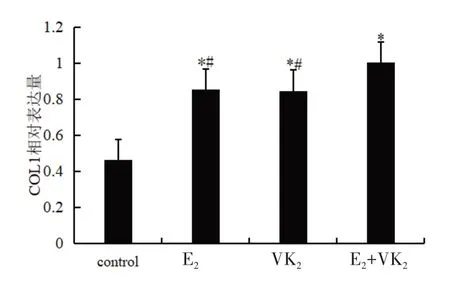
图5 不同药物对hUC-MSCs 中COL1 表达的影响
2.3 不同药物对hUC-MSCs RUNX2 表达的影响
E2+VK2组、E2组、VK2组与control 组相比,RUNX2 的表达上调,差异有统计学意义(相对表达量分别为1.170、0.830、0.757、0.513;t=15.119、48.833、34.617,P<0.05)。E2+VK2组与E2组或VK2组比较,RUNX2 的表达上调,差异有统计学意义(t=15.105、9.618,P<0.05),表明联合用药效果更好。E2组和VK2组相比,差异无统计学意义(t=2.345,P>0.05)。见图6。

图6 不同药物对hUC-MSCs RUNX2 表达的影响
2.4 不同药物对hUC-MSCs 成骨分化过程中ALP活性的影响
E2+VK2组、E2组、VK2组和control 组相比,ALP表达上调,差异有统计学意义(相对表达量分别为0.163、0.127、0.137、0.083;t=25.000、38.000、41.000,P<0.05)。E2+VK2组与E2组或VK2组比较可见ALP活性升高,差异有统计学意义(t=62.092、51.702,P<0.05),表明联合用药作用更强。E2组和VK2组相比,差异无统计学意义(t=-2.121,P>0.05),见图7。

图7 不同药物对ALP 活性的影响
3 讨论
MSCs 具有成骨分化的能力,不同的成骨基因及蛋白可以代表骨分化的不同阶段。本研究选择COL1、RUNX2、ALP 作为检测指标主要有以下原因:COL1 是骨组织矿化过程中特异的胶原类型,通过对COL1 标志物检测可以作为成骨细胞鉴定依据;RUNX2 作为鉴定成骨分化的早期标志,同时能够上调MSCs 向成骨细胞分化的能力,是骨形成中重要的调节因子[7];ALP 是成骨过程中可以作为检测成骨细胞生长的标志物,ALP 含量的下降会导致骨矿化不良[8]。目前MSCs 已成为近年来研究的热点,但现阶段E2和VK2对体外培养hUC-MSCs 的相关研究较少。本研究首先成功提取脐带间充质干细胞,细胞表面抗原检测CD73 阳性表达,CD34、CD45、HLA-DR 阴性表达,并成功将其诱导为成骨细胞、脂肪样细胞和神经样细胞,以上结果均符合国际细胞疗法学会制定标准。
本研究结果显示,E2组、VK2组与control 组相比,COL1、RUNX2 表达量上调,ALP 活性增加(P<0.05),说明E2、VK2能够促进hUC-MSCs 向成骨细胞分化。E2促进hUC-MSCs 成骨分化可能与E2受体(estrogen receptor, ER)结合引起ER 相关信号通路的活化有关,E2也可以通过旁分泌、直接调节以及诱导细胞凋亡等方式改变成骨细胞与破骨细胞活性[9]。骨代谢过程中雌激素通过调节转化生长因子-β、肿瘤坏死因子-α、白介素-6、白介素-7 等起到维持成骨细胞和破骨细胞的平衡,调控破骨细胞及成骨细胞受体的结合抑制骨吸收,在抗骨质疏松治疗过程中起到重要作用[10-11]。高巳东等[12]研究通过分离提取间充质干细胞,将实验分为正常组、E2组、E2+淫羊藿苷组,ELISA 检测E2及6、12、18 d 时ALP 的活性。结果显示正常组、E2组、E2+淫羊藿苷组6、12、18 d 时的ALP 的活性分别为(174.53±7.84)、(227.87±20.71)、(212.31±8.42);(218.04±8.72)、(276.54±14.75)、(273.34±13.22);(233.60±10.29)、(289.17±10.99)、(288.63±7.18),差异有统计学意义(P<0.05)。该研究结果与本研究ALP 相对表达量相近,结果均证明E2可以促进MSCs 的成骨分化和成骨基因的表达。维生素K2可以通过下调细胞凋亡因子Fas 和Bax 的表达和上调GDF-15 和STC2 的基因表达活化人成骨细胞细胞活性,阻止成骨细胞凋亡、维持成骨细胞数量及活性[13]。VK2可促进骨髓间充质干细胞和成骨前体细胞ALP、骨钙素的表达,从而促进骨形成[14-15]。本研究结果显示VK2和E2能够通过上调COL1、RUNX2、ALP 的表达从而促进成骨分化。E2+VK2组与E2或VK2组相比,相关成骨基因COL1、RUNX2、ALP 表达量明显增加(P<0.05),说明联合用药更能促进人脐带间充质干细胞向成骨方向的分化。
综上所述,本实验证实E2和VK2联合用药能够显著促进成骨细胞的分化,目前尚未检索到两种药物联合应用的文献报道,具体信号通路及分子机制有待进一步的研究。通过本研究证实E2和VK2两种药物能够协同促进hUC-MSCs 的成骨分化,从而为临床治疗骨科疾病提供理论依据,为临床用药提供指导。

