超声冻融-复合酶解制备小麦多孔淀粉及其吸附特性
李彩妮,安凤平,2,石 娟,孙帅豪,宋洪波,2
(1.福建农林大学 食品科学学院,福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福州 350002)
0 引言
多孔淀粉是一种新型的改性淀粉[1],具有较高的吸附性能和良好的释放性能,在食品、药品等领域有着应用潜力[2]。复合酶(α-淀粉酶和葡萄糖淀粉酶)是制备多孔淀粉的常用方法,该法制得的多孔淀粉比表面积和孔隙率较大[3]。有研究表明,超声的空化作用导致淀粉内部产生孔隙[4],酶解前对淀粉进行超声预处理,增加了淀粉微孔的数量和比例[5]。经过微波超声波辅助复合酶解得到的木薯多孔淀粉,其吸附性能较单纯酶解制得多孔淀粉更好[6]。冻融可使淀粉颗粒产生小孔从而增加淀粉对酶水解的敏感性,因此冻融技术结合酶解有利于制备吸附性能更好的多孔淀粉[7]。
小麦是我国的主要农作物之一[8]。国内外对小麦多孔淀粉的研究较少,且制备方法较单一,制备的多孔淀粉吸附性能较差[9]。因此,本文以小麦淀粉为原料,对比研究超声冻融、复合酶处理以及超声冻融-复合酶解淀粉的理化性质和吸附性能,为超声冻融-复合酶解制备小麦多孔淀粉的应用提供依据。
1 材料与方法
1.1 材料与试剂
小麦淀粉、α-淀粉酶(2×104U/mL)、糖化酶(105U/mL),上海源叶生物有限公司;花生油,食品级,青岛嘉里花生油有限公司;亚甲基蓝(分析纯)、色谱级溴化钾,国药集团化学试剂有限公司;直链淀粉含量检测试剂盒(BC4260-50T/48S),索莱宝试剂公司。
1.2 主要仪器与设备
KQ2200DV 型数控超声波清洗器(昆山市超声仪器有限公司);TGL-16 型高速离心机(四川蜀克仪器有限公司);UV-1700 型紫外可见分光光度计[岛津仪器(苏州)有限公司];Nova Nano SEM230 型场发射扫描电子显微镜(捷克FEI CZECH REPUBLICS.R.O 公司);VERTEX70 型傅里叶变换红外光谱仪[布鲁克(北京)科技有限公司];Ultima IV 型X-射线衍射仪(日本Rigaku公司);asap2460 型比表面积及孔隙度分析仪(美国麦克公司)。
1.3 试验方法
1.3.1 超声冻融小麦淀粉的制备
参考KEERATIBURANA 等[10]的方法并稍作修改。将小麦淀粉(NS)与蒸馏水按质量比1:2混合搅拌3 h,-25 ℃冷冻6 h;以频率为40 kHz、功率为500 W 于室温超声处理1 h;干燥后粉碎并过100 目筛得到超声冻融淀粉(US-IR)。
1.3.2 小麦多孔淀粉的制备
参考ZHAO 等[11]的方法并在预试验基础上有所改动。分别将NS,US-IR 与乙酸缓冲溶液(0.5 mol/L,pH=4.6)按料液比1:3 混合均匀形成淀粉乳,55 ℃恒温水浴15 min;加入复合物酶溶液(α-淀粉酶和糖化酶比为1:4,U:U),55 ℃恒温水浴振荡24 h;加入NaOH 调节pH 值至11 结束水解反应;加入2 倍无水乙醇使酶失活,用无水乙醇和蒸馏水反复洗涤3 次,抽滤后55 ℃烘干12 h;粉碎并过100 目筛,分别得到复合酶解多孔淀粉(ES)和超声冻融-复合酶解多孔淀粉(CS)。
1.3.3 颗粒形态分析
取适量样品均匀洒在导电胶表面,用洗耳球吹去多余淀粉并在真空条件下喷金,采用扫描电镜以6 kV 加速电压观察样品形貌。
1.3.4 低温氮吸附测定
称取200 mg 样品,置于比表面积及孔隙度分析仪中于45 ℃脱气24 h,在77.35 K 的液氮温度下测定淀粉样品的氮气吸附-脱附等温线。采用仪器自带分析软件,分别以BET(Brunauer-Emmett-Teller) 和BJH(Barrett-Joyner-Halenda)法计算淀粉样品的比表面积和总孔体积。
1.3.5 直链淀粉含量测定
采用试剂盒测定直链淀粉含量,操作步骤和计算公式参照试剂盒说明书。
1.3.6 X 射线衍射分析
采用X 射线衍射仪测定样品的晶体结构。测定条件:40 mA,40 kV,Cu-Kα 射线,扫描速率为2(°)/min,衍射角(2 θ)范围为5~35°。使用MDI Jade 6.0 软件计算淀粉的相对结晶度[12]。
1.3.7 傅里叶红外光谱分析
参考蔡文琪等[13]的方法并稍作修改。将样品和溴化钾研磨10 min,放入压模中,抽真空压片。仪器测定参数:扫描波数范围在400~4 000 cm-1,分辨率为0.8 cm-1,扫描次数为32 次。
1.3.8 溶解度和膨胀力测定
参考赵安琪[14]的方法并稍作修改。将干燥的离心管和培养皿称重,分别记为A1(g)和B1(g);将0.4 g 样品和20 mL 蒸馏水于离心管中混合均匀,80 ℃恒温水浴振荡30 min,5 500 r/min离心作用15 min;取上清液倒入培养皿中,称得离心管与沉淀物的质量为A2(g),将装有上清液的培养皿105 ℃干燥至恒重,记为B2(g)。淀粉样品的溶解度(SOL)和膨胀力(SP)分别按下式计算:
1.3.9 吸附性测定
(1)亚甲基蓝吸附量的测定
取0.5 g 淀粉样品和30 mL 亚甲基蓝溶液(0.5 g/L)混合,25 ℃水浴振荡器吸附2 h,倒入离心管中,以5 500 r/min 离心作用10 min,计算上层亚甲基蓝溶液的体积;取1 mL 稀释100 倍后的溶液于紫外可见分光光度计665 nm 波长处测定吸光值,根据预先绘制的亚甲基蓝标准曲线计算游离亚甲基蓝浓度。亚甲基蓝吸附量(Qe)按下式计算:
式中 C0,C1—— 亚甲基蓝初浓度和游离亚甲基蓝浓度,mg/L;
V0,V1—— 加入的甲基蓝体积和上层亚甲基蓝溶液的体积,L;
m——淀粉质量,g。
(2)吸油率和吸水率的测定
将0.5 g 样品和5 mL 蒸馏水或花生油于已知质量W0(g)的离心管中涡旋5 min,室温静置30 min;以5 500 r/min 离心作用10 min,除去淀粉表面水(或油)后得到沉淀物,称重记为W1(g)。则淀粉样品的吸油率/吸水率(AC)计算如下:
1.4 数据分析
试验重复3 次,采用Microsoft Excel 2003 和DPS 18.10 对数据进行处理和方差分析,结果以平均值±标准偏差表示;采用Duncan 法进行检验,p<0.05 为显著水平;使用Origin 2018 绘图。
2 结果与分析
2.1 颗粒形态分析
如图1 所示,图A 表明NS为球状或椭状的颗粒,表面较光滑。图B 所示的US-IR 表面出现侵蚀和凹陷,说明经超声冻融处理的淀粉表面受到一定程度破坏,但颗粒完整性未被破坏,这是由于淀粉颗粒中的水分经冷冻形成冰晶过程中产生的膨胀作用,以及超声波强烈的振荡和空穴效应等对淀粉颗粒表面产生了一定侵蚀作用[15]。图C 所示的ES 表面侵蚀明显,沿赤道方向形成孔洞并产生一些破碎淀粉,此结果与YAIZA 等[16]采用糖化酶处理小麦淀粉的现象相似。图D 显示CS 呈现出空心状结构,表面分布着明显的孔,说明超声冻融处理造成淀粉表面被侵蚀,成为复合酶水解的薄弱点,促进复合酶水解,因此形成了多孔淀粉。

图1 不同淀粉的扫描电子显微镜图(×2 000 和×10 000)Fig.1 Scanning electron micrographs of different starch samples(×2 000 and ×10 000)
2.2 低温氮吸附分析
不同淀粉样品的氮气吸附-脱附等温线如图2 所示。
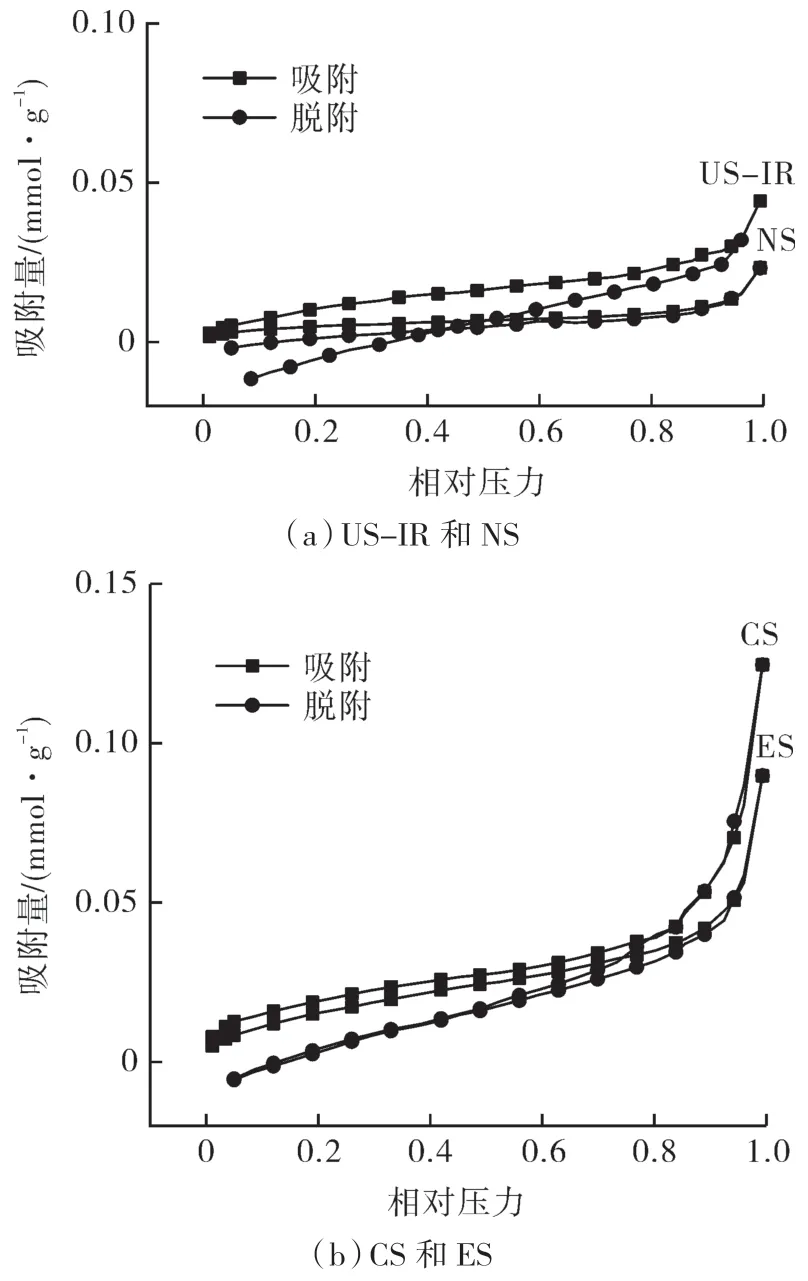
图2 不同淀粉样品的氮气吸附-脱附等温线Fig.2 Nitrogen adsorption-desorption isotherms of different starch samples
根据国际纯粹与应用化学联合会(IUPAC)分类方法可知,4 个样品的氮气吸附等温线为Ⅱ型,吸附和脱附等温线均不重合,滞后环为H3型,这是多层吸附的介孔材料的典型特征[17]。US-IR 的吸附等温线在NS 上方,说明超声冻融提高淀粉对氮气的吸附量。与NS 和US-IR 相比,ES 和CS 在相对压力接近1 时急剧升高,是因为发生毛细凝聚现象[18]。
各样品的比表面积及总孔体积如图3 所示。NS,US-IR,ES 和CS 的比表面积和总孔体积均依次显著增大(p<0.05)。特别是CS 的比表面积和总孔体积值均最大,这是因为超声冻融处理使淀粉表面积增大,增加复合酶与淀粉的接触面积,促进复合酶对淀粉的水解。这与图1 所示的各样品的外观形貌特征具有一致性。
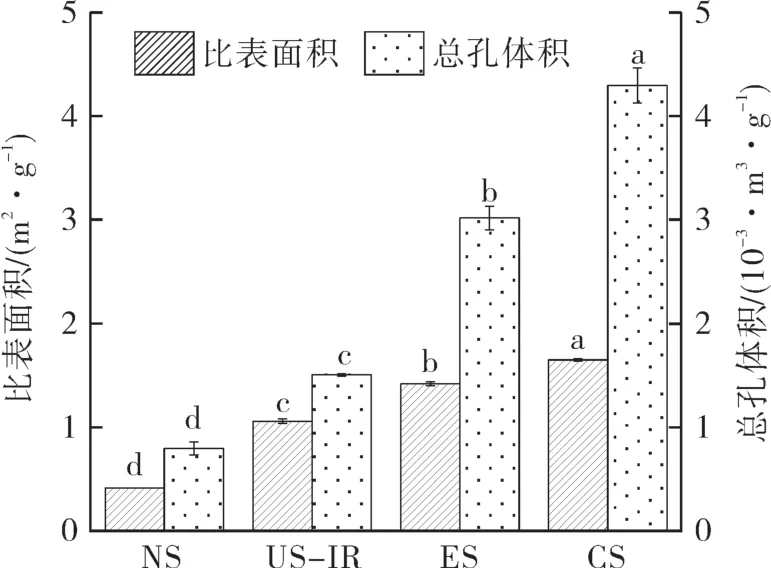
图3 不同淀粉样品的比表面积和总孔体积Fig.3 Specific surface area and total pore volume of different starch samples
2.3 直链淀粉含量和X 射线衍射分析
淀粉样品的X 射线衍射图谱见图4。
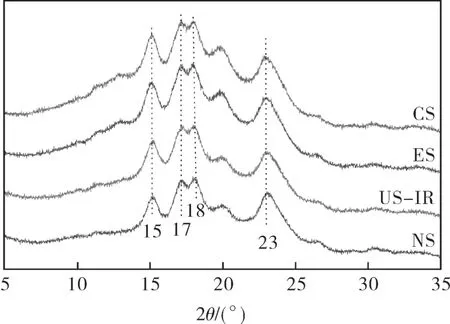
图4 不同淀粉样品的X 射线衍射图Fig.4 XRD of different starch samples
NS 在15,17,18,23°(2 θ)处出现尖峰衍射特征峰,这是A 型晶型的典型特征,与ZHANG 等和CHI 等的报道一致[19-20]。4 种淀粉呈现相似的X 射线衍射图谱,说明超声冻融、复合酶解和超声冻融-复合酶解均未改变小麦淀粉的晶型。与NS 和US-IR 相比,ES 和CS 在大约20°(2 θ)处的衍射峰更尖锐,是因为复合酶解增加了直链淀粉的相对含量,从而促进直链淀粉与脂质发生反应形成直链淀粉-脂质复合物所致[21-22]。
淀粉样品的直链淀粉含量以及相对结晶度如表1 所示。与NS 的直链淀粉含量为23.25%相比,US-IR 的含量显著降低(p<0.05),一方面可能是由于超声波对淀粉的无定形区部分降解;另一方面是冷冻过程中冰晶生长导致直链淀粉从无定形区部分渗出造成。相反,ES 中的直链淀粉含量明显增加(p<0.05),可能是由于支链淀粉的非还原性末端更多,有助于酶水解成更多的直链淀粉。CS 的直链淀粉含量为21.73%,明显低于ES(p<0.05),可能是超声冻融促进复合酶对淀粉无定形区的水解,并在洗脱过程中除去了部分直链淀粉。

表1 不同淀粉样品的直链淀粉含量和相对结晶度Tab.1 Amylose content and relative crystallinity of different starch samples %
US-IR 较NS 的相对结晶度显著降低(p<0.05),可能是因为冷冻过程中冰晶生长的膨胀作用以及超声波的振荡作用,一定程度破坏了淀粉颗粒结晶结构的有序性。ES 的相对结晶度进一步显著降低,是因为酶解先作用于淀粉颗粒的无定形区,再作用于亚结晶区和结晶区。NS 的支链淀粉与直链淀粉相比,具有更多的非还原性末端[23]。CS 的相对结晶度高于ES,是因为超声冻融增加了酶对淀粉无定形区域的可及性,复合酶优先在US-IR 的无定形区域进行水解。
2.4 傅里叶红外光谱分析
淀粉短程有序又被称为双螺旋有序,与淀粉的相对结晶度相关[24]。1 047 cm-1处的吸光度是淀粉结晶区的结构特征,1 022 cm-1处的吸光度与无定形区有关。一般来说,淀粉的红外光谱图在1 047 cm-1和1 022 cm-1处吸光度的比值,一定程度上表示淀粉的相对结晶度[25]。995 cm-1处的吸收峰与C-6 处羟基的氢键有关[26],1 022/955 cm-1的比值与晶体内部双螺旋结构有关[27],该比值越小,淀粉的双螺旋分子越有序。
根据4 个样品的红外光谱图,可得1 047/1 022 cm-1和1 022/995 cm-1比值,列于表2 中。其中,NS,US-IR,CS 的1 047/1 022 cm-1比值分别为0.88,0.87,0.86,说明淀粉经过超声冻融或复合酶解后,双螺旋有序结构遭到破坏,相对结晶度降低。CS 的1 047/1 022 cm-1比值显著大于ES(p<0.05),是因为经超声冻融处理后,复合酶可以进一步水解淀粉的无定形区域,从而导致结晶区与无定形区的比值增大,这与X 衍射结果的变化趋势一致。NS,US-IR,ES,CS 的1 022/995 cm-1比值依次增加(p<0.05),说明超声冻融和复合酶解均降低淀粉双螺旋结构分子的有序性,其中超声冻融结合复合酶水解的作用最明显。

表2 不同淀粉样品的红外特征比值Tab.2 Infrared characteristic ratios of different starch samples
2.5 溶解度和膨胀力分析
从表3 可以看出,US-IR 的溶解度和膨胀力较NS 显著增大(p<0.05),是因为淀粉经超声冻融处理,分子有序结构被破坏和游离羟基的短链含量增加所导致[28]。SUJKA 等[29]认为,淀粉晶体结构的破坏、水分子与直链淀粉或支链淀粉的游离羟基结合均可造成淀粉的溶胀性增加。NS和US-IR 经复合酶水解后,所制备ES 和CS 的溶解度和膨胀力均显著增加(p<0.05),特别是CS的溶解度和膨胀力显著大于ES,是因为超声冻融增加了酶对淀粉无定形区域的可及性,有助于水分子进入淀粉的无定形区。此外,CS 的比表面积和总孔体积大于ES,因此CS 具有更好的溶胀性。

表3 不同淀粉样品的溶解度和膨胀力Tab.3 Solubility and swelling power of different starch samples
2.6 吸附性
不同淀粉的亚甲基蓝吸附量、吸油率和吸水率如图5 所示。与NS 相比,US-IR 的亚甲基蓝吸附量和吸水率显著增大(p<0.05),是由于超声波处理对淀粉表层侵蚀,且使淀粉颗粒结构变得松散,暴露更多的亲水基团[30]。然而,US-IR 的吸油率反而显著降低(p<0.05),是因为超声冻融处理减少淀粉中直链淀粉的含量所致。王玫玫[28]认为,直链淀粉分子与极性脂肪物质可以形成螺旋结构,直链淀粉的减少降低淀粉对油的结合能力。ES 和CS 的亚甲基蓝吸附量、吸油率和吸水率较NS 和US-IR 有明显的提高(p<0.05),特别是CS 达到最大值,这得益于超声冻融处理结合复合酶水解形成丰富的孔,提高溶胀能力,以及降低双螺旋结构的有序性。

图5 不同淀粉样品的吸附性Fig.5 Adsorption capacities of different starch samples
3 结语
对比研究超声冻融、复合酶(α-淀粉酶和糖化酶)处理以及超声冻融-复合酶水解小麦淀粉的理化性质和吸附性能。小麦淀粉为A 型淀粉,超声冻融、复合酶解和超声冻融-复合酶解均未改变小麦淀粉的晶型;经超声冻融处理,淀粉表面被侵蚀且分子有序性降低,复合酶水解则可形成少量孔洞的多孔淀粉,因此超声冻融结合复合酶水解制得的多孔淀粉的比表面积和总孔体积最大,淀粉的相对结晶度较低、双螺旋分子结构的有序性最低,使得溶胀性和吸附性显著增大。

