基于Ecopath模型的长山列岛邻近海域褐牙鲆增殖生态容量研究*
徐晓卉, 尹 洁, 刘淑德, 纪毓鹏,3, 薛 莹,3,4, 任一平,3,4, 徐宾铎,3,4**
(1. 中国海洋大学水产学院, 山东 青岛 266003; 2. 山东省渔业发展和资源养护总站, 山东 烟台 264003; 3. 青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237; 4. 海州湾渔业生态系统教育部野外科学观测研究站, 山东 青岛 266003)
长山列岛邻近海域地处黄渤海交汇处,同时受到黄海、渤海的影响,具有特殊的水文特征、地貌特征以及生态群落。由于高强度捕捞以及海洋污染等多种因素的影响,导致邻近海域许多重要经济种类资源量下降、个体变小[1]。褐牙鲆(Paralichthysolivaceus)隶属于鲽形目(Pleuronectiformes)牙鲆科(Paralichthyidae)牙鲆属(Paralichthys)[2],是我国重要的底栖海洋经济鱼类之一,也是长山列岛邻近海域重要增殖种类之一。在二十世纪五六十年代,褐牙鲆渔获量曾达上千吨,但长期高强度捕捞,导致该种资源量迅速下降[3]。
渔业资源增殖放流对于海洋生态系统渔业资源养护和生态环境修复具有重要作用,国内外学者针对其已开展了大量的理论和实践研究。增殖放流食物链中营养级较高的渔业生物种类可有效利用低营养级生物从而改善海域基础生产力,优化食物链结构[4]。从1986年起,山东省开始在沿岸海域增殖放流褐牙鲆,2005年起开展了规模性增殖放流[4]。世界上许多国家都在开展增殖放流活动以期实现相应的经济和社会目标[5],然而,由于对放流水域的生态结构、食物网构成及其营养动力状况等缺乏深入了解,加上增殖放流体系不完善,当前增殖放流达到预期效果的案例较少[6],探究增殖种类最佳放流策略对增殖放流的成功与否具有重要意义。最佳放流策略包括放流时间、放流尺寸、放流天气以及放流数量等,增殖容量研究是研究放流数量的前提[7]。
Ecopath模型是研究水域生态系统的重要工具,已广泛应用于生态容量评估[8]。在该模型中,生态系统是由若干功能组组成,这些功能组包括研究水域生态系统中从碎屑到顶级捕食者的所有生物组成部分[8-9],各功能组之间相互联系,基本包括该生态系统能量循环的全部过程。国内学者利用该模型对多个河口、海湾、湖泊等生态系统能量流动及生态系统生态容量进行了评估[10-13]。
本文根据 2016—2017 年长山列岛邻近海域的渔业资源调查数据,通过构建长山列岛邻近海域Ecopath 模型,分析了该海域生态系统能量流动特征及营养相互关系,评估了长山列岛邻近海域增殖种褐牙鲆的增殖生态容量,旨在为确定该海域合理增殖放流数量提供参考依据。
1 材料与方法
1.1 研究海域
本文渔业资源数据来源于2016年10月、2017年1、5、8月在长山列岛邻近海域开展的渔业资源季度调查。调查海域范围为37.5°N—38.5°N,119.8°E—121.8°E,共设置44个站位(见图1)。调查船为220 kW单船底拖网渔船,设定拖网时间为1 h,拖速为3 kn,拖网网具网口高约7.5 m,网口宽约15 m。
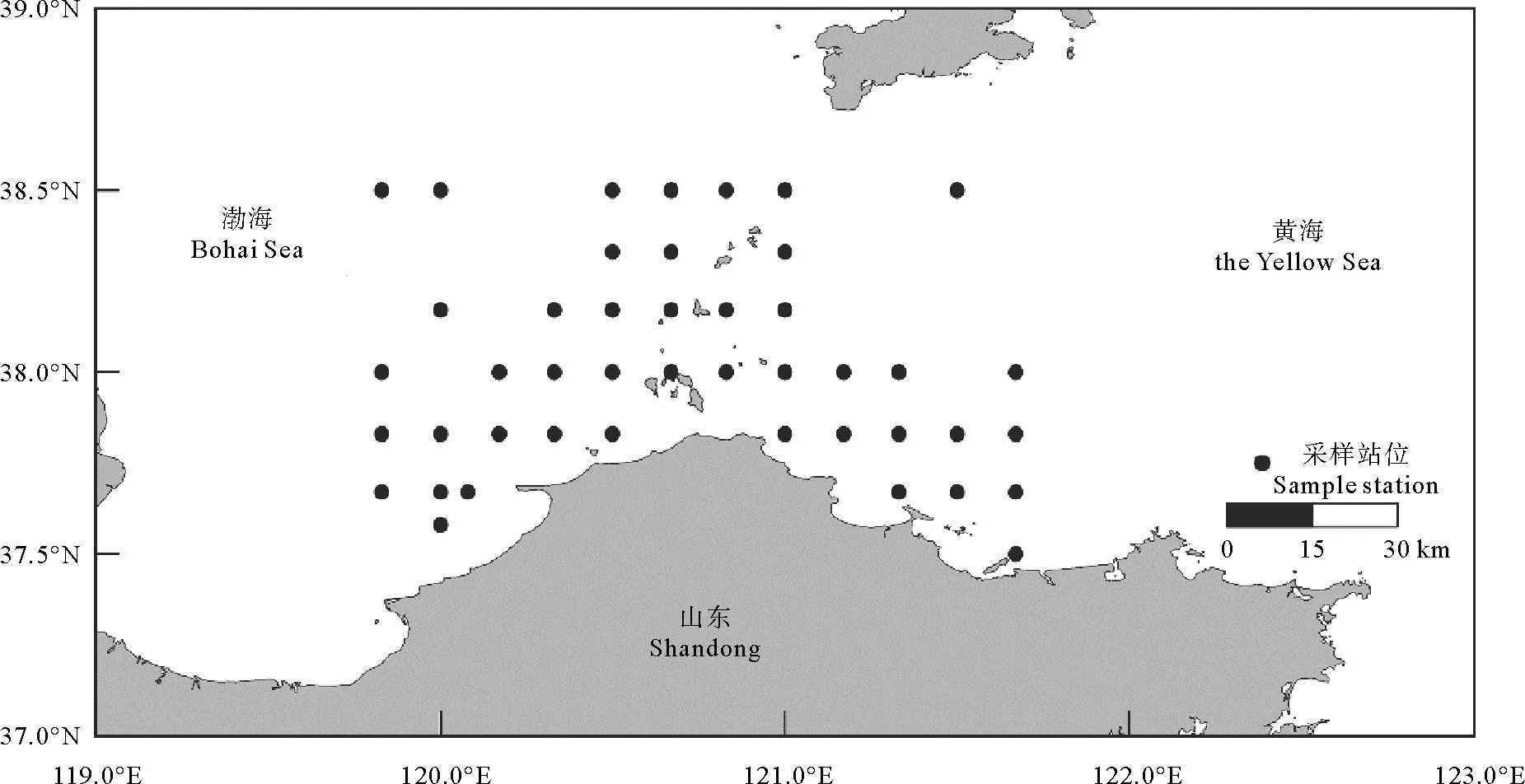
图1 长山列岛邻近海域底拖网调查站位
1.2 Ecopath模型
本文应用Ecopath模型来分析长山列岛邻近海域生态系统的能量流动特征。Ecopath模型以一组线性方程来描述特定时间内生态系统的能量输入与输出平衡,公式如下[14]:
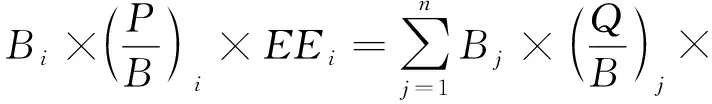
(1)
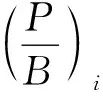
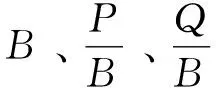
1.3 功能组划分
根据研究海域各生物种类摄食习性,同时考虑栖息生境等特征,将该海域生态系统划分为29个功能组,包括该海域各栖息水层的种群、褐牙鲆以及其敌害生物和饵料生物种类以及碎屑、浮游植物等,基本涵盖了该生态系统全部的能量流动过程。本研究中将增殖放流对象褐牙鲆、其主要饵料生物种类(如鳀、黄鲫、虾虎鱼类、口虾蛄等)和捕食者(如许氏平鲉、大泷六线鱼、鲬等)分别作为单独的功能组(见表1)。

表1 长山列岛邻近海域生态系统模型功能组的定义
1.4 数据来源及模型调试
各功能组中棘皮动物、软体动物、多毛类、其他小型底栖生物、浮游动物、浮游植物和碎屑的生物量B参考文献[16-17]中邻近海域的值,其余功能组生物量B主要依据2016—2017年长山列岛邻近海域底拖网调查数据(见图1);P/B和Q/B参考文献[16-21]或相似生态系统的Ecopath模型(见表2)。各功能组的食物组成矩阵数据来自样本胃含物分析,部分种类参考已有的食性研究结果[22-25]。生态营养效率EE值由模型得出。生物量用扫海面积法进行计算,公式为[26]
ρ=C/(aq)。
(2)
式中:ρ为资源密度;C为单位时间平均拖网渔获量;a为网具单位时间扫海面积;q为各种类的捕获率。
Ecopath模型平衡的基本条件是使EE≤1。在输入原始数据后会有功能组EE>1的情况,说明此时该生态系统能量输入与输出未保持平衡,需调整EE>1的功能组的摄食矩阵组成等参数。重复调试,直至所有功能组的EE值均在0~1之间,从而获得合理的参数值[27]。通过Pedigree指数对模型数据质量进行评估[27]。Pedigree指数值介于0~1.0之间,1.0表明使用的数据是通过高精度采样获得;0代表使用的数据是参考其他邻近海域或相关文献等[9]。
1.5 营养级计算
Ecopath模型中的各功能组营养级(Trophic level, TL)计算公式如下[28]:
TLj=1+∑DCij×TLi。
(3)
式中:TLj表示功能组j的营养级;TLi表示饵料生物功能组i的营养级;DCij表示饵料生物功能组i在功能组j所摄食的饵料生物中占的比例。浮游植物和有机碎屑的营养级默认为1。
1.6 混合营养效应分析和关键功能组
应用混合营养效应分析(Mixed trophic impact analysis, MTI)研究各功能组之间的关系以及捕捞对各功能组的影响。其取值介于-1~1,取正值表示相关功能组之间为正效应,取负值表示相关功能组之间为负效应[29]。
基于混合营养效应分析判定关键功能组,根据关键功能组对应较高的总体效应值(接近1)和较高的关键指数值(接近或大于0)原则确定关键功能组,关键指数计算公式为[30]
KSi=log(εi(1-pi))。
(4)
式中:KSi是功能组i的关键指数;pi是功能组在食物网总生物量中所占的比例;εi是功能组i在生态系统中的总影响,其计算公式如下[30]:
(5)
式中mij是功能组i对功能组j的混合营养效应值。
1.7 增殖生态容量确定
在模型平衡后,通过不断增加放流种类的生物量,观察各功能组的变化,若某一功能组EE值超过1,则模型平衡被打破,此时放流种的生物量为它的增殖生态容量[31-32]。
2 结果
2.1 模型基本参数输出
表2为长山列岛邻近海域生态系统Ecopath模型各功能组的基本参数。代表评价模型总体质量的Pedigree指数值为0.414。由表2可知,长山列岛邻近海域生态系统各功能组的营养级范围为1.00~4.57,其中褐牙鲆的营养级为4.57,在长山列岛邻近海域范围内属于高营养级生物。所有功能组EE值在0.19~0.94之间,其中褐牙鲆的生态营养效率为0.85。长山列岛邻近海域生态系统食物网如图2所示,长山列岛邻近海域生态系统能量流动以碎屑食物链和牧食食物链为基础,该海域生态系统的能量主要来源于碎屑和浮游植物。
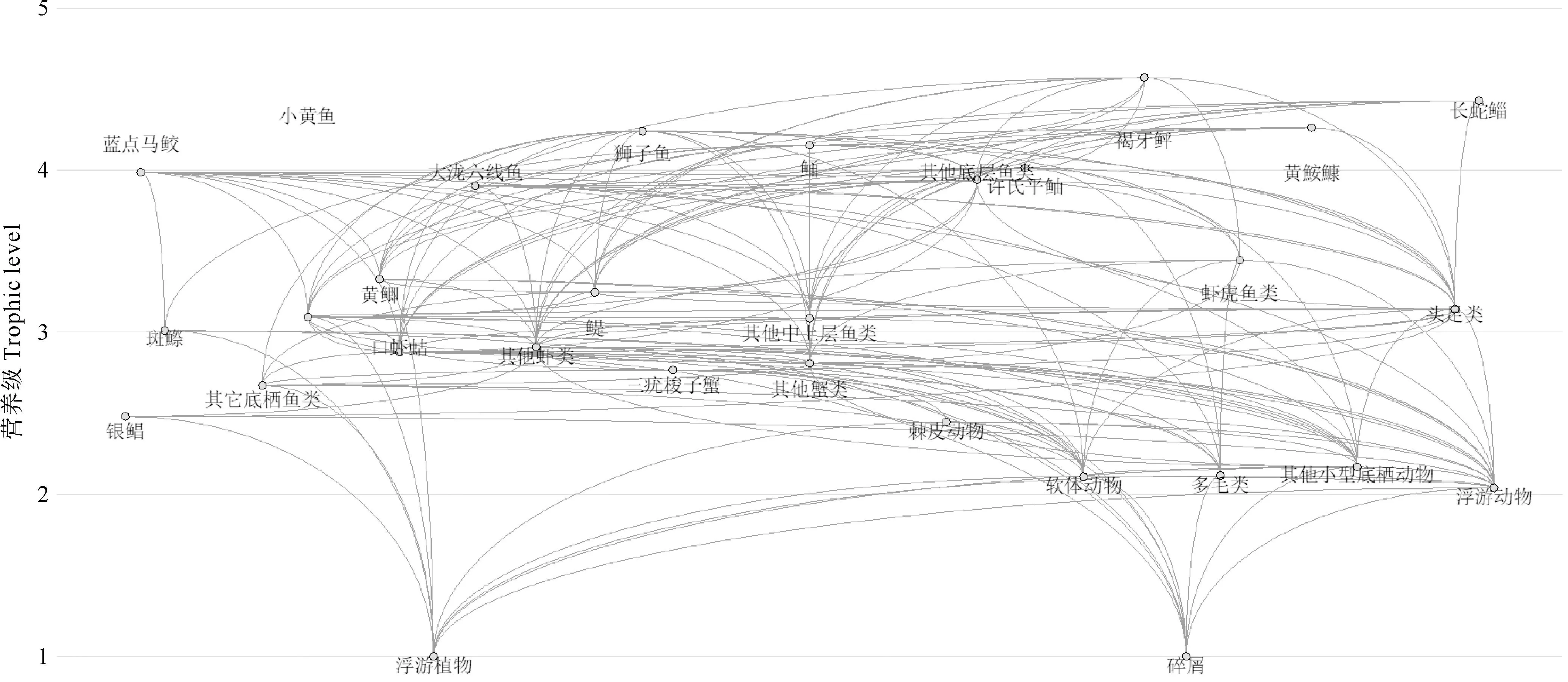
图2 长山列岛邻近海域生态系统食物网
2.2 功能组间的营养关系和关键功能组
长山列岛邻近海域生态系统各功能组按关键指数值递减的顺序排列(见图3),长山列岛邻近海域关键功能组为软体动物。此外,关键指数和总体效应值较高的还有其他小型底栖动物和浮游动物。
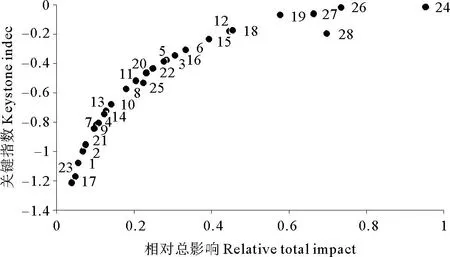
(图中数字代表功能组序号,与表1相同。 The numbers in the figure represent the serial numbers of function groups, which are the same as those in table 1.)
该生态系统中各功能组间营养关系通过混合营养效应来分析(见图4)。结果表明,浮游植物和有机碎屑作为低营养级的饵料生物,对大多数功能组产生正影响。各功能群的生物量增加,会使它们对于饵料生物的竞争程度更加剧烈,从而限制了自身生物量的进一步增加。褐牙鲆生物量的增加对褐牙鲆、鳀产生显著负影响,影响值分别为-0.241、-0.119;而鳀、其他底层鱼类生物量的增加对褐牙鲆产生正影响,影响值分别为0.185、0.162;大泷六线鱼以及褐牙鲆生物量的增加对褐牙鲆产生负效应,影响值分别为-0.119、-0.241。软体动物和浮游动物受到浮游植物和捕食者的双重影响,在能量传递中发挥重要作用。捕捞对大部分渔业生物功能组有明显负影响。
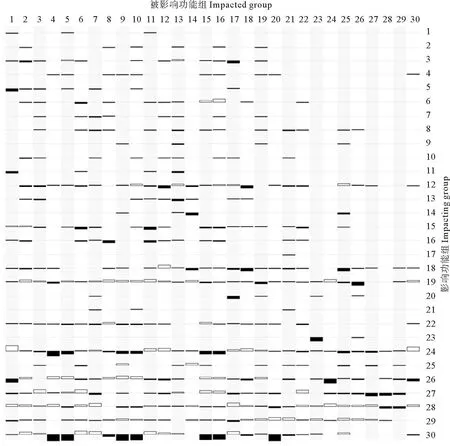
(1:斑鰶Konosirus punctatus; 2:黄鲫Setipinna taty; 3:鳀Engraulis japonicus; 4:银鲳Pampus argenteus; 5:蓝点马鲛Scomberomorus niphonius; 6:其他中上层鱼类Other pelagic fishes; 7:小黄鱼Larimichthys polyactis; 8:许氏平鲉Sebastes schlegelii; 9:大泷六线鱼Hexagrammos otakii; 10:细纹狮子鱼Liparis tanakai; 11:鲬Platycephalus indicus; 12:其他底层鱼类Other demersal fishes; 13:褐牙鲆Paralichthys olivaceus; 14:虾虎鱼类Gobiidae; 15:黄鮟鱇Lophius litulon; 16:长蛇鲻Saurida elongate; 17:其他底栖鱼类Other benthic fishes; 18:口虾蛄Oratosquilla oratoria; 19:其他虾类Other shrimp; 20:三疣梭子蟹Portunus trituberculatus; 21:其他蟹类Other crabs; 22:头足类Cephalopods; 23:棘皮动物Echinoderms; 24:软体动物Molluscs; 25:多毛类Polychaetes; 26:其他小型底栖动物Other meiobenthos; 27:浮游动物Zooplankton; 28:浮游植物Phytoplankton; 29:碎屑Detritus;30:拖网 Fleets。白色表示正影响,黑色表示负影响,色块大小表示影响程度的强弱。 White indicates positive influence, black indicates negative impact, the color block size indicates the strength of the influence degree.)
2.3 增殖容量评估
在调查期间褐牙鲆生物量为0.009 24 t·km-2。褐牙鲆属于营养级较高的捕食者,其生物量的增加必会对较低营养级的饵料生物及其竞争者产生消极影响。当褐牙鲆生物量扩容1.55倍,生物量达0.014 3 t·km-2时,模型仍能保持平衡,生物量继续增大,其饵料生物鳀的EE值开始大于1,模型失去平衡。因此,长山列岛邻近海域生态系统能够支撑的褐牙鲆的生态容量为0.014 3 t·km-2(见表3)。

表3 长山列岛邻近海域褐牙鲆生物量扩容后的Ecopath模型变动情况
2.4 生态系统总体特征
褐牙鲆增殖前后长山列岛邻近海域生态系统能量流动、稳定性等基本特征如表4所示。大部分特征参数变化不大或基本相同,当褐牙鲆达到其生态容量时,该海域系统总流量、总生产量、总生物量等均变化不大,来自初级生产者的能量流的平均转换效率由6.28%增加至6.35%、碎屑能量流的平均转换效率6.11%增加至6.17%,总能量转换效率6.23%增加至6.29%。

表4 褐牙鲆增殖前后长山列岛邻近海域生态系统的总体特征
3 讨论
本文通过建立长山列岛邻近海域Ecopath模型,分析了长山列岛邻近海域生态系统的能量流动过程、相关关系以及系统总体特征。该系统的Pedigree 指数为0.414,Morissette等[33]对其他150个不同的生态系统进行评估,Pedigree 指数介于0.164~0.676之间,表明构建的该海域生态系统Ecopath模型处于较合理的范围。在生态系统发育初期,生产量较大,此时TPP/TR>1,随着系统发育,逐渐趋于成熟,TPP/TR接近1,此时TPP/B较低[34]。长山列岛邻近海域TPP/TR为1.47,高于1,TPP/TB为26.87,与莱州湾生态系统TPP/TR值(1.53)、 TPP/TB值(24.54)相近[17]。作为反映生态系统内部连接程度的指标,连接指数CI和系统杂食指数SOI越大表明其联系越密切,生态系统就越稳定。长山列岛邻近海域CI值和SOI值分别为0.24和0.19,远小于1,与林群等[17]对莱州湾生态系统的研究(0.29和0.17)相近,较小于1998年长山列岛邻近海域及北黄海生态系统的0.43和0.22[35]。循环指数FCI表征生态系统中营养物质再循环的比率,该生态系统中FCI值为6.91%,较低于1998年长山列岛邻近海域及北黄海生态系统的9.44%[35]。由于历史上长期高强度捕捞、环境变化以及全球变暖等影响,使得该生态系统各营养级间联系不密切,抗干扰能力较弱,较多营养不能充分利用[16,36]。
褐牙鲆增殖生态容量为0.014 3 t·km-2,调查生物量为其生态容量的64.62%,该海域褐牙鲆的增殖潜力较小。究其原因,一方面,该增殖种同时受到上行效应以及下行效应控制。褐牙鲆食性广泛,主要以鱼类为主,甲壳类次之,主要摄食鳀、黄鲫、斑鰶、皮氏叫姑鱼、玉筋鱼、短吻红舌鳎和六丝钝尾虾虎鱼等鱼类,脊腹褐虾、鲜明鼓虾、日本鼓虾和口虾蛄等甲壳类以及日本枪乌贼等软体动物[37],随着褐牙鲆生物量的增加,将会摄食更多的饵料生物(如鳀),导致鳀在生态系统中的能量不足以满足其自身利用、被捕捞以及流向有机碎屑等部分,系统将失去平衡。此外,幼体褐牙鲆也会被大泷六线鱼以及成体褐牙鲆摄食[38]。另一方面,本系统的总能量转换效率仅为6.23%,显著低于10%的林德曼效率[39],低营养级之间能量转换效率过低,大量初级生产力和次级生产力富余,无法进入高营养级,原因可能是高营养级生物量远小于低营养级,有一部分初级生产力和次级生产力无法被利用。放流褐牙鲆至增殖容量时,该海域能量转化效率略有提升。此外,对褐牙鲆进行增殖放流,褐牙鲆生物量增大,其主要饵料生物鳀、虾虎鱼类、口虾蛄和其他虾类等功能组生物量下降[40]。因此,可能进一步引起虾虎鱼类、口虾蛄和其他虾类的饵料生物,即本文中的关键功能组软体动物、其他小型底栖动物在长山列岛邻近海域数量增加。关键功能组对食物网能量流动起到了重要作用,关键饵料生物种类数量的上升,对种间关系及整个食物网的稳定性有重要意义[41]。根据调查海域面积换算出年平均生物量为129.23 t,根据褐牙鲆的平均个体质量171 g换算约为75.57万尾,扣除现有群体约47.33万尾,若放流9 cm的苗种,根据其残存率2.05%[42],则需放流1 377.56万尾;若放流11 cm的苗种,根据其残存率3.38%[42],则需放流835.5万尾。
除了考虑放流数量,还应充分考虑放流种与生态系统中其他功能组的营养关系,在放流前首先应考虑提高营养级之间的传递效率。在该生态系统中,浮游生物、碎屑生物量较高,但其营养转换效率都较低,可以增加浮游生物食性的鱼类以及滤食性贝类来减少碎屑以及浮游生物的堆积,提高营养利用率,同时避免了富营养化[43]。此外,由于褐牙鲆生存最适底质类型为细砂底质,故放流时应选择在饵料生物丰富、敌害生物少的细砂底质上进行放流[38]。放流时间上,应以褐牙鲆最适生存温度为准。本研究充分考虑了褐牙鲆与其捕食者、饵料生物以及食物竞争者间的相关关系,同时考虑了增殖放流活动对整个生态系统的影响,对确定长山列岛邻近海域褐牙鲆的合理放流数量以及环境承载力提供了参考依据,有利于优化增殖放流策略、科学制定增殖放流规划。但本研究得出的增殖种类的生态容量仅为理论上限,实际增殖放流工作还要考虑生态效益、经济效益和社会效益,若放流活动同时包含多个种类,则还需要考虑放流种之间的相互关系。

