山茶油对H2O2诱导大鼠H9C2 心肌细胞氧化应激损伤的保护作用
晏 庆,郭 蓁,孙赛男,黎 婧,谭机永,黎 静
(广西医科大学生理教研室,广西 南宁 530021)
在全球范围内心血管疾病(cardio vascular disease, CVD)是一种潜伏期较长,发病较隐匿,且痊愈困难的疾病,威胁着人类的健康。[1]。随着我国社会逐步走向老龄化,心血管疾病占据死亡率的首位也变成了当今社会要面临的严峻问题之一[2]。氧化应激指细胞内活性氧过量产生或抗氧化剂耗尽,活性氧通过对脂质,DNA,蛋白质造成损害从而破坏细胞内的还原氧化失衡。多种心血管疾病的发生与氧化应激相关,例如动脉粥样硬化,充血性心力衰竭,缺血再灌注损伤,慢性缺血性心脏病,心律失常等[3]。过氧化氢(H2O2)是活性氧中的一员,作为一种信使分子,H2O2在新陈代谢中具有调节作用,同时它也是介导细胞氧化应激的重要分子[4]。使用H2O2诱导细胞建立氧化应激模型已在实验中得到广泛的应用。
山茶油在我国被广泛用作食用油,也被认为是辅助药物。山茶油具有广泛的生物活性,如抗炎、抗肿瘤、抗高血压,抗菌和对氧化应激的保护作用[5]。然而,关于山茶油对心肌细胞的作用却少有报道。本研究采用H9C2 心肌细胞细胞系建立体外模型,模拟H2O2诱导的氧化应激损伤,观察不同浓度山茶油对H2O2诱导的H9C2 心肌细胞氧化损伤的保护作用。
1 材料与方法
1.1 材料
H9C2 心肌细胞(普诺赛有限公司);3%H2O2(美国Sigma 公司);山茶油(陕西金康泰生物科技有限公司);二甲基亚砜(DMSO)(美国Sigma 公司);CCK8 试剂盒(新赛美生物科技有限公司)胎牛血清(美国 Gibco 公司);DMEM 高糖培养基(以色列 Biological Industries 公司);胰酶(以色列 Biological Industries 公司);PBS(索莱宝科技有限公司);青链霉素(以色列 Biological Industries 公司);细胞衰老β-半乳糖苷酶染色试剂盒(碧云天生物技术有限公司);BeyoClick™ EdU-594 细胞增殖检测试剂盒(碧云天生物技术有限公司);线粒体膜电位检测试剂盒(JC-1)(碧云天生物技术有限公司);LDH 检测试剂盒、MDA 检测试剂盒(索莱宝有限公司);SOD 检测试剂盒(南京建成有限公司)。
1.2 方法
1.2.1 细胞培养 使用含10%胎牛血清和1%青链霉素的DMEM 高糖培养基培养大鼠H9C2 心肌细胞,置于5%CO2、37 ℃的恒温培养箱中培养。定期换液,当细胞密度达80%时,使用胰酶消化传代。取对数生长期的细胞进行实验。
1.2.2 不同浓度山茶油的制备 将10 μL 山茶油溶解于90 μL DMSO 中,得到10%浓度的山茶油;取10 μL 10%浓度的山茶油溶解于90 μL DMSO 中,得到1%浓度的山茶油;按此方式依次梯度溶解,分别得到10%,1%,0.1%,0.01%浓度的山茶油,本研究选取0.01%,0.1%,1%三个浓度的山茶油进行实验。
1.2.3 细胞分组 将H9C2 细胞以每毫升4 万个的密度接种于六孔板,培养24 h 后,用1%,0.1%,0.01%三个浓度的山茶油预处理细胞24 h,然后用200 μmol/L H2O2溶液处理细胞24 h。将细胞分为:空白对照组;模型组:H2O2组;实验组:H2O2+0.01% 山 茶 油 组、H2O2+0.1% 山 茶 油 组、H2O2+1%山茶油组。每组设置 3 个复孔,实验重复 3 次。
1.3 检测指标
1.3.1 CCK-8 法检测细胞活力 将对数增长期H9C2 细胞以每孔4×103个的密度接种于九十六孔板,正常培养细胞24 h 后,分别加入0、50、100、200、400 μmol/L 浓度的H2O2溶液,正常组加入完全培养基。继续培养24 h 后,加入 10 μL CCK-8 溶液,37 ℃下继续孵育 2 h 后,在 450 nm 波长条件下检测各孔光密度(OD)值,计算细胞存活率。
1.3.2 β-半乳糖苷酶衰老染色实验 吸弃细胞培养液后加PBS 洗涤1 次,加入1 mL β-半乳糖苷酶染色固定液室温固定15 min。吸弃固定液后用PBS 洗涤细胞。每孔加入1 mL β-半乳糖苷酶染色工作液,放入37 ℃无CO2的恒温培养箱中孵育过夜。普通光学显微镜下观察细胞染色情况,衰老细胞呈绿色,未衰老细胞不着色。结果表示为衰老染色阳性细胞在总计数细胞中的百分比。
1.3.3 线粒体膜电位实验 吸弃细胞培养基,PBS洗涤一次,每孔加入1 mL 培养基和1 mL JC-1 染色工作液,充分混匀。37 ℃孵育20min。孵育结束后,用JC-1 染色缓冲液(1×)洗涤2 次。加入2 mL 细胞培养液,在荧光倒置显微镜下观察细胞。 使用Image J 软件分析线粒体膜电位荧光强度。以红/绿荧光强度的比值表示细胞去极化程度,比值高低代表膜电位高低。
1.3.4 EdU 细胞增殖染色实验 将EdU 工作液加入细胞中,孵育2 h 完成EdU 标记。使用Click Additive Solution 室温避光孵育30 min,孵育结束后洗涤细胞,使用1× Hoechst 33342 溶液室温避光孵育10 min。洗涤后在荧光倒置显微镜下观察细胞。通过Image J 软件计算细胞增殖率。
1.3.5 划痕实验 吸弃细胞培养液,用尺子和200 μL 枪头垂直于六孔板做划痕,每孔划三条等间距的竖线,划完后加PBS 洗涤细胞去除细胞碎屑,加入培养基。用普通光学显微镜拍照记录刚划痕时和24 h 后细胞的迁移情况。同样通过Image J 软件计算细胞迁移率。
1.3.6 LDH、MDA、SOD 水平检测 收集各组细胞和上清,按照 LDH、MDA、SOD 检测试剂盒说明分别检测上清中LDH、SOD 水平, 细胞中MDA水平。
1.4 统计学处理
采用SPSS 23.0 和GraphpadPrism 8.0 统计软件进行数据分析。实验数据均用均数±标准差(±s)表示,组间比较采用t检验或单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 H2O2氧化应激损伤模型的建立
建立H2O2诱导的H9C2 细胞损伤模型,模拟氧化应激状态时对心肌细胞损伤。结果显示,相比空白对照组,随着H2O2浓度的增加,H9C2 细胞的存活率 下 降,200 μmol/L H2O2处 理 细 胞24 h 后,H9C2细胞活力下降至对照组的52%左右(P<0.01),说明此浓度既能显著抑制H9C2 细胞的活力,又不会使细胞大量凋亡,因此后续的实验采用200 μmol/L的H2O2处理细胞24 h 来建立细胞损伤模型,见表1。
表1 不同浓度H2O2干预 H9C2 心肌细胞后细胞活性比较(n=5,±s)Tab 1 Comparison of cell activity of H9C2 myocardial cells after intervention with different concentrations of H2O2(n=5,±s)

表1 不同浓度H2O2干预 H9C2 心肌细胞后细胞活性比较(n=5,±s)Tab 1 Comparison of cell activity of H9C2 myocardial cells after intervention with different concentrations of H2O2(n=5,±s)
注:与0 μmol/L 比较,**P<0.01。
存活率(%)H2O2浓度(μmol/L)100 83.31±0.47**75.69±0.30**52.80±0.31**12.58±0.50**34 178 0.000 0 50 100 200 400 F P
2.2 山茶油对H2O2损伤后H9C2细胞衰老的影响
结果显示:与空白对照组相比,模型组β-半乳糖苷酶阳性率增加,衰老细胞数所占百分比增加(P<0.01);与模型组相比,实验组衰老细胞数量减少,衰老细胞数所占百分比减小,且随着山茶油浓度的增加,衰老细胞数量依次降低,衰老细胞阳性率降低(P<0.05),见表2,图1。
表2 山茶油对H2O2诱导H9C2 细胞衰老阳性率的影响(n=3,±s)Tab 2 Effect of camellia oil on the positive rate of H2O2-induced aging in H9C2 cells(n=3,±s)
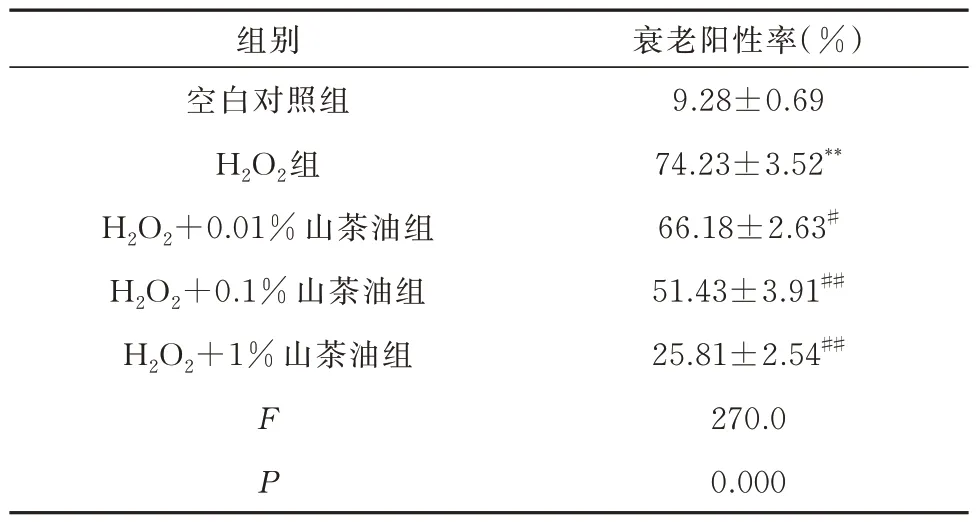
表2 山茶油对H2O2诱导H9C2 细胞衰老阳性率的影响(n=3,±s)Tab 2 Effect of camellia oil on the positive rate of H2O2-induced aging in H9C2 cells(n=3,±s)
注:与空白对照组比较,**P<0.01;与H2O2 组比较,#P<0.05;##P<0.01。
衰老阳性率(%)9.28±0.69 74.23±3.52**66.18±2.63#51.43±3.91##25.81±2.54##270.0 0.000组别空白对照组H2O2组H2O2+0.01%山茶油组H2O2+0.1%山茶油组H2O2+1%山茶油组F P
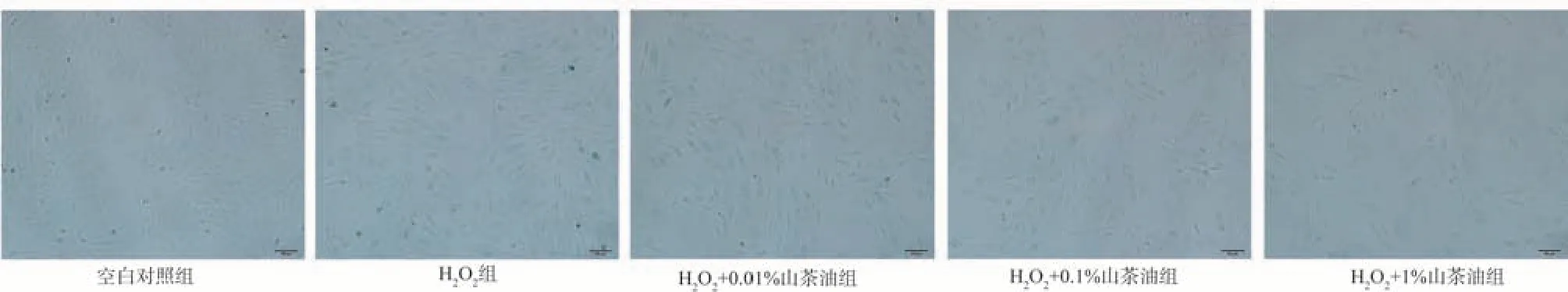
图1 不同浓度山茶油干预模型后H9C2 细胞β-半乳糖苷酶衰老染色实验(×100)Fig 1 Senescence-associated-β-galactosidase (SA-β-gal) staining of H9C2 cells after different concentrations of camellia oil intervention(×100)
2.3 山茶油对H2O2 损伤后H9C2 细胞线粒体膜电位的影响
结果显示:相比空白对照组,模型组细胞红/绿荧光强度比值显著降低(P<0.01);与模型组相比,H2O2+1%山茶油组细胞红/绿 荧光强度比值升高(P<0.01);H2O2+0.1%山茶油组、H2O2+0.01%山茶油组组间细胞红/绿 荧光强度没有明显区别(P>0.05),见图2。
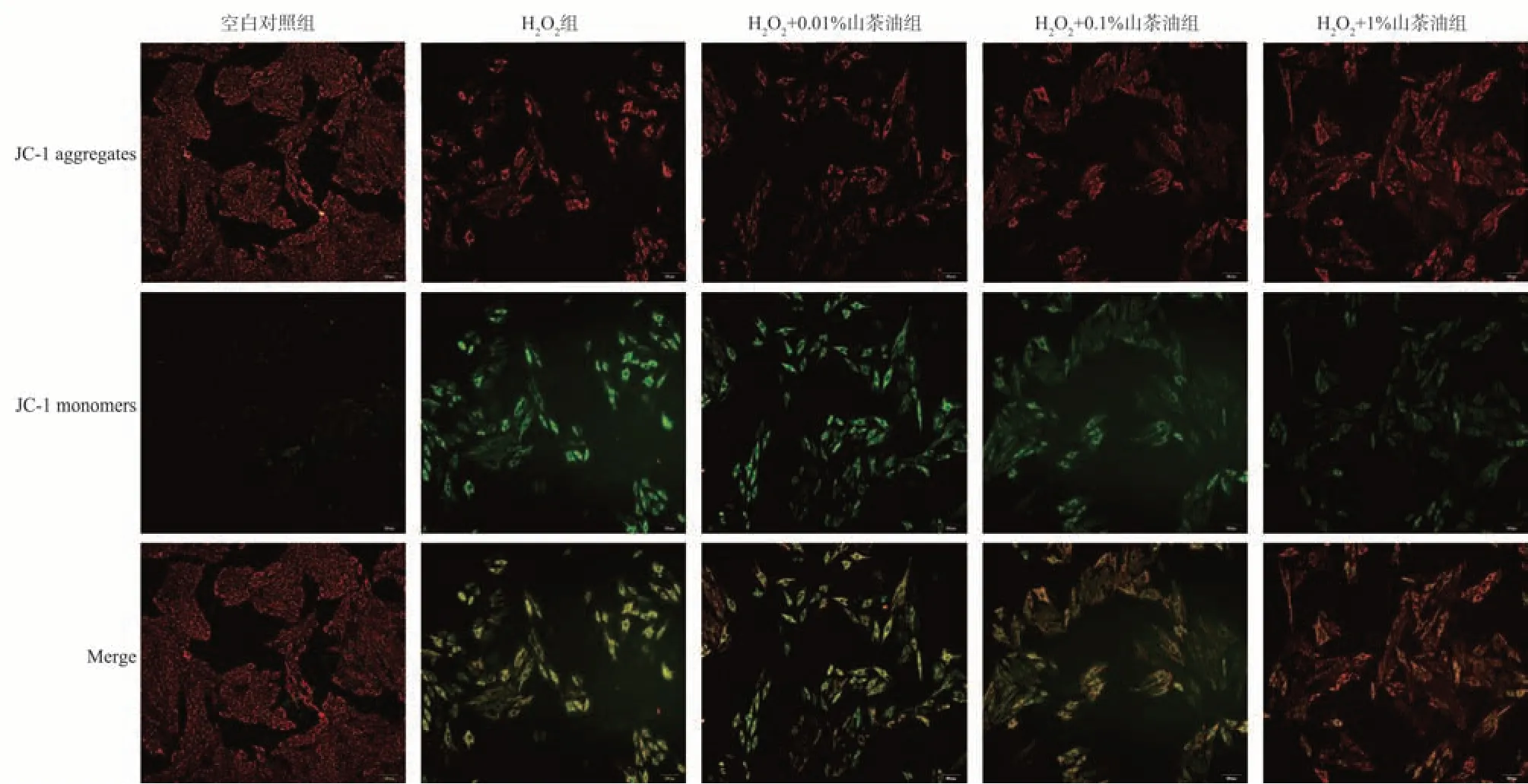
图2 不同浓度山茶油干预模型后H9C2 细胞线粒体膜电位实验(×100)Fig 2 Mitochondrial membrane potential assay (JC-1) of H9C2 cells after different concentrations of camellia oil intervention(×100)
2.4 山茶油对H2O2损伤后H9C2细胞增殖的影响
结果显示:与空白对照组相比,模型组的细胞增殖率明显降低(P<0.01);相比模型组,实验组的细胞增殖率增加,随着山茶油浓度的增加,增殖率依次增加(P<0.01 或P<0.05),见表3,图3。
表3 山茶油对H2O2诱导H9C2 细胞增殖率的影响(n=3,±s)Tab 3 Effect of camellia oil on H2O2 induced H9C2 cell proliferation rate(n=3,±s)
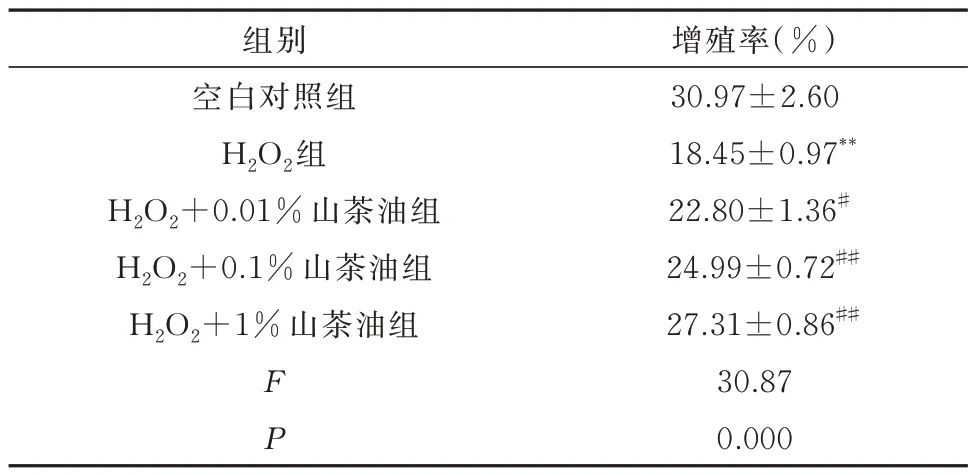
表3 山茶油对H2O2诱导H9C2 细胞增殖率的影响(n=3,±s)Tab 3 Effect of camellia oil on H2O2 induced H9C2 cell proliferation rate(n=3,±s)
注:与空白对照组比较,**P<0.01;与H2O2 组比较,#P<0.05;##P<0.01。
组别空白对照组H2O2组H2O2+0.01%山茶油组H2O2+0.1%山茶油组H2O2+1%山茶油组增殖率(%)30.97±2.60 18.45±0.97**22.80±1.36#24.99±0.72##27.31±0.86##30.87 0.000 F P
2.5 山茶油对H2O2损伤后H9C2细胞迁移的影响
结果显示:相比空白对照组,模型组细胞迁移率降低,愈合能力减弱(P<0.01);与模型组相比,H2O2+0.01% 山茶油组间迁移率无明显差别,H2O2+0.1%山茶油组和H2O2+1%山茶油组细胞迁移率增加,细胞愈合能力增强(P<0.01 或P<0.05)。见表4,图4。
表4 山茶油对H2O2诱导H9C2 细胞迁移率的影响(n=3,±s)Tab 4 Effect of camellia oil on H2O2-induced H9C2 cell migration rate(n=3,±s)
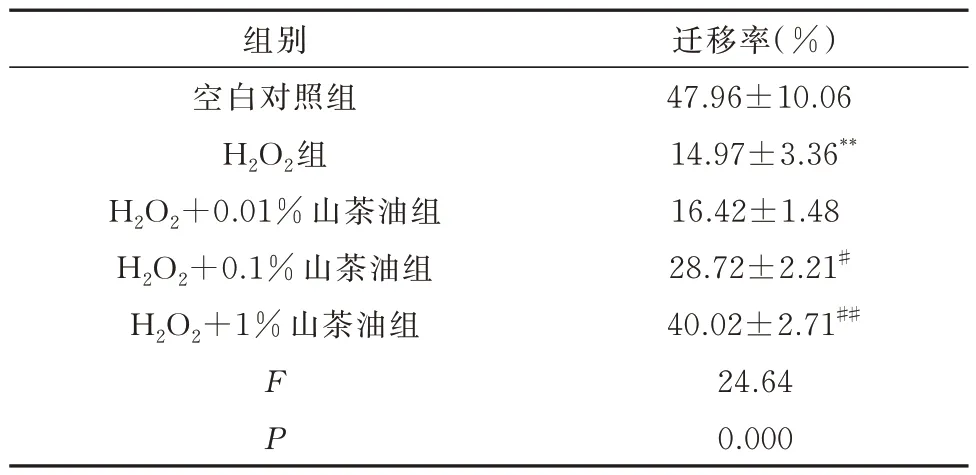
表4 山茶油对H2O2诱导H9C2 细胞迁移率的影响(n=3,±s)Tab 4 Effect of camellia oil on H2O2-induced H9C2 cell migration rate(n=3,±s)
注:与空白对照组比较,**P<0.01;与H2O2 组比较,#P<0.05;##P<0.01。
组别空白对照组H2O2组H2O2+0.01%山茶油组H2O2+0.1%山茶油组H2O2+1%山茶油组迁移率(%)47.96±10.06 14.97±3.36**16.42±1.48 28.72±2.21#40.02±2.71##24.64 0.000 F P
2.6 山茶油对H2O2 损伤后的H9C2 中LDH、MDA、SOD 的影响
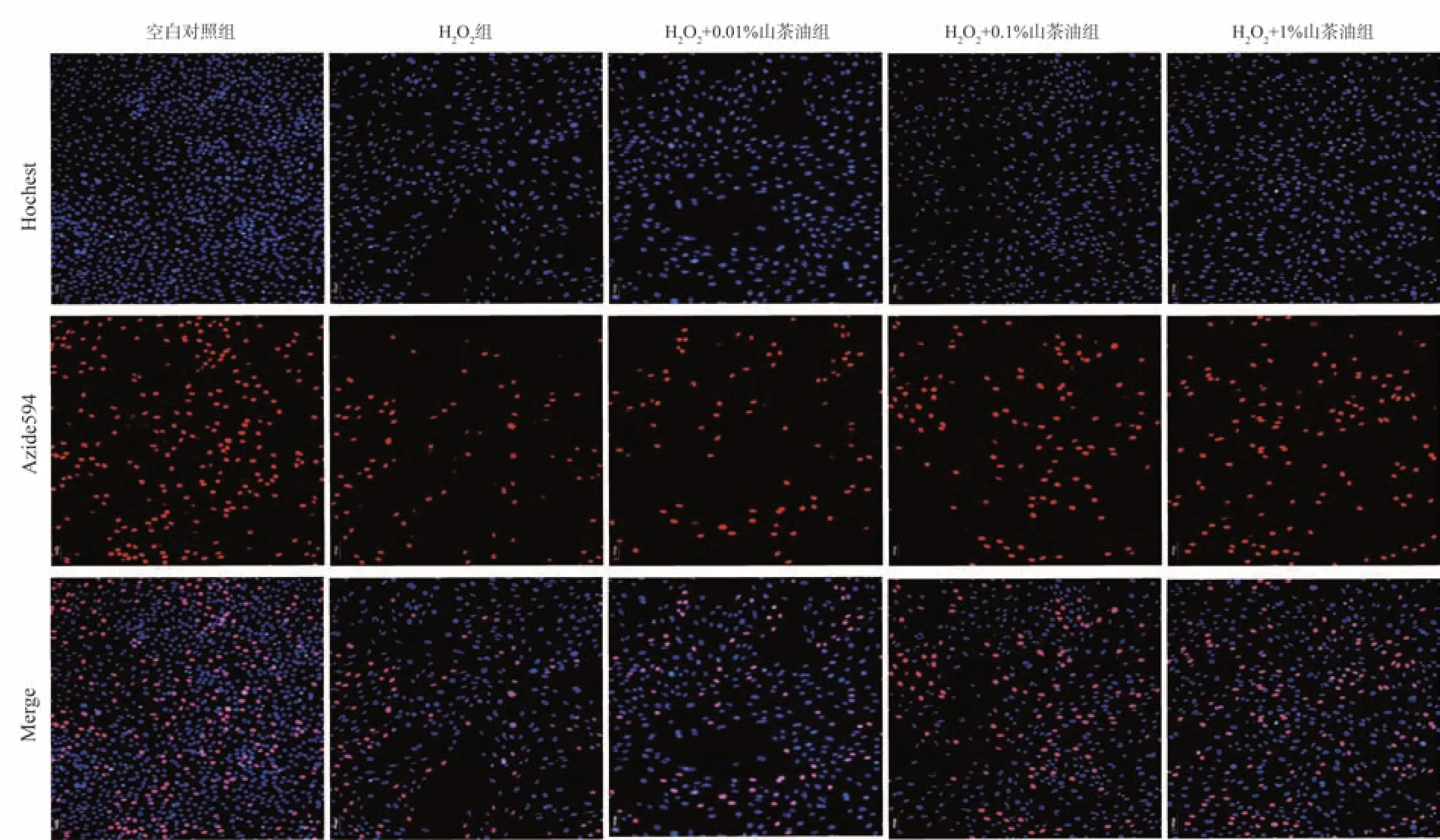
图3 不同浓度山茶油干预模型后H9C2 细胞EdU 增殖染色实验(×100)Fig 3 EdU staining of H9C2 cells after different concentrations of camellia oil intervention(×100)
与空白对照组相比,模型组细胞SOD 活性降低(P<0.01),LDH 活性和MDA 含量增加(P<0.01);与模型组相比,H2O2+0.01%山茶油组间心肌细胞MDA 含 量、SOD 活 性 无 明 显 差 别,LDH 活 性 增 加(P<0.01)。H2O2+0.1%山茶油组和H2O2+1%山茶油组细胞SOD 活性增加,LDH 活性和MDA 含量下降(P<0.05)。见表5。

图4 不同浓度山茶油干预模型后H9C2 细胞划痕实验(×40)Fig 4 Scratch test of H9C2 cells after different concentrations of camellia oil intervention(×40)
表5 山茶油对H2O2诱导H9C2 细胞中LDH、MDA、SOD 的影响(n=3,±s)Tab 5 Effect of camellia oil on LDH, MDA, and SOD in H9C2 cells induced by H2O2(n=3,±s)
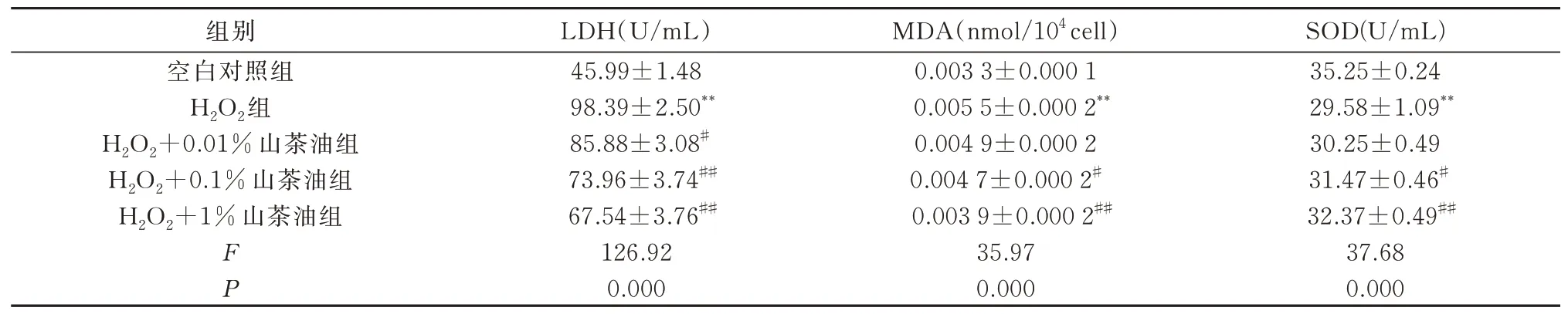
表5 山茶油对H2O2诱导H9C2 细胞中LDH、MDA、SOD 的影响(n=3,±s)Tab 5 Effect of camellia oil on LDH, MDA, and SOD in H9C2 cells induced by H2O2(n=3,±s)
注:与空白对照组比较,**P<0.01;与H2O2组比较,#P<0.05;##P<0.01。
组别空白对照组H2O2组H2O2+0.01%山茶油组H2O2+0.1%山茶油组H2O2+1%山茶油组LDH(U/mL)45.99±1.48 MDA(nmol/104 cell)0.003 3±0.000 1 SOD(U/mL)35.25±0.24 29.58±1.09**30.25±0.49 31.47±0.46#32.37±0.49##37.68 0.000 F P 98.39±2.50**85.88±3.08#73.96±3.74##67.54±3.76##126.92 0.000 0.005 5±0.000 2**0.004 9±0.000 2 0.004 7±0.000 2#0.003 9±0.000 2##35.97 0.000
3 讨论
心血管疾病包括,心律失常,冠状动脉粥样硬化性心脏病,高血压,心肌病,外周血管疾病和先天性心脏缺陷等疾病[6,7]。心血管疾病是我国居民死亡的主要原因,占我国人口死亡的40%,是当之无愧的人类健康的“第一杀手”[8]。随着我国老年人口所占比例逐渐增加,心血管疾病的发病率也日渐增加,必须重视其预防治疗[9]。
包括心血管疾病在内的许多慢性疾病,如糖尿病、肾脏、骨骼肌疾病被证实与氧化应激直接相关[10]。氧化应激是指体内氧化与抗氧化机制的失衡,活性氧是具有化学反应性的一类含氧化学物质的统称,包括过羟基自由基超氧化物,氧化物等非自由基分子。活性氧水平对的细胞稳态的调节至关重要,低到中等水平的活性氧激活应激反应性生存途径,维持细胞分化和增殖。然而,高水平的活性氧会造成细胞成分的损伤,例如DNA、蛋白质和脂质[11]。多种心血管疾病已被证明与活性氧的过量产生有关[12],H2O2作为活性氧的一员可调节从细胞分化到细胞凋亡的各种生物过程,同时过量的H2O2也被广泛认为具有细胞毒性作用,其在体内通过过氧化氢酶、谷胱甘肽过氧化物酶等酶消除[13,14]。
山茶油是从成熟的油茶种子中获得的纯天然食用油,因为其油酸浓度很高,与橄榄油非常相似,通常被称为“亚洲橄榄油”。山茶油不仅是一种常见的食用油,而且也具有很大的的药用价值。传统上,山茶油长期以来一直用于治疗人们的胃肠道,肺和肾脏疾病。先前的研究表明,山茶油比普通食用油更能有效预防高血压、高脂血症和高血糖[15-18]。山茶油主要成分包括油酸、亚油酸、棕榈酸、角鲨烯、维生素E 以及类黄酮,具有抗氧化作用在内的广泛的药理作用。由此猜想山茶油可以减轻氧化应激造成的心血管损伤,从而有效的预防心血管疾病。
在体外利用H2O2诱导细胞建立氧化应激损伤模型已逐渐成熟,本研究通过利用H2O2在体外建立细胞氧化应激损伤模型,用氧化应激损伤模型来探索山茶油对细胞氧化应激具有保护作用。首先分别用不同浓度的H2O2溶液对H9C2 心肌细胞进行损伤造模,通过CCK8 实验来选取最佳H2O2损伤造模浓度,从而建立氧化应激模型。用不同浓度的山茶油预处理细胞后,加入200 mol/L H2O2刺激细胞,分别通过β-半乳糖衰老染色实验,线粒体膜电位实验,EdU 细胞增殖染色实验及划痕实验来探索不同浓度山茶油对细胞氧化应激后衰老、线粒体膜电位、细胞增殖、细胞迁移及氧化应激指标的影响。本研究结果显示在H2O2处理条件下,山茶油可以抑制心肌细胞线粒体膜电位下降和心肌细胞衰老;增加心肌细胞增殖率和迁移率。LDH、MDA 可反映心肌细胞氧化损伤程度,SOD 可反应心肌抗氧化程度。山茶油可降低H2O2处理条件下心肌细胞LDH和MDA 活性 ,增高 SOD 活性。说明山茶油能对H2O2诱导的H9C2 心肌细胞损伤起保护作用。
综上所述,本研究证实了山茶油对H2O2诱导大鼠H9C2 心肌细胞氧化应激损伤具有保护作用,提示山茶油可能具有抗氧化应激损伤的能力,且山茶油的抗氧化力随着山茶油浓度的增加而增强。实验结果为山茶油后续的抗氧化药理作用及临床研究提供帮助。本研究仅局限于体外细胞实验,还需要进一步在动物模型中验证,为山茶油对机体氧化损伤的保护作用提供更多依据。
作者贡献度说明:
晏庆:实验实施,数据处理和论文撰写;郭蓁、孙赛男、黎婧:文献检索和数据分析;黎静、谭机永:实验设计,实验指导及论文修改指正。
所有作者声明不存在利益冲突关系。

