胃饥饿素通过miR-455-5p 靶向IGF-1R 调控肝细胞胰岛素敏感性的作用及机制研究
郭展宏,居悦俊,沈 婷,张琳琪,盛忠奇,吴润泽,孔颖宏
(江苏省常熟市第二人民医院内分泌科,江苏 常熟 215500)
糖尿病与遗传易感性或不健康的生活方式有关。根据国际糖尿病联盟(international diabetes federation,IDF)的数据,全球有超过4 亿人口患有糖尿病,其中90%是2 型糖尿病[1]。胰岛素抵抗(insulin resistance,IR)被认为是引起2 型糖尿病的主要原因之一。肝脏是葡萄糖储存和代谢的关键器官。IR 可导致肝脏葡萄糖代谢异常,从而加快2 型糖 尿病的 进展[2]。磷 脂酰肌醇3 激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路调节细胞增殖、分化以及代谢[3],它在胰岛素对血糖的调节、葡萄糖转运蛋白的激活、促进糖原合成和调节糖酵解过程中发挥关键作用[4]。PI3K/Akt 通路的信号转导异常与许多人类疾病密切相关,包括2 型糖尿病、肥胖症和癌症等[3]。 胰 岛 素 样 生 长 因 子-1 受 体(insulin-like growth factor-1 receptor,IGF-1R)是一种酪氨酸激酶受体[5],它激活下游的PI3K/Akt 通路,提高机体的胰岛素敏感性[6]。
微小核糖核酸(microRNA,miRNA)是非编码内源性RNA,通过结合靶点的3'非翻译区抑制或切割靶点mRNA,从而调节基因表达。最近的研究发现,一些miRNA 是人类IGF-1R mRNA 的负性调节因 子,包 括miR-130a-3p[7]和miR-520b[8]。研 究 发现,miR-455-5p 的上调可能通过抑制肝细胞癌中的IGF-1R 信号转导,抑制糖酵解或葡萄糖摄取[9]。一项针对中国2 型糖尿病患者的研究显示,miR-455-5p 在 这 些 患 者 中 高 表 达[10]。miR-455-5p的上调可能抑制许多与代谢有关的生物过程,包括脂肪生成和胰岛素信号通路[11]。以上研究证明了miR-455-5p 与2 型糖尿病之间存在密切的相关性。然而,miR-455-5p 如何影响胰岛素敏感性的分子机制仍需进一步阐明。
去酰基化胃饥饿素(des-acyl ghrelin,DAG)是由胃底黏膜分泌的一种脑肠肽,它参与调节许多代谢过程[12]。临床研究表明,在节食减肥后,较高水平的DAG 可以改善肥胖个体的胰岛素敏感性[13]。研究证实,长期外源性应用DAG 可以稳定血糖和胰岛素水平[14],并改善胰岛素敏感性,这可能与DAG 调节胰岛素抵抗状态下的氧化应激和炎症反应有关[15]。然而,DAG 改善胰岛素抵抗的确切机制仍不清楚。
人肝癌细胞系(HepG2)已广泛用于肝细胞葡萄糖稳态的研究,包括肝葡萄糖产生和胰岛素信号通路的调节等。本研究构建了一个胰岛素抵抗的HepG2 细胞模型,以探究DAG 对胰岛素抵抗的调节以及miR-455-5p/IGF-1R/PI3K 信号通路在这一过程中的作用。
1 材料与方法
1.1 细胞培养及处理
HepG2 细胞系购自中国科学院上海细胞生物学研究所细胞库,在含5% CO2以及37 ℃培养箱条件下,采用含10%胎牛血清(Bovogen Biologicals,Australia)和1% 抗生素(青霉素和链霉素)的DMEM(Gibco, USA)进 行 培 养。 使 用 含5.5 mmol/L(正常对照组)或30 mmol/L 葡萄糖(胰岛素抵抗组及药物干预组)的DMEM 进行培养,并加入高胰岛素(100 nmol/L)构建胰岛素抵抗的HepG2 细胞模型;在胰岛素抵抗组及药干预组培养基中加入1 μmol/L DAG(Cozmo-Lab,USA)后培养48 h,以评估DAG 对葡萄糖代谢的影响。用100 nmol/L 胰岛素处理0.5 h 后收取细胞。
1.2 细胞转染
miR-455-5p 模拟物或抑制剂由PPL 质粒与蛋白共享库(南京)合成,并使用LipofectamineTM3000转染试剂(Invitrogen,USA)转染进入HepG2 细胞中。转染24 h 后,使用miRNA 荧光原位杂交(Fluorescencein situ hybridization,FISH)检测miR-455-5p的表达水平,以验证转染是否成功。Western Blot法检测IGF-1R、PI3K/Akt 信号通路的表达水平。
1.3 miRNA 荧光原位杂交
针对miR-455-5p 的异硫氰酸荧光素(FITC)标记特异性探针由上海生工生物(Sangon Biotech)设计并合成。使用FISH 试剂盒(RiboBio Corporation)进行miR-455-5p FISH 检测。细胞图像使用共聚焦显微镜(Nikon,Japan)拍摄。
1.4 细胞活性检测
使用MTT 检测试剂盒(北京索莱宝科技有限公司)检测采用不同浓度DAG(从0 到4 μmol/L)处理的HepG2 细胞的存活率。细胞在DAG(0、0.5、1.0、2.0 和4.0 μmol/L)中 孵 育24 h。随 后 加 入MTT 溶液(5 mg/mL,20 μL/孔)并孵育4 h。去除上清液,每孔加入110 μL 甲臜(Formazan)溶液,低速震荡10 min,使用多功能微孔板读数仪(PerkinElmer,USA)记录490 nm 处的吸光度。
1.5 葡萄糖消耗量测定
转染24 h 后,使用葡萄糖含量检测试剂盒(北京索莱宝科技有限公司)测定培养基中的葡萄糖含量,根据如下公式计算出各组HepG2 细胞葡萄糖消耗量:葡萄糖消耗量(mmol/L)=空白组葡萄糖含量(mmol/L)-各组葡萄糖含量(mmol/L)。使用多功能微孔板读数仪(PerkinElmer,USA)记录505 nm 处的吸光度。
1.6 糖原含量测定
使用糖原检测试剂盒(北京索莱宝科技有限公司)测定糖原含量。按说明书操作,使用多功能微孔板读数仪(PerkinElmer,USA)记录620 nm 处的吸光度。计算糖原含量并以μg/106细胞表示。
1.7 双荧光素酶报告基因实验
使 用TargetScanHuman 软 件(版 本7.2)预 测miR-455-5p 靶向IGF-1R 基因。进行双荧光素酶报告基因实验以确认miR-455-5p 靶向IGF-1R mRNA 3'-UTR。将野生型(WT)和突变型(MUT)的IGF-1R 3'UTR 分别克隆到psiCHECK-2 载体(Promega,USA)中。该载体包含萤火虫荧光素酶报告基因和海肾荧光素酶基因。然后,使用LipofectamineTM 3000 转 染 试 剂(Invitrogen,USA)将miR-455-5p 模拟物或其对照(5 pM)、报告基因质粒IGF-1R-WT(0.16 μg/孔)或IGF-1R-MUT(0.16 μg/孔)转染到HepG2 细胞中。24 h 后,检测相对荧光素酶活性。
1.8 Western Blot
转染48 h 后,收集HepG2 细胞并在RIPA 缓冲液(北京索莱宝科技有限公司)中裂解。使用BCA检测试剂盒(Thermo Fisher,USA)测定总蛋白浓度。蛋白样品在SDS-PAGE(北京索莱宝科技有限公司)中分离,随后转移到0.22 μm PVDF 膜(Amresco,USA)上。PVDF 膜在4 ℃条件下加入一抗中孵育过夜,然后在室温下加入二抗中孵育1 h。使用凝胶成像系统(Syngene,USA)进行化学发光成像。一抗:p-PI3K(1∶1 000,#13857,CST,USA)、PI3K(1∶1 000,#4249,CST,USA)、p-Akt(1∶1 000,#9271,CST,USA)、Akt(1∶1 000,#9272,CST,USA)、IGF-1R(1∶1 000,#AP59586,苏州百远生物科技有限公司)、GAPDH(1∶2 500,ab9485,Abcam,UK)。
1.9 统计学处理
使 用GraphPad Prism 9.0 (GraphPad Software Inc., USA) 软件进行统计分析。所有实验都重复3次,结果表示为(±s)。通过单因素方差分析(ANOVA)和非配对t检验计算P值。P<0.05 为差异具有统计学意义。
2 结果
2.1 DAG 对细胞活性的影响
使用MTT 检测试剂盒检测DAG 对HepG2 细胞的毒性作用。将HepG2 细胞置于含一系列不同浓度DAG(0.5、1.0、2.0 以及4.0 μmol/L)的培养液中孵育24 h。结果显示细胞存活率未发生变化(图1A、表1)。说明本研究中使用的DAG 浓度(1 μmol/L)不会对细胞造成损害。
2.2 DAG 改善高糖诱导的HepG2 细胞的胰岛素敏感性
多项研究表明,DAG 促进葡萄糖消耗,并在多种细胞中上调胰岛素依赖的信号通路[14,15]。使用HepG2 细胞建立了胰岛素抵抗模型,然后应用DAG(1 μmol/L)进行干预。与正常对照组相比,高糖(30 mmol/L)状态下HepG2 细胞的葡萄糖消耗明显降低,从胰岛素刺激后的1 h 开始下降,并在12 h 达到最大值(图1B、表2)。高糖(30 mmol/L)条件下处理48 h 显著降低了葡萄糖消耗量(图1C、表3)和细胞内糖原含量(图1D、表3)。同时,IGF-1R、p-PI3K 和p-Akt 的表达也明显下降(图1E),这与前人研究的结果一致[16].DAG (1 μmol/L) 显著增加了葡萄糖消耗量(图1C、表3)和细胞内糖原含量(图1D、表3),并增加了高糖条件下IGF-1R、p-PI3K 和p-Akt 的表达(图1E)。这些结果表明DAG 可能通过上调IGF-1R/P13K/Akt 通路来改善胰岛素敏感性。
2.3 IGF-1R 是miR-455-5p 的直接靶基因
生物信息学分析预测了miR-455-5p 可与IGF-1R 3'-UTR 上的特定位点结合(图2A)。为了验证miR-455-5p 是否靶向IGF-1R,进行双荧光素酶报告基因实验。与正常对照模拟物组(NC mimic)相比,IGF-1R-WT/miR-455-5p 共转染后的荧光素酶活性明显降低(图2B)。共转染miR-455-5p 和IGF-1R-MUT 后,荧光素酶活性保持不变(图2B)。Western Blot 实验证实了上调miR-455-5p 对IGF-1R 表达的影响。miR-455-5p 上调后,IGF-1R蛋白水平明显降低(图2C)。以上结果表明IGF-1R是miR-455-5p 的直接靶基因。
2.4 DAG 通过miR-455-5p 介导的IGF-1R/PI3K/Akt 信号通路改善高糖诱导的胰岛素抵抗

图1 高糖培养诱导HepG2 细胞胰岛素抵抗Fig 1 Insulin resistant HepG2 cells induced by high glucose

表1 HepG2 细胞活性测定Tab 1 The viability of HepG2 cells
为了明确miR-455-5p 在DAG 改善胰岛素抵抗过程中的作用机制,检测了miR-455-5p 以及总IGF-1R、p-PI3K 和p-Akt的蛋白水平的变化。在高糖条件下,miR-455-5p 表达上调(图1F)。使用DAG(1 μmol/L)连 续 干 预48 h 后,HepG2 细 胞 中 的miR-455-5p 高表达被部分逆转(图1F)。同时,IGF-1R、p-PI3K 和p-Akt 的蛋白表达水平升高(图1E)。 然 后 分 别 使 用miR-455-5p 的 模 拟 物(miR-455-5p mimic)或抑制剂(miR-455-5p inhibitor)过表达或沉默miR-455-5p,并通过FISH 检测miR-455-5p的表达(图3A,图4A)。以上结果表明,过表达miR-455-5p部分逆转了DAG 对IGF-1R/PI3K/Akt信号通路的影响(图3D),降低了葡萄糖消耗量和细胞内糖原含量(图3B,图3C、表3)。miR-455-5p 抑制剂提高了IGF-1R、p-PI3K 和p-Akt的表达(图4D),促进了葡萄糖消耗和糖原合成(图4B,图4C、表3)。以上结果表明,DAG 可能通过下调miR-455-5p 的表达,从而激活IGF-1R/PI3K/Akt信号通路,部分改善高糖诱导的HepG2细胞的胰岛素抵抗。
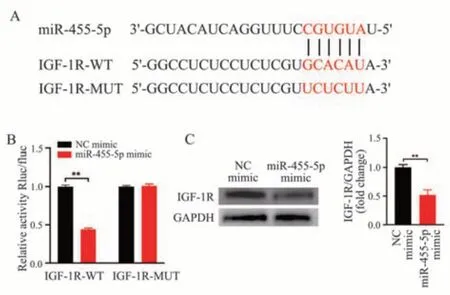
图2 miR-455-5p 与IGF-1R 的靶向关系Fig 2 Target relationship between miR-455-5p and IGF-1R

表2 高糖培养的HepG2 细胞(胰岛素抵抗组)以及正常对照组在胰岛素刺激后葡萄糖消耗的时间曲线Tab 2 Time-course profiles of glucose consumption after stimulation with insulin under high glucose condition (IR group) compared to those in the control group
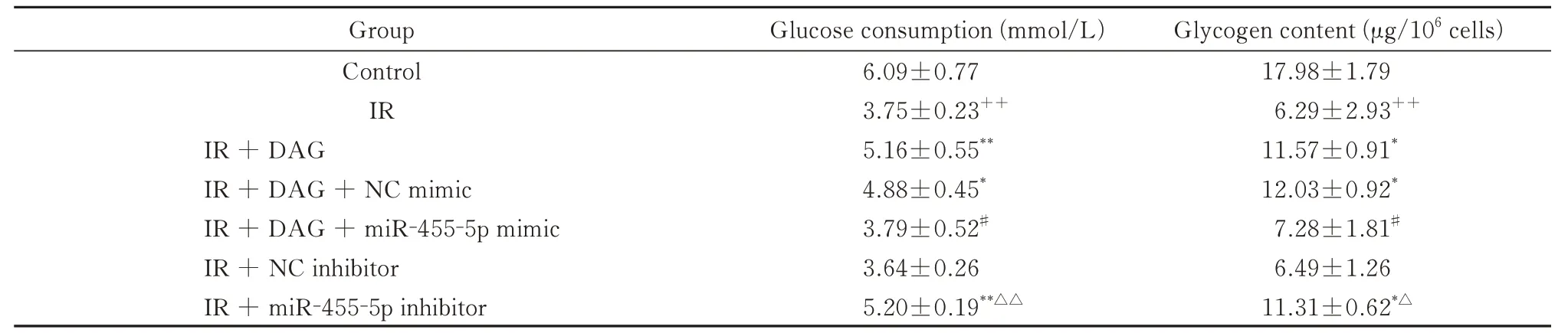
表3 各组HepG2 细胞的葡萄糖消耗量和细胞内糖原含量Tab 3 Glucose consumption and glycogen content of HepG2 cells in each group

图3 miR-455-5p 过表达部分阻断了DAG 对胰岛素敏感性的改善作用Fig 3 miR-455-5p overexpression partially prevents the ameliorative effect of DAG on insulin sensitivity

图4 抑制miR-455-5p 部分消除了高糖对IGF-1R 信号通路的抑制作用Fig 4 miR-455-5p inhibitor partially abolishes the inhibitory effect of high glucose on the IGF-1R pathway
3 讨论
近年来,随着生活方式的改变,2 型糖尿病(T2DM)的发病率在全球范围内迅速增加,仍然是全球重要的公共卫生问题[17]。胰岛素抵抗是T2DM 的重要病理生理机制。肝脏在维持机体葡萄糖稳态中起着重要作用,也是胰岛素作用的最关键靶器官之一[18]。肝脏胰岛素抵抗被认为是导致葡萄糖摄取和利用受损的主要因素,进而引发代偿性高胰岛素血症、糖原储备下降和糖异生增加[19]。因此,改善肝脏葡萄糖代谢对于缓解T2DM 患者的胰岛素抵抗具有重要意义。胃饥饿素(Ghrelin)于1999 年被首次发现,最初被认为可以促进生长激素的分泌[20]。酰化胃饥饿素(acyl ghrelin,AG)通过激活GHS-R1a 受体,调节摄食行为、能量平衡和胃肠蠕动,发挥广泛的生理作用[21]。去酰化胃饥饿素(des-acyl ghrelin,DAG)在调节能量平衡、胃肠动力等方面对AG 具有拮抗作用[22]。此外,DAG 对血糖稳态也具有有益影响,可以降低血糖水平并改善胰岛素抵抗[23]。本研究发现:(1) DAG 改善高糖诱导的胰岛素抵抗。(2) DAG 通过激活PI3K/Akt 信号通路促进葡萄糖摄取和糖原合成。(3) DAG 可能通过下调miR-455-5p 的表达,从而激活IGF-1R/PI3K/Akt 通 路,这 可 能 是DAG 改 善HepG2 细 胞 胰岛素抵抗的潜在机制。
IGF-1R 是一种跨膜糖蛋白,属于酪氨酸激酶受体家族,通过激活PI3K/Akt 通路调节细胞生长和能量代谢[24,25]。Akt 通过对磷酸化下游的磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)、葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)和糖原合酶激酶3(glycogen synthase kinase 3β, GSK-3β),调节糖原合成和糖异生过程[19,26]。胰岛素抵抗HepG2 细胞中的IGF-1R 蛋白水平显著降低。总PI3K 和Akt 并未明显改变,但在高糖条件下,PI3K/Akt 通路的磷酸化水平明显下降,这与相关研究[16]结论一致。PI3K/Akt 信号通路的失调导致葡萄糖代谢失衡,抑制葡萄糖摄取和糖原合成。已有研究证实了外源性DAG 干预可以增强葡萄糖摄取和胰岛素敏感性[23,27]。研究结果显示,DAG 上调了IGF-1R 的水平,并增强了PI3K/Akt 信号通路的磷酸化水平,从而促进了葡萄糖摄取和糖原合成。
miRNA 参与调控机体胰岛素敏感性。例如,高脂饮食导致胰岛素抵抗和葡萄糖代谢异常,与miRNA 的失调有关,包括miR-27a[28]、miR-29b-3p[29]和miR-144[30]。研 究 表 明miR-455-5p 可 以 通 过 下 调IGF-1R/Akt/GLUT 信号通路来抑制肝细胞癌(Hepatocellular Carcinoma,HCC)的葡萄糖摄取[9],这与研究结果一致。本文重点研究了miR-455-5p通过抑制胰岛素抵抗HepG2 细胞中的IGF-1R 来调节胰岛素敏感性。验证了miR-455-5p 可直接结合IGF-1R mRNA 的3'UTR。本研究发现,在胰岛素抵抗状态下,miR-455-5p 表达明显增加,而IGF-1R蛋白表达量显著减少。抑制IGF-1R 蛋白表达将导致PI3K/Akt 信号通路的磷酸化水平降低,进而降低葡萄糖摄取和糖原合成。转染miR-455-5p 抑制剂/模拟物可分别上调/下调IGF-1R 的蛋白表达。miR-455-5p 抑制剂可部分逆转高糖诱导的IGF-1R的蛋白表达下降,提高PI3K/Akt 信号通路的磷酸化水平,进而增加葡萄糖摄取和糖原合成。研究结果表明,下调miR-455-5p 有助于激活IGF-1R 及其下游的PI3K/Akt 信号通路,从而改善胰岛素抵抗。
DAG 显著降低了高糖诱导的HepG2 细胞中miR-455-5p 的表达,表明DAG 介导的miR-455-5p下调可能有助于其对改善胰岛素抵抗的作用。上调miR-455-5p 的表达逆转了DAG 对胰岛素抵抗的改善作用。miR-455-5p 抑制剂部分消除了高糖对IGF-1R/PI3K/Akt 通路的抑制作用。这些结果表明,DAG 可能通过下调miR-455-5p 的表达来改善高糖诱导的IGF-1R/PI3K/Akt 信号通路失调,这可能是改善胰岛素抵抗和2 型糖尿病患者血糖水平的潜在治疗靶点。
综上所述,本研究发现高葡萄糖条件可上调HepG2 细胞中miR-455-5p 的表达,降低了IGF-1R蛋白水平、p-PI3K 以及p-Akt 的表达,从而抑制了胰岛素信号传导,最终导致胰岛素抵抗发生。DAG 通过干预miR-455-5p/IGF-1R 信号通路,改善HepG2细胞中的胰岛素抵抗。本研究结果表明,抑制miR-455-5p 或上调DAG 可能是2 型糖尿病的潜在治疗靶点。
作者贡献度说明:
郭展宏、居悦俊:实验设计与论文撰写;沈婷、吴润泽:细胞培养与转染;张琳琪、盛忠奇:细胞实验相关指标检测与数据分析;孔颖宏:实验设计指导与论文修改。
所有作者声明不存在利益冲突关系。

