miR-146a介导下的IGSF1对甲状腺乳头状癌侵袭转移的调控机制
龚 烨, 程 超, 王慧琴
(新疆维吾尔自治区人民医院1乳腺甲状腺科, 2医学研究与转化中心, 乌鲁木齐 830001)
甲状腺癌(Thyroid cancer,TC)是比较常见且多发的内分泌恶性肿瘤,其发病率以每年约10%的速度增长[1]。统计数据显示,2020年全球新诊断的甲状腺癌病例为586 202例,排名第9位[2]。其中,甲状腺乳头状癌(Papillary thyroid cancer,PTC)占所有甲状腺癌病例的85%[3]。PTC是侵袭性最低的甲状腺癌,10年生存率在90%以上,但有30%的患者在治疗后出现复发,导致其死亡率的增加[4]。小分子核糖核酸(microRNA,miRNA)属于非编码分子,和PTC发生发展密切相关[5]。研究发现,PTC患者体内的miR-146a高表达,与肿瘤进程、疾病预后关系密切[6-7]。人体内免疫球蛋白超家族成员1(IGSF1)位于Xq26.2,参与调控甲状腺癌的生长、转移和凋亡[8]。然而,有关miR-146a在PTC中的具体调控作用及IGSF1蛋白是否有参与的相关报道较少。本研究通过miR-146a转染人甲状腺乳头状癌细胞系(TPC-1)细胞,探讨miR-146a对TPC-1细胞生物学行为的影响,阐明miR-146a与IGSF1的交互作用及作用机制。
1 材料与方法
1.1 试剂与仪器Annexin V-APC/7-AAD Apoptosis Detection Kit(货号:E-CK-A218)、CCK-8细胞活力检测试剂盒(货号:E-CK-A362)购自Elabscience公司;TPC-1细胞(美国Procell公司,货号:CL-0643);β-连环蛋白(β-catenin)多克隆抗体(货号:51067-2-AP)、骨桥蛋白(Osteopontin,OPN)多克隆抗体(货号:22952-1-AP)购自Proteintech公司;IGSF1多克隆抗体(美国Novus公司,货号:NBP2-14119);结晶紫(货号:C0121)、BCA蛋白浓度测定试剂盒(货号:P0010)均购自碧云天公司。
1.2 实验方法
1.2.1 TPC-1细胞孵育、传代与转染 将TPC-1细胞从液氮中取出,置于37℃水浴锅,轻摇、溶解冻存液;溶解后的细胞置于含有RPMI-1640+10%、FBS+1%P/S的5 mL培养基的离心管中,室温、1 000 r/min,离心5 min,弃上清;用含10%胎牛血清的完全培养基悬浮细胞,接种至培养皿中,吹打混匀,37℃、5% CO2饱和湿度,培养细胞。待细胞贴壁生长,且密度达到80%,进行传代。弃去培养基,PBS洗涤1次;加入2 mL、0.25%胰蛋白酶,消化细胞30~60 s,显微镜下观察,可看到细胞相互分离变圆,即消化完成;弃去胰酶,加入完全培养基,吹打细胞,制成单细胞悬液,1∶3的比例进行传代,37℃、5% CO2饱和湿度,扩大培养。通过MEM培养基进行TPC-1单细胞悬液的制备。将20 μL细胞悬液以3.5×105个密度接种于96孔板内,37℃、5%CO2,饱和湿度,培养过夜。细胞转染:取200 μL JetPRIME缓冲液,加入终浓度60 nmol/L的inhibitor、30 nmol/L的mimics、及4 μL的jetPRIME Transfection Reagent,孵育10 min;取上述混合物200 μL加入细胞培养液中,6 h后换新鲜培养基,37℃、5% CO2培养细胞;转染48 h后进行后续检测。按此法分为Control组、miR-146a mimics组、miR-146a mimics NC组、miR-146a inhibitor组及miR-146a inhibitor NC组。
1.2.2 细胞增殖实验 各组细胞在37℃、5% CO2环境下,培养24 h,细胞作用时间为24 h;各孔内加入10 μL的CCK-8溶液,置于37℃、5% CO2培养4 h,通过酶标仪测定各组细胞的吸光值。
1.2.3 细胞凋亡实验 收集各组细胞,1 500 r/min离心,5 min,重悬,按1∶10的比例加入Binding缓冲液与7-氨基放线菌素D(7-AAD)染色液,反应10 min;再分别加入Binding缓冲液和APC标记膜联蛋白V(Annexin V-APC),继续反应10 min,通过流式细胞仪检测各组细胞的凋亡情况。
1.2.4 Transwell实验 将处理好的各组细胞消化、收集、离心、重悬,细胞计数板计数备用。将稀释为1 mg/mL的Matrigel加入到 Transwell小室上,使用移液管或滴管将Matrigel滴加至小室中进行凝胶处理,将小室置于干燥,温度和湿度适宜的培养箱中生长。每个小室中加入200 μL悬液,置于恒温摇床或培养箱中,培养24 h,用戊二醛对细胞进行固定、苏木精染色,在显微镜(×400)下观察细胞。
1.2.5 细胞划痕实验 利用马克笔在六孔板背后划横线(需要横穿过孔,且各孔至少要划五条线)。选取经处理后的细胞,胰酶(0.25%)消化5×105个细胞,接种于六孔板中,37℃、5% CO2,饱和湿度,培养过夜。待细胞密度达80%时,在六孔板底部铺满,通过枪头划痕,植入无血清培养基,0 h时拍照;置于37℃、5% CO2培养箱中培养24 h、48 h,并拍照监测细胞迁移距离。
1.2.6 免疫组织化学实验 细胞3 μm切片,常规脱蜡、水化,加入3% H2O2作用10 min;在酸碱值为6.0的枸橼酸盐缓冲液内作用10 min后微波加热,待冷却后,室温处理山羊血清30 min;加入IGSF1一抗(1∶100),4℃,孵育过夜;加入二抗(1∶200),室温处理30 min,再加链霉素-蛋白水解酶复合物工作液(SP)(1∶100),室温处理30 min,DAB显色,苏木素复染,脱水、透明、封片,光镜下观察IGSF1并摄片。
1.2.7 实时荧光定量PCR实验(RT-qPCR) 用Primer3设计IGSF1与miR-146a的荧光定量PCR引物,见表1。加入DNA Remover 缓冲液1 μL、RNA 1 μg、无RNA酶水10 μL,42℃,分离2 min;继续加入miRNA Loop Primer 2 μL、SynScriptTMIII RT Enzyme Mix 1 μL、dNTPs 2 μL、无RNA酶水20 μL,50℃,分离15 min;85℃,再次分离5 min。将逆转录产物置于冰上或冷藏备用。反应体系:正向引物(10 μmol/L,0.8 μL),反向引物(10 μmol/L,0.8 μL),2×TSINGKE® Matser qPCR Mix(SYBR Green I,10 μmol/L),无RNA酶水(6 μL),互补DNA模板(2 μL)和50×ROX Reference Dye 2(0.4 μL),配制成20 μL 体系混合均匀。反应条件(20 μL):95 ℃,1 min;95 ℃,10 s;60 ℃ 10 s;72 ℃,15 s,共40个循环,采用RQ=2-ΔΔCt对miR-146a和IGSF1表达水平进行分析。

表1 引物序列设计
1.2.8 Western-Blot 在细胞中加入裂解液,低温离心,收集上清液,检测细胞中β-catenin与OPN表达水平。检测步骤:灌胶、加样、电泳、转膜后、封闭,加一抗(1∶1 000),4℃过夜;加二抗 (1∶5 000)反应2 h,曝光显影,扫描光密度值,计算β-catenin与OPN的光密度值之比。
1.2.9 双荧光素酶报告基因检测 收集各组细胞,加入报告基因细胞裂解液,充分裂解,取上清,测定荧光素酶的活性。融解萤火虫荧光素酶检测试剂和Renilla 荧光素酶检测缓冲液,并使其达到室温。将Renilla荧光素酶检测底物(×100)置于冰浴或冰盒上备用;制备Renilla荧光素酶检测工作液,并测定荧光素酶的相对光单位(RLU)值;以萤火虫荧光素酶为内参,用Renilla荧光素酶的RLU值除以萤火虫荧光素酶的RLU值。
2 结果
2.1 各组细胞增殖活性比较与Control组(100.00±0.00)%比较,miR-146a mimics组TPC-1细胞增殖活性(84.77±3.71)%显著降低,差异有统计学意义(P<0.05);而miR-146a inhibitor组TPC-1细胞增殖活性(119.20±5.81)%显著升高,差异有统计学意义(P<0.05),见表2。
表2 miR-146a对TPC-1细胞增殖活性的影响
2.2 各组细胞凋亡情况比较流式细胞术检测结果显示,与Control组(6.37±0.27)%比较,miR-146a mimics组TPC-1细胞凋亡率(20.33±1.26)%显著增加,而miR-146a inhibitor组TPC-1细胞凋亡率(3.35±0.93)%显著降低,差异有统计学意义(F=217.1,P<0.05),见图1。
2.3 各组细胞侵袭和迁移能力比较Transwell实验和细胞划痕实验研究结果显示,与Control组比较,miR-146a mimics组在24 h和48 h 的相对迁移距离、侵袭细胞数显著降低,差异有统计学意义(P<0.05);miR-146a inhibitor组在24 h和48 h 的相对迁移距离、侵袭细胞数显著增加,差异有统计学意义(P<0.05),见表3、图2。
表3 各组细胞侵袭和迁移能力比较
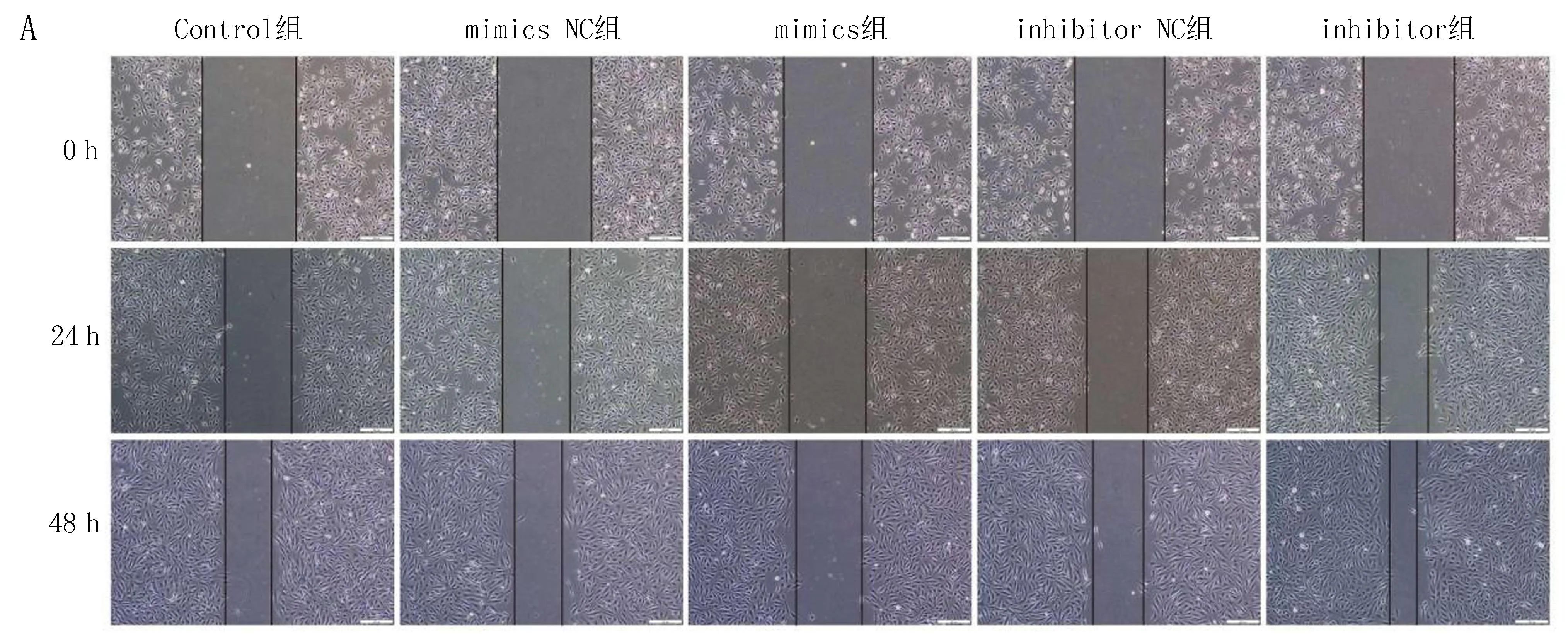
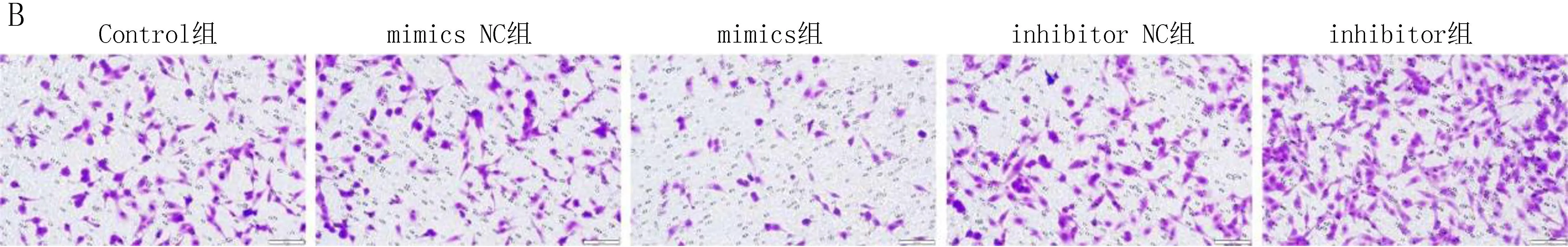
注: A, 细胞划痕实验原始图; B, Transwell原始图。
2.4 miR-146a与IGSF1的表达水平比较与Control组比较,miR-146a mimics组miR-146a表达水平显著增加,IGSF1表达水平显著降低,差异有统计学意义(P<0.05);miR-146a inhibitor组miR-146a表达水平显著降低,IGSF1表达水平显著增加,差异有统计学意义(P<0.05),见表4、图3。
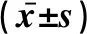
表4 各组miR-146a与IGSF1表达水平比较
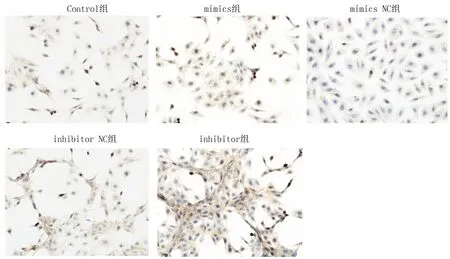
图3 各组IGSF1的表达水平比较
2.5 OPN与β-catenin表达水平比较与Control组(0.92±0.09)比较,miR-146a mimics组β-catenin(0.54±0.08)和OPN(0.30±0.09)表达水平均显著降低,差异有统计学意义(P<0.05);而miR-146a inhibitor组β-catenin(1.26±0.07)和OPN(1.07±0.13)表达水平显著增加,差异有统计学意义(P<0.05),见图4。
注:与Control组比较, *P<0.05。
2.6 双荧光素酶报告基因检测结果比较双荧光素酶报告基因检测结果显示,miR-146a mimics组突变型(mut)(1.17±0.25)与miR-146a mimics NC突变型(1.14±0.35)比较,差异无统计学意义(P>0.05);miR-146a mimics 组野生型(wt)(0.64±0.11)与miR-146a mimics NC 组野生型(1.16±0.07)比较,差异有统计学意义(P<0.05),见图5。
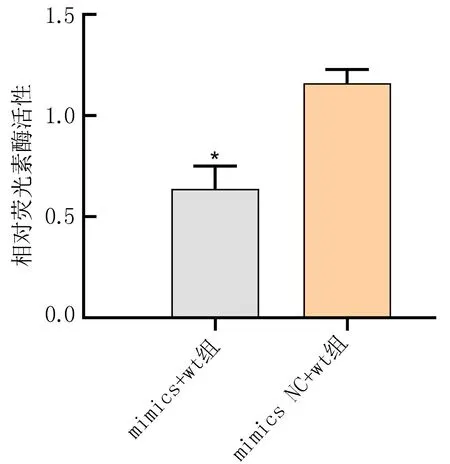
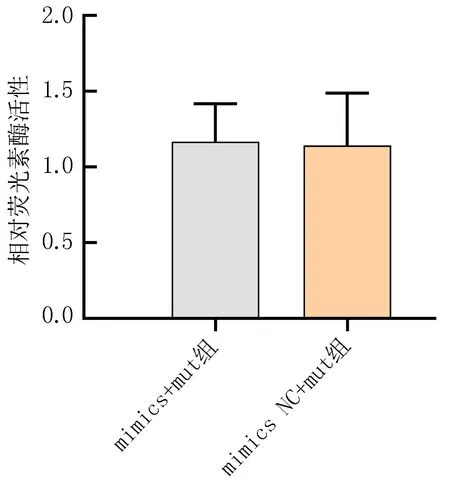
注: 与mimics NC+wt组比较, *P<0.05。
3 讨论
既往研究表明,甲状腺癌的转移涉及多环节、多途径的细胞恶性生物学改变[9]。当患者出现复发转移,会增加治疗难度,影响治疗效果,导致患者预后不佳。miRNA作为非编码分子,与肿瘤进程密切相关,其调控主要通过基因转录过程中和转录后的蛋白表达完成[10],可通过影响肿瘤细胞的转录和翻译过程,诱导肿瘤细胞的异常代谢[11],其异常表达可诱导癌症,引起肿瘤细胞的异常增殖和迁移[12]。miRNA相关研究发现,miR-146a在多种肿瘤细胞中表达异常,且主要参与炎症反应[13]。有研究报道,高表达的miR-146a促进口腔癌细胞的侵袭和转移,而低表达的miR-146a-5p抑制肿瘤细胞的侵袭和转移[14]。过表达miR-146a-5p促进乳腺癌血管新生和细胞迁移[15],而高表达miR-146a-5p抑制胃癌细胞增殖与侵袭[16]。因此,不同肿瘤中miR-146a-5p具有促癌和抑癌的双重作用。有研究认为,甲状腺乳头状癌与miR-146a表达水平密切相关[17]。但目前,关于miR-146a的具体调控作用尚未明确。
本研究结果显示,miR-146a对TPC-1细胞的增殖、凋亡、迁移和侵袭具有重要调节作用。过表达miR-146a导致细胞增殖活性降低,凋亡率增加,相对迁移距离和侵袭细胞数显著降低。相反,抑制miR-146a的表达则促进细胞增殖,降低凋亡率,增加相对迁移距离和侵袭细胞数。表明miR-146a可能是一种肿瘤抑制因子,在甲状腺癌的发展中起重要作用。本研究中过表达的miR-146a对TPC-1细胞侵袭、转移与增殖能力具有抑制作用的结果也与徐万苏等[16]的研究结果一致。研究认为,肿瘤组织类型对miR-146a功能具有决定性作用,在TPC-1细胞内,miR-146a具有抑制癌症基因的功能[17]。此外,miRNA的相互作用机制能够作用靶基因,有效调控其功能,影响肿瘤进程。已有研究报道,在甲状腺癌细胞系中,IGSF1下调可抑制细胞增殖、转移并促进细胞凋亡[18]。同时,抑制IGSF1表达可下调N型钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)和增强子Zeste同源物2(EZH2),与肿瘤转移有关。说明miR-146a可抑制IGSF1,并影响TPC-1的生物学行为改变。
OPN作为一类糖蛋白,在包括促进肿瘤细胞的增殖、侵袭和转移中发挥作用。研究显示,高表达的OPN可促进卵巢癌细胞的侵袭效能,而在甲状腺癌中,OPN的低表达抑制SW579的侵袭效能,进一步研究发现,miR-146a可抑制OPN和β-catenin的翻译水平[19-20],这与本研究结果相似。说明miR-146a可抑制OPN,限制TPC-1的进程。有研究结果表明,OPN与β-catenin之间有密切相关性,β-catenin的激活可促进肿瘤的侵袭[21]。已有研究发现,OPN选择性地和β-catenin之间发生作用,介导β-catenin细胞核聚集与S675磷酸化,激活Wnt信号通路,促进胆管癌(ICC)疾病进程[22]。本研究结果显示,miR-146a通过抑制OPN与β-catenin的表达水平,对TPC-1细胞产生影响,当miR-146a与靶基因的突变型(mut)结合时,基因表达并未显著改变,这可能是因为miR-146a与突变型靶基因的结合较弱,导致无法有效下调基因表达。当miR-146a与靶基因的野生型(wt)结合时,双荧光素酶报告基因的活性显著降低。这进一步证实了miR-146a能与靶基因的野生型进行特异性结合,通过下调其表达水平来发挥功能。表明miR-146a在甲状腺乳头状癌的发展中起到了关键的调控作用。
综上所述,miR-146a可交互作用IGSF1,调控OPN及β-catenin的表达水平,影响甲状腺乳头状癌的进程。这为该疾病的治疗提供了新的思路和潜在的治疗靶点。

