术前乳酸脱氢酶和HALP的联合评分对III期胃癌患者预后的影响*
任燕燕 刘贤明 王发艳 彭丽丽 张洪珍
(1.河北北方学院研究生院,河北 张家口 075000;2.河北省人民医院肿瘤五科,河北 石家庄 050001)
胃癌是常见的消化道恶性肿瘤,据2020年全球癌症统计,其发病率和死亡率分别居于第五位和第四位[1]。本病往往缺乏临床特异性和简单有效的筛查手段,大多数患者就诊时已处于中晚期,总体5年生存率不足40%,尤其对于III期胃癌患者,即使行胃癌根治术并给予标准的术后辅助化疗,患者的预后仍欠佳[2]。因此,为III期胃癌寻找简单、有效的预后标记物,建立一个更准确、更经济的预后风险模型,将有助于III期胃癌患者的个体化治疗寻找最佳的诊疗策略。
近年来有研究[3]表明,癌症相关性炎症和机体营养状况与肿瘤的发生发展密切相关。炎症指标如中性粒细胞/淋巴细胞比值(Neutrophil to lymphocyte ratio,NLR)、血小板/淋巴细胞比值(Platelet to lymphocyte ratio,PLR)、淋巴细胞/单核细胞比值(Lymphocyte to monocyte ratio, LMR)和系统免疫炎症指数(Systematic immune-inflammation index,SII),营养指标如BMI、血ALB、Hb及预后营养指数(Prognostic nutritional index,PNI)已被报道[4-5]与胃癌的预后相关。血红蛋白、白蛋白、淋巴细胞、血小板(Hemoglobin, Albumin, Lymphocytes and platelets,HALP)是一种基于血红蛋白、白蛋白、淋巴细胞和血小板组成的新的生物标志物,反映了全身炎症和免疫营养状况,相关研究已证实HALP与肺癌[6]、胃癌[7]、膀胱癌[8]、宫颈癌[9]等患者的生存率相关。除了炎症和营养等生物标志物,乳酸脱氢酶(Lactate dehydrogenase,LDH)是一种参与无氧糖酵解的代谢酶,高LDH与胃癌患者的肿瘤进展、转移和预后有关[10]。HALP和LDH均可作为独立预后指标预测胃癌的预后,然而,在胃癌中关于这两种生物标志物的联合检测与预后的关系尚不明确。因此,本研究结合LDH和HALP(L-HALP),探索了一种新的预后评分,并探讨L-HALP评分与接受根治性胃切除术并行辅助化疗的III期患者预后的影响,并建立了结合L-HALP评分和TNM分期以及组织学分级的列线图,以预测III期胃癌患者的1、3、5年生存率。
1 资料与方法
1.1 一般资料 回顾性收集2015年1月—2018年12月河北省人民医院行D2胃癌根治术并接受辅助化疗的176例III期胃癌患者的临床病理资料。其中男145例(82.4%),女31例(17.6%),年龄28~78(60.9±9.3)岁。纳入标准:①经组织学或病理学证实为胃癌。②根据胃癌AJCC第八版TNM分期为pIII期。③均行R0切除加D2淋巴结切除术。④术后均接受辅助化疗。⑤具有完整的临床病理和随访资料。排除标准:①术前行新辅助放化疗者。②术前伴有急性感染或其他免疫系统疾病。③术前患有严重血液系统疾病。④术后因其他疾病死亡者。⑤伴有其他恶性肿瘤患者。所有III期胃癌术后患者均接受至少3周期的XELOX(奥沙利铂130 mg/m2,卡培他滨1 000 mg/m2)方案辅助化疗。本研究经河北省人民医院医学伦理委员会审查通过[批准号:2017科研伦审第(190号)]。患者均签署知情同意书。
1.2 方法
1.2.1 临床及病理资料 从电子病例系统中收集患者的临床病理资料以及实验室数据,包括年龄、性别、肿瘤部位、肿瘤大小、组织学分级、pTNM分期、淋巴血管侵犯、神经周围侵犯、辅助化疗方案、LDH和HALP。
1.2.2 HALP及L-HALP评分 将收集的术前7 d内清晨空腹静脉中Hb、ALB、淋巴细胞、PLT测定HALP,HALP定义如下:Hb(g/L)×ALB(g/L)×淋巴细胞计数(/L)/PLT(/L),L-HALP 评分是基于不同LDH水平和HALP值的组合而建立的。
1.2.3 分组及分组标准 根据X-tile软件确定与OS相关的HALP的最佳截断值为25.8(见图1),LDH采用本院正常上限值250 U/L为分组标准。以LDH≥250 U/L为高LDH组,LDH<250 U/L为低LDH组;HALP≥25.8为高HALP组,HALP<25.8为低HALP组。L-HALP评分制定标准如下:(低风险组)L-HALP=0分:LDH<250 U/L,HALP≥25.8;(中风险组)L-HALP=1分:LDH≥250U/L,HALP≥25.8或LDH<250U/L,HALP <25.8;(高风险组)L-HALP=2分:LDH≥250U/L,HALP<25.8。
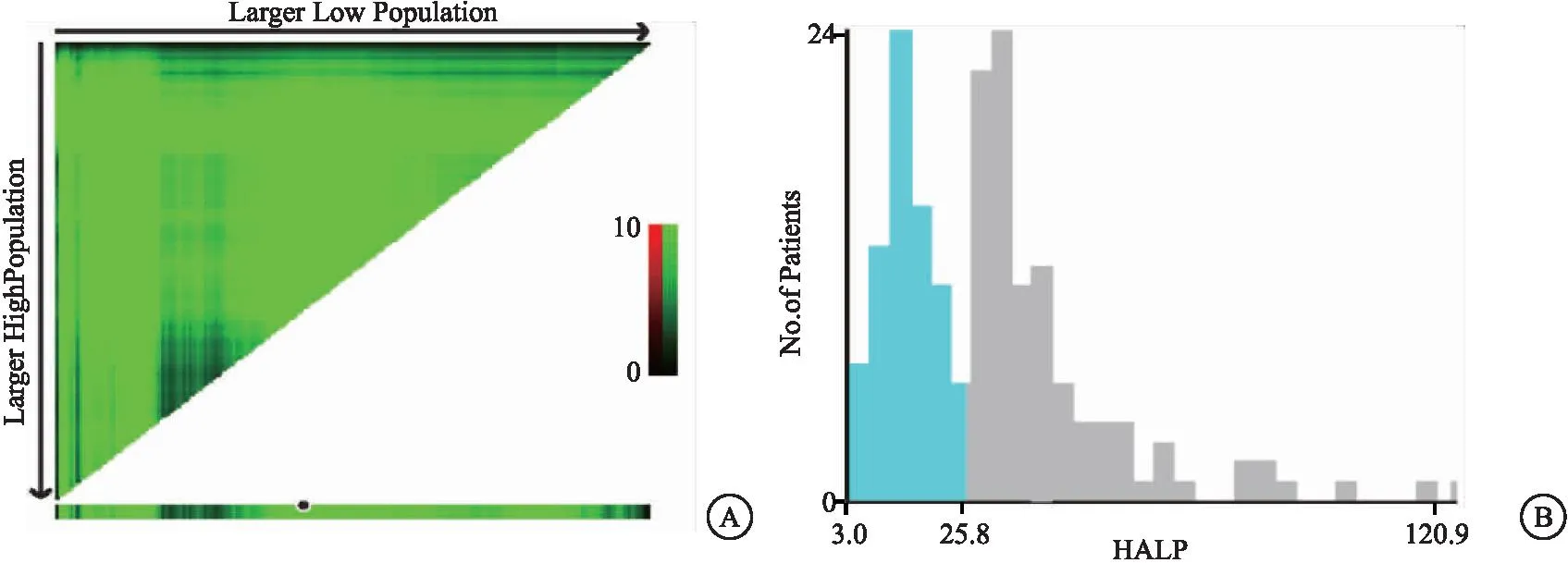
图1 截断值选取Figure 1 Cutoff value selection注:A.横轴上的黑点表示HALP的精确截断值;B.HALP值的X-tile直方图。
1.3 随访 随访方式通过电话、门诊、住院、短信等方式进行,随访评估主要包括体格检查、血液学检查、内窥镜检查及影像学检查(胸腹盆部增强CT、 MRI等),在治疗后前2年每3个月随访一次,后3年每 6 个月随访一次,此后每年随访1次, 2022年3月进行最后一次随访。总生存期(Overall survival,OS )定义为从手术到任何原因死亡或到最后一次随访的时间间隔。
1.4 统计学分析 采用SPSS软件26.0软件进行统计分析,Graphpad Prism 9.0(GraphPad software Inc.,San Diego,CA,USA)软件进行绘图。利用X-tile 3.6.1(Yale University,New Haven CT,USA)软件得到HALP的最佳截断值。分类变量比较采用卡方或Fisher’s精确检验,采用Kaplan-Meier法和Log-Rank检验进行生存分析,并绘制生存曲线;利用Cox风险回归模型进行预后因素分析,基于多因素分析结果,采用R 4.2.1软件(http://www.r-projec.org/)及“survival”、“rms”、“foreign”软件包建立Nomogram预测模型,并计算一致性指数(C-index)确定模型区分度。以P<0.05 为差异有统计学意义。
2 结果
2.1 LDH、HALP、L-HALP与生存结局的相关性 在176例胃癌患者中,患者中位总生存时间为46个月,1、3、5年生存率分别为88.1%、57.7%、41.4%。高LDH组和低HALP组患者OS均显著短于低LDH组和高HALP组,差异有统计学意义(P<0.001)(见图2A~B)。为了进一步探讨LDH和HALP对患者预后的影响,本研究根据其截断值将患者分为四组,结果显示,四个亚组总体存在明显差异(P<0.001),而高LDH组、高HALP组和低LDH组及低HALP组间差异无统计学意义(P>0.05)(见图2C)。基于LDH和HALP水平的L-HALP评分组结果显示,高风险组的OS最短,低L-HALP评分组(低风险组)的OS最长(P<0.001),见图2D。
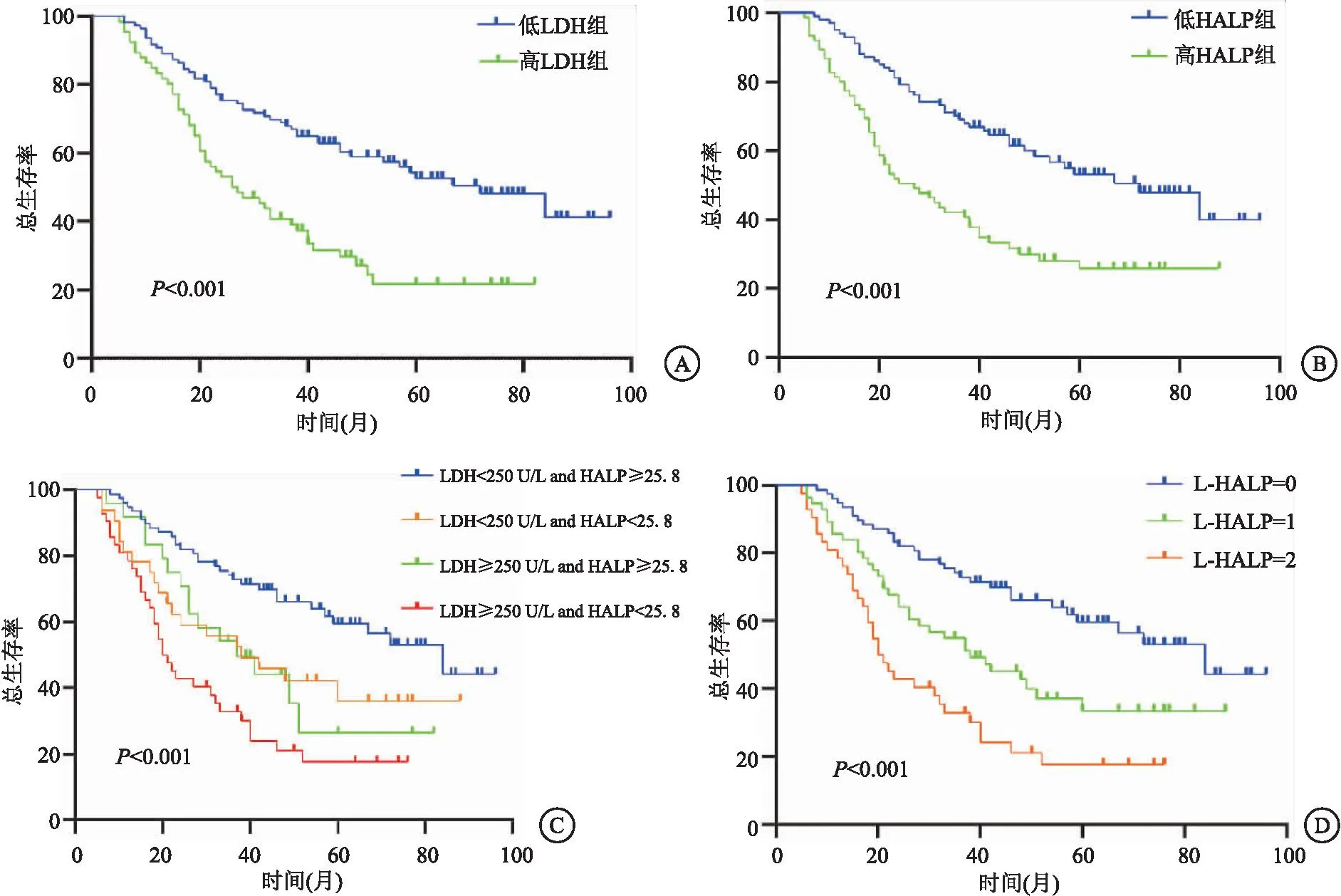
图2 Kaplan-Meier分析Figure 2 Kaplan-Meier analysis注:A.术前LDH;B.术前HALP;C.术前LDH与HALP的组合;D.L-HALP评分。
2.2 影响III期胃癌患者术后OS的Cox单多因素回归分析 单因素生存分析结果显示,LDH、HALP、L-HALP评分、TNM分期、组织学分级、化疗周期、淋巴血管侵犯与OS有关(P<0.05)。将单因素分析中有统计学意义的因素纳入多因素Cox回归模型中,由于L-HALP由LDH和HALP综合评分而来,因此,将多因素结果分为两部分,结果a显示LDH、HALP、TNM分期、 组织学分级是影响OS的独立预后因素;结果b显示L-HALP评分、TNM分期、组织学分级是影响OS的独立预后因素,见表1。
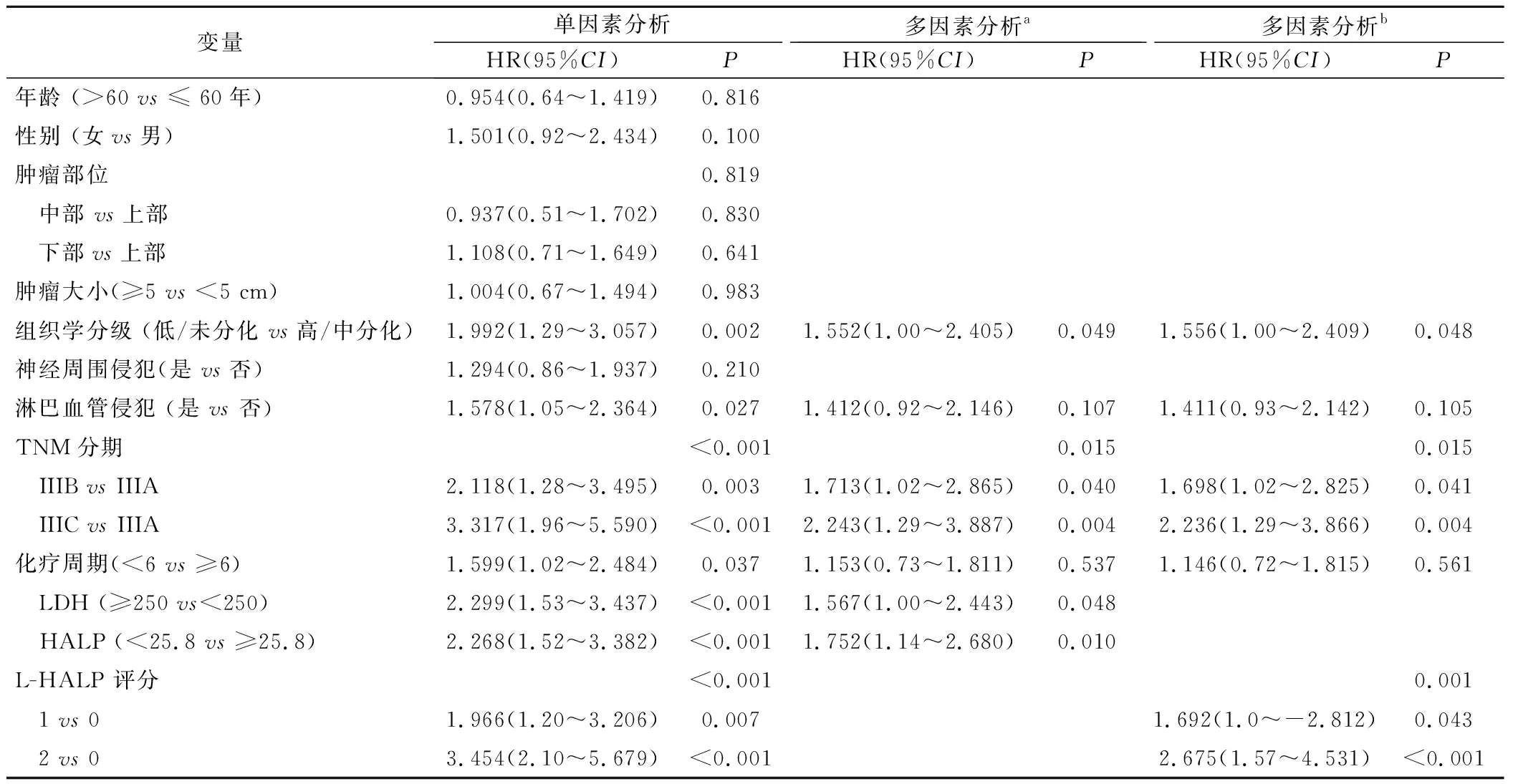
表1 胃癌患者总生存期的单因素和多因素Cox回归分析Table 1 Univariate and multivariate Cox regression analysis of overall survival of gastric cancer patients
2.3 LDH、HALP、L-HALP评分与III期胃癌临床病理特征相关性 LDH水平升高和HALP降低患者与手术年龄较大(P=0.011和P=0.024)、TNM分期较晚(P<0.001和P=0.018)和化疗周期短(P=0.003和P=0.004)有关。此外,分析L-HALP评分与临床病理特征之间的关系发现,高L-HALP评分患者与手术年龄较大(P=0.003)、TNM分期较晚(P=0.001)、化疗周期短(P<0.001)有关,见表2。
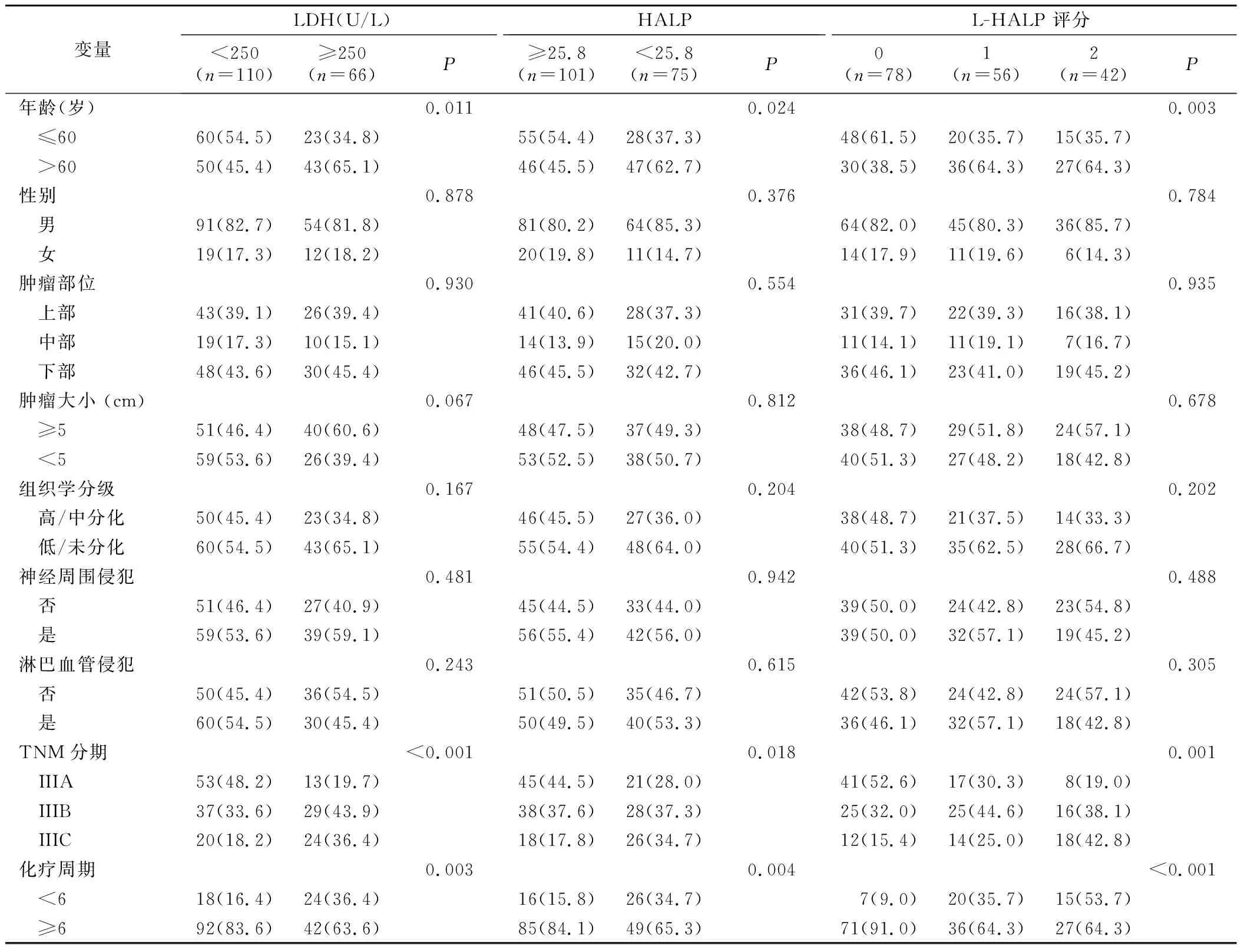
表2 术前LDH、HALP和L-HALP评分与临床病理资料的关系[n(×10-2)]Table 2 Relationship between preoperative LDH, HALP and L-HALP scores and clinicopathological data
2.4 列线图预测模型的建立 为进一步评估L-HALP评分的临床实用性,本研究基于Cox多因素分析中的独立预后因素为依据,包括L-HALP评分、TNM分期、组织学分级,应用R软件构建预后Nomogram 图(见图3)。在Nomogram图中,每个因素都被赋予一个加权分数,根据对应得分估计1、3、5年生存率,总分较高的III期胃癌患者的预后更差,模型的内部验证结果显示C-index为0.705,提示该模型有良好的区分度。

图3 预测胃癌患者术后1、3、5年OS的列线图预测模型Figure 3 Columnar graph prediction model for predicting 1-year, 3-year and 5-year OS after surgery in patients with gastric cancer
3 讨论
本研究结果提示,由术前LDH和HALP(血红蛋白、白蛋白、淋巴细胞和血小板)组成的L-HALP评分是接受根治性手术并行辅助化疗的III期胃癌患者的独立预后因素。还发现高L-HALP评分与患者年龄较大、TNM分期较晚、化疗周期短有关。此外,还将L-HALP评分与其他独立预测因素相结合,建立了III期胃癌患者的预后模型,该模型的C-index值为0.705,具有一定的预测准确性。因此,L-HALP评分作为一个简单有效的预测指标,可以帮助临床医生综合评估患者的预后提供一种方法。
据报道[11],乳酸脱氢酶是参与无氧糖酵解过程中丙酮酸转化为乳酸所必需的关键酶,恶性肿瘤在异常增殖时,不论氧气是否充足,肿瘤细胞均先通过糖酵解途径满足自身快速增长繁殖的能量需求,这种现象也被称Warburg效应。LDH在细胞代谢过程中受转录因子Myc(c-Myc)和缺氧诱导因子1-α(Hypoxia Inducible Factor 1 α,HIF1-α)的调节,还可通过磷脂酰肌醇三羟基激酶/丝氨酸苏氨酸激酶/雷帕霉素靶蛋白(Phosphatidylinositol 3 kinase/Akt/mammalian target of rapamycin,PI3K/ Akt/mTOR)通路促进编码糖酵解酶的基因转录,增加体内酸性肿瘤微环境的形成[12-13]。这种酸性环境又可通过降解细胞外基质大量释放血管内皮生长因子(VEGF),促进肿瘤自身的增殖、侵袭和转移[14]。因此,高LDH患者的往往预后较差,并在多种实体瘤中已得到证实,如Uehara等[15]研究认为高LDH水平提示行根治性放疗的口咽癌患者生存率低;Su等[16]研究表明术前高LDH是膀胱癌患者的预后不良因素。本研究发现高LDH组患者OS较低组显著缩短,与既往研究结果相符。此外,LDH还可调控细胞自噬,在恶性肿瘤治疗中有望成为一种极具希望的新靶点[17-18]。如在肾透明细胞癌患者中,血清高LDH的患者更可能从TORC1抑制剂替西罗莫司中受益[19];激素受体阳性乳腺癌患者应用LDH-A抑制剂或干扰LDH-A后,增加耐药的乳腺癌细胞对他莫西芬的敏感性[20]。Liang等[21]研究发现抑制MYC-LDHA 轴可降低LDH活性、减少葡萄糖摄取从而促进前列腺癌细胞凋亡。
有研究[22-23]发现营养状况、炎性细胞和免疫反应与癌症患者预后密切相关。HALP是衡量机体营养、炎症及免疫状态的综合指标,Hb、ALB及Lym细胞降低及PLT升高提示可能与肿瘤较差的预后有关[24]。高水平HALP胃癌患者预后较差可能与以下机制相关:首先,恶性肿瘤是慢性消耗的过程,大约三分之一的癌症患者在诊断时患有癌症相关性贫血,约20%的肿瘤相关性死亡是由恶病质造成的[25]。血红蛋白和白蛋白水平是评价营养状况的标志,肿瘤细胞分泌的肿瘤坏死因子-α和白细胞介素-6(IL-6)可通过改变造血环境降低Hb水平,ALB渗透性高易被肿瘤细胞内化,炎症也会抑制ALB合成,导致体内ALB水平减低[26- 27]。其次,Lym参与机体的免疫应答,不仅抑制肿瘤的生长,同时也使肿瘤朝着低免疫原性方向发展,Lym减少往往代表了宿主对恶性肿瘤的免疫反应受损,抗肿瘤Lym作用减弱[28]。最后,PLT通过分泌多种相关因子(血管内皮生长因子、PLT活化因子、PLT衍生生长因子)促进肿瘤侵袭和转移,PLT还可保护癌细胞免受免疫攻击[29]。目前该指标已用于预测多种恶性肿瘤的预后,Xu等[30]研究发现,术前低水平的HALP与胰腺癌患者早期复发和较差的OS有关,是预后的独立危险因素;一项包括1332例胃癌切除患者的研究表明,术后HALP评分与临床特征密切相关,HALP≥56.8组的患者预后均明显优于HALP <56.8组患者[7]。本研究与其不同的是, HALP的最佳截断值较小为25.8,这可能与本研究纳入人群均为III期,分期相对较晚有关,尽管临界值不尽相同,但研究结果具有相似性。本研究发现,术前乳酸脱氢酶水平和HALP是III期胃癌患者OS的独立预后因素。因此,本研究创建了由血清乳酸脱氢酶水平和HALP组成的L-HALP评分。与既往研究发现一致,本研究证明高乳酸脱氢酶水平和低HALP(L-HALP评分2)预后较差。
列线图通过整合有价值的预后参数来计算结局事件发生的概率,一些参数的组合应用甚至比传统的TNM分期系统更可靠,在肿瘤的个体化治疗发挥着重要作用[31-32]。本研究将Cox回归模型中L-HALP、TNM分期、组织学分级3项独立危险因素进行整合,建立行根治性切除III期胃癌患者的Nomogram图,可以更直观地综合评估患者的预后生存,细化胃癌患者的危险分层。
然而,本研究也存在一定局限性:第一,这为单中心回顾性研究,且样本量较少,难免存在选择偏倚,未来仍需大规模、前瞻性研究加以验证;第二,本研究未将无病生存期纳入预后分析,其结果可能会增加新的发现;第三,L-HALP仅是术前的一个时间节点评估,在患者整个癌症治疗周期中L-HALP的变化可能对预后有更显著的影响;第四,本研究建立的列线图仅进行了内部验证,缺乏外部验证,期待未来进一步多中心验证。
4 结论
本研究结果提示,术前L-HALP评分是根治性切除III期胃癌患者预后的独立标志物,基于L-HALP评分的列线图模型具有较好的预后性能,且其方便获得、经济有效,在一定程度上可为III期胃癌患者个体化治疗策略和随访提供参考。

