2024 年GOLD 慢性阻塞性肺疾病诊断、治疗、管理及预防全球策略更新要点解读
陈典,隆寰宇,李姝润,陈亚红
100191 北京市,北京大学第三医院呼吸与危重症医学科
2024 年慢性阻塞性肺疾病全球倡议(global initiative for chronic obstructive lung disease,GOLD) 是2023 年GOLD 的修订版,新增2022 年1 月—2023 年7 月的148 篇参考文献,其中10 篇来自中国学者的研究,于主题为“肺系生命,刻不容缓”的“第22 个世界慢阻肺日”(2023-11-15)前发布[1-3]。总体来说,GOLD 2024 共分为6 章,在形式上原第3 章(预防和维持治疗的支持证据)和第4 章[稳定期慢性阻塞性肺疾病(以下简称慢阻肺)的管理]合并为第3 章(慢阻肺预防与管理)以去除重复内容。重要的内容变化之处在于修订和增加了10 个方面:(1)扩充保留比值肺功能受损(PRISm)的概念;(2)增加肺过度充气的部分;(3)肺功能章节增加吸入支气管舒张剂前进行肺功能检查的说明;(4)增加慢阻肺目标人群筛查的部分;(5)在慢阻肺初始评估部分,更新血嗜酸性粒细胞计数的说明;(6)更新间质性肺异常部分;(7)修订戒烟部分;(8)对慢阻肺患者的推荐疫苗进行更新,与目前美国疾病控制与预防中心(CDC)的指南保持一致;(9)扩充吸入性治疗的管理部分,包括患者正确使用递送装置的能力以及如何选择吸入装置;(10)新增戒烟药物治疗[1]。本文介绍GOLD 2024 的关键点及更新要点。
1 定义和概述
1.1 关键点与更新要点
1.1.1 关键点:(1)慢阻肺是一种异质性疾病,其特征为由气道(支气管炎、细支气管炎)和/或肺泡异常(肺气肿)所致的慢性呼吸道症状(呼吸困难、咳嗽、咳痰、急性加重),引起持续进行性加重的气流受限。(2)慢阻肺的危险因素为遗传基因(G)-环境因素(E)-全生命期事件(T)(GETomics),会造成肺组织破坏,改变肺正常发育或衰老过程。(3)慢阻肺的主要环境暴露因素是烟草烟雾、吸入室内外空气污染有毒颗粒和气体,但其他环境和宿主因素(包括肺发育异常和加速衰老)也可以促进慢阻肺的发生。(4)慢阻肺最相关(但罕见)的遗传因素是SERPINA1 基因突变导致α1抗胰蛋白酶缺乏(AATD),其他基因突变与肺功能下降和慢阻肺发生风险相关,但其相应的效应值较小。(5)根据慢阻肺定义、危险因素,肺量计检查吸入支气管舒张剂后第1 秒用力呼气容积/用力肺活量(FEV1/FVC)<0.7 提示存在不完全可逆的气流受限,即确诊慢阻肺。(6)有些患者可能有呼吸系统症状和/或肺结构破坏(肺气肿)和/或生理异常(如FEV1下降、气体陷闭、过度充气、弥散功能下降)和/或FEV1快速下降,但不存在气流受限(吸入支气管舒张剂后FEV1/FVC ≥0.7),这些患者归属于慢阻肺前期,PRISm 用于筛选比值正常但肺通气功能异常的患者;这两部分人群是发生气流受限的高危人群,但并不是所有的患者会发生气流受限。(7)慢阻肺典型症状为呼吸困难、活动受限,和/或咳嗽伴或不伴有咳痰,可伴有呼吸症状的急性恶化,称为慢阻肺急性加重,需要给予预防与治疗策略。(8)慢阻肺患者常存在其他共患病,影响疾病状态和预后,并需要针对性治疗。共患病与急性加重表现类似,并会促进急性加重发生。(9)慢阻肺是常见的可防、可治的疾病,但存在严重的漏诊和误诊,导致未及时治疗或不恰当治疗。早期正确诊断慢阻肺具有重要的公共卫生意义。(10)生命早期暴露,包括烟草、烟雾在内的其他环境因素,会影响青年人慢阻肺的发生、发展,关注慢阻肺前期和PRISm 有助于疾病预防、早期诊断并给予迅速恰当的干预治疗。
1.1.2 更新要点:GOLD 2024 重新绘制了图1,更新了生命进程中的FEV1轨迹变化,同时扩充了PRISm 的概念并增加了关于肺过度充气的部分。

图1 生命进程中的FEV1 轨迹Figure 1 FEV1 trajectories over the life course
1.2 肺功能轨迹:发育和衰老
人出生时,肺部尚未发育完全。肺的生长和成熟延续至20~25 岁(女性更早),此时肺功能达到巅峰(图1)[4]。随后是尚不太明确但相对较短的平台期,最后是由于肺生理性衰老导致的轻度肺功能下降阶段。这种正常肺功能轨迹可被妊娠期、出生期、儿童期和青春期发生的影响肺生长(继而影响肺功能峰值)的过程,和/或缩短平台期和/或加速衰老期(继而随着年龄的增长,肺功能下降的正常速率加快)的过程所改变。
经由肺量计检查测得的肺功能峰值降低可用于识别慢阻肺风险增加的个体。一项大型研究和荟萃分析证实出生体重与成年期FEV1呈正相关[5]。生命早期的“童年期不利因素”是成年期肺功能改变的关键决定因素。一项研究评价了3 个独立的纵向队列(Framingham、Copenhagen 和Lovelace 研究),发现约50% 的患者FEV1随时间加速下降直至罹患慢阻肺(传统的Fletcher和Peto 模型)[6],而另外50%的患者因肺生长和发育异常(肺功能随时间正常下降;图1)而罹患慢阻肺[7]。
年龄通常被列为慢阻肺的危险因素,随着年龄增长,肺功能会出现生理性下降。然而,尚不清楚正常衰老是否会导致慢阻肺,以及年龄是否反映了终生累积暴露量的总和。气道和肺实质老化会表现出与慢阻肺相关的一些结构性改变,有证据表明慢阻肺会加速患者衰老[8]。一项对慢阻肺患者随访超过10 年的前瞻性研究显示,端粒(一种衰老的标志物)加速缩短和肺气体交换进行性恶化、肺过度充气、肺外受累之间存在相关性[9]。此外,在相同观察期内,端粒持续缩短会增加全因死亡风险。免疫细胞中与年龄相关的DNA 表观遗传变化也与慢阻肺患者的急性加重和死亡风险增加相关[10]。在塔斯马尼亚纵向健康研究中,混合型(低FVC 和低FEV1/FVC)和单纯阻塞型(低FEV1/FVC)肺功能模式表明,53 岁时慢阻肺患病率最高(分别为37%和22%)[11]。
术语“气道发育不全(Dysanapsis)”系指人体测量学上气道树口径相对于肺容量的不匹配,由TODISCO等[12]于大约50 年前根据健康成人最大呼气流量的变异性首次提出。目前对气道发育不全的起源和临床意义的理解仍然存在很大的空白,但最近使用计算机断层扫描(CT)的研究表明:(1)该病症在一般人群中很常见[13];(2)其与成年早期的FEV1/FVC 相关[14];(3)在健康成年供体的移植肺中,中心气道发育不全(通过CT 可检测到)延伸至外周气道(CT 上不可见)[14];(4)即使不考虑年龄、性别、身高和人种-种族因素,气道发育不全也与基线气流阻塞和发生慢阻肺的风险相关,但与肺功能随时间下降无关[15],该观察结果与以下肺功能轨迹一致:成年早期肺功能峰值较低,随后出现正常的肺功能下降(占老年人慢阻肺的50%)[7];(5)气道发育不全可能促进了阻塞性肺疾病的病理生理进程和雾化药物的沉积[15];(6)气道发育不全的发生机制尚不明确。目前尚不清楚这是否由遗传易感性、宫内暴露于有害颗粒或病原体、早产、低出生体质量、新生儿肺损伤、幼年反复呼吸道感染或多种因素并存所致,但在生命早期影响支气管树生长的因素和在生命晚期影响支气管树稳态的因素与气道发育不良相关联。需要注意的是,为了量化儿童的肺部结构,在研究幼年气道发育不全的病因时需要采用无辐射(或较低剂量辐射)的方法。
因此,引起成年人慢阻肺发生的两大主要生物学机制包括异常肺发育和随年龄增加肺功能下降速率加快,二者可以合并存在。有些人在儿童期肺功能低于正常,而在青春期会逐渐加重;有些成年人早期肺功能超过正常但在吸烟等因素影响下肺功能随时间下降。尽管如此,这些人后期肺功能检查会出现“假性正常”(即存在症状、结构破坏如肺气肿等表现,但肺功能正常)。
1.3 PRISm 概念的扩展
PRISm 描述了一秒率正常(吸入支气管舒张剂后FEV1/FVC ≥0.7)但肺通气功能受损(吸入支气管舒张剂后FEV1<80%预计值)的个体。基于人群的研究发现PRISm 的患病率为7.1%~11.0%[16],而在当前和既往吸烟人群(例如COPD Gene 队列)中,PRISm 的患病率为10.4%~11.3%[17]。PRISm 的患病率在当前和既往吸烟者中尤其高,且与过高BMI 和过低BMI、女性、肥胖以及多种疾病相关。PRISm 与以下风险增加相关:心肺疾病、全因死亡率和心血管死亡率、住院率以及气道阻塞等。
PRISm 并不总是一个稳定的表型。随着时间推移,PRISm 患者的肺功能检查结果可转变为正常或气流阻塞(20%~30%)。从肺功能检查来看,PRISm 转变为慢阻肺最重要的预测因素是基线FEV1%和FEV1/FVC 较低、年龄较大、当前吸烟、女性和第2 次评估中的用力呼气时间较长。尽管有关PRISm 的文献越来越多,但在其发病机制和治疗方面仍存在很大的知识空白。此外,并非所有慢阻肺前期(Pre-COPD)或PRISm 人群随时间的推移最终会出现固定性的气流阻塞(继而发生慢阻肺),但其均应被视为“患者”(因为其已经出现症状和/或功能性和/或结构性异常),因此,这一部分患者应该得到照护和治疗。目前面临的挑战在于还没有证据提示对于这些患者最好的治疗方法是什么。
1.4 肺过度充气
当自主呼气结束时,若肺部气体量高于正常值,即为肺过度充气。肺过度充气与慢阻肺患者的临床表现具有相关性,并导致慢阻肺患者呼吸困难、运动耐量受损、住院风险增加、呼吸衰竭和死亡风险增加。在慢阻肺患者中,由于肺部弹性减退和呼气气流阻塞,会出现肺过度充气。当自主呼吸过程中产生的呼气流量达到该肺容量可产生的最大流量时,就会发生呼气气流阻塞。呼气气流阻塞是由肺实质破坏(肺气肿)和气道异常(如黏液阻塞、气道水肿、支气管张力增加、气道壁重塑)的双重作用所引起。当通气需求增加且呼气时间减少时,在静息时(肺气肿引发的肺弹性回缩力丧失而导致静态过度充气)和/或运动期间(由于气流阻塞而导致动态过度充气),会发生肺过度充气。
肺过度充气在慢阻肺患者中很常见,甚至在静息状态有轻度阻塞的患者中也可见,而运动状态下更为常见。在中重度阻塞患者中,与FEV1相比,动态过度充气水平与弥散能力受损、小气道阻塞严重程度以及对运动的更高通气反应的相关性更强。
通过体积描记法或气体稀释法(氦稀释或氮冲洗)评估的肺容量是评估肺过度充气是否存在和严重程度的参考指标。然而,由于测量可压缩气体体积或连通气体体积的差异,数值可能会存在不同。静息和运动状态下吸气量的测量是呼气末肺容量增加的间接指标,表明存在静态和/或动态过度充气。胸部成像也可以检测到肺过度充气,但缺乏标准化。
肺过度充气可通过支气管舒张剂、氧疗、氦氧混合气、肺康复、缩唇呼吸以及吸气肌训练来治疗,或对导致严重过度充气的肺气肿患者采用肺减容术或支气管镜肺减容术来治疗。
2 诊断和初始评估
2.1 关键点与更新要点
2.1.1 关键点:(1)存在呼吸困难、慢性咳嗽或咳痰,有复发性下呼吸道感染史和/或有接触该疾病危险因素史的患者均应考虑慢阻肺。肺功能检查是确诊慢阻肺的必备条件,如FEV1/FVC<0.70,可确定存在持续气流受限。(2)慢阻肺评估的目标在于确定气流受限程度、疾病对患者健康状况的影响和远期不良风险(如慢阻肺急性加重、住院或死亡),从而指导治疗。(3)经初始治疗仍有持续症状的慢阻肺患者应该进一步评估肺功能,包括测定肺容积、弥散功能、运动试验和/或胸部影像。(4)慢阻肺患者常合并心血管疾病、骨骼肌功能障碍、代谢综合征、骨质疏松、抑郁、焦虑、肺癌等多种慢性病(合并症)。不管慢阻肺气流受限程度如何,这些合并症均影响患者住院和死亡。因此,对慢阻肺患者均应积极寻找合并症,并给予正确治疗。
2.1.2 更新要点:GOLD 2024 强调了吸入支气管舒张剂前的肺功能检查、慢阻肺目标人群筛查,更新了关于血嗜酸性粒细胞计数的说明以及影像学部分肺间质异常的内容。GOLD 2024 慢阻肺诊断和评估的流程如图2 所示。

图2 2024 年GOLD 中慢阻肺的ABE 分级Figure 2 ABE assessment tool in 2024 年GOLD
2.2 吸入支气管舒张剂前的肺功能检查
GOLD 指南既往推荐使用吸入支气管舒张剂后的肺功能指标来诊断慢阻肺,认为这些指标更适合用于诊断是否发生气流受限且可重复性高,并且可以用于排除哮喘。然而,现在人们认识到,针对支气管舒张剂的反应在区分哮喘和慢阻肺上几乎没有诊断价值,而吸入支气管舒张剂前的肺功能指标重复性更高,且气道阻塞在吸入支气管舒张剂后并不常见。检测吸入支气管舒张剂后的肺功能指标更加耗时,可能会妨碍医生开具肺功能检查。最新版GOLD 指南指出,吸入支气管舒张剂前的肺功能检查可以用于初步评估有临床表现的患者是否存在气流受限。如果吸入支气管舒张剂前肺功能结果未显示气道阻塞,则无需进行吸入支气管舒张剂后的肺功能检查,除非该患者在临床上高度怀疑慢阻肺。在这种情况下,FEV1/FVC 可能<0.7,需要进一步对患者的病因进行调查并随访,包括重复的肺功能检查。如果使用支气管舒张剂前的肺功能结果已经显示有气流受限,则应使用吸入支气管舒张剂后的测定值来诊断慢阻肺。吸入支气管舒张剂前FEV1/FVC<0.7,而吸入支气管舒张剂后FEV1/FVC ≥0.7 的个体未来进展为慢阻肺的风险很大,应密切随访。
2.3 慢阻肺目标人群筛查
美国预防临床服务指南工作组(USPSTF)基于临床试验中无症状或轻度症状慢阻肺患者的系统综述建议不要对无症状个体进行慢阻肺筛查[18]。然而该建议不适用于慢阻肺高风险人群,如每年需要接受低剂量胸部CT(LDCT)以检测肺癌或影像学检查显示肺部异常(如肺气肿、气道壁增厚、支气管扩张)且临床主诉有呼吸系统症状的患者。
2.3.1 利用肺癌成像筛查慢阻肺:USPSTF 建议每年对50~80 岁吸烟史≥20 包年的人群进行LDCT 检查,从而实现对肺癌的早期诊断。临床试验结果表明,每年1次的LDCT 可显著提高患者的生存率[19]。肺癌和慢阻肺有共同的危险因素,慢阻肺也是肺癌的独立危险因素,是影响肺癌患者生存的关键合并症。因此,对接受LDCT 肺癌筛查的个体彻底评估症状并进行肺功能测定是同时筛查患者是否存在潜在慢阻肺症状和气流受限的特别机会。
在肺癌筛查中评估慢阻肺患者症状并进行肺功能检查的研究报告显示,气流阻塞患病率为34%~57%,肺气肿患病率为68%~73%,新诊断的慢阻肺患病率为67%,男性、年龄较小、吸烟时间较短以及无症状与既往未诊断为慢阻肺的气流阻塞有关[20]。既往未诊断出慢阻肺的患者症状轻微,但症状发生率仍较高,超过50%的患者会出现症状。部分研究报道,接受肺癌筛查的慢阻肺漏诊率可达90%[21]。
在肺癌的筛查队列中,超过一半的肉眼可见的肺气肿患者存在气流阻塞[22]。密度定量分析技术也可用于检测慢阻肺,其灵敏度和特异度取决于所选的阈值。在国家肺癌筛查试验(NLST)中,>65 岁的个体中1%定量肺气肿的阈值与女性和男性的灵敏度相关,分别为65%和75%,且特异度分别超过70%和65%[23]。
2.3.2 利用偶然的肺部影像学异常筛查慢阻肺:除吸烟以外,其他因素也会增加慢阻肺患病风险(例如发育、遗传、环境暴露、儿童感染等),此类患者可能会接受胸部影像学检查以评估呼吸道症状。此类人群未曾或很少吸烟,通常年龄较小。与每年接受LDCT 肺癌筛查的人群不同,CT 扫描本身有助于在非肺癌筛查人群中识别慢阻肺风险增加的个体,并提示其可以考虑进行肺功能检查。
肺气肿是慢阻肺的标志之一,通过放射科医生的目视检查或通过定量肺密度,容易在胸部成像中检测到肺气肿。肺部成像还可识别慢阻肺的其他异常指征,包括气体陷闭、气道壁增厚和黏液阻塞。这些异常不仅表明可能存在气流阻塞,而且预示着患者的肺功能会加速下降,生活质量会更差。虽然在临床中通常难以对LDCT数据进行定量分析,但肺气肿和其他气道异常的存在应当引起临床疑诊慢阻肺,并对症状进行详细评估,考虑进行肺功能检查。
目前在肺癌筛查期间偶然发现患慢阻肺的高危患者,或在影像学检查中偶然发现可能提示慢阻肺的肺部异常患者,会错过进行肺功能检查的机会。GOLD 2024建议对接受肺癌筛查的目标患者和偶然发现气道影像学异常的目标患者进一步进行肺功能检查。
2.3.3 更新血嗜酸性粒细胞计数的说明:血嗜酸性粒细胞计数可以用于预测吸入性糖皮质激素(ICS)对未来急性加重事件的预防效果,因此GOLD 指南推荐将血嗜酸性粒细胞计数作为ICS 用药管理的一部分。
慢阻肺患者血嗜酸性粒细胞计数较高,并且与肺部嗜酸性粒细胞数量以及Ⅱ型炎症标志物的表达相关[24]。气道炎症的差异或可解释不同的血嗜酸性粒细胞计数对ICS 治疗的反应差异。在大规模基层就诊的人群中,血嗜酸性粒细胞计数表现出较好的可重复性。尽管在较高的阈值下能观察到更大的差异性,但在较低阈值(例如100 个细胞/μL)下可观察到更好的重复性[25]。血嗜酸性粒细胞计数可帮助临床医生评估规律支气管舒张剂治疗基础上加用ICS 后产生有益预防反应的可能性,因此在做出关于ICS 的使用决策时,可将其用作生物标志物与临床评估结合使用。
2.3.4 肺间质异常:肺实质性纤维化或炎症在吸烟者和非吸烟者的胸部CT 影像中均很常见,而当在未患间质性肺病(ILD)的患者中偶然发现时,则被称为肺间质异常(ILA)。在老年人(>60 岁)中,ILA 的发生率为4%~9%,涵盖从亚临床到临床疾病的多个范围[26]。在4 360 例COPD Gene 受试者中,8% 的人群患有ILA,其中一半符合疑似ILD 的标准,即CT 检查显示明显的纤维化、FVC 低于80%预测值或一氧化碳弥散量(DLCO)低于70%预测值[27-28]。疑似ILD 的患者呼吸道症状和死亡率增加[28]。纤维性ILA(即牵引性支气管扩张、结构扭曲和蜂窝状改变)更有可能发生疾病进展,且与不良结局相关,尤其是合并肺气肿时。鉴于ILA 的临床相关性,多项研究支持对存在上述症状的个体进行临床评估、风险分层和随访监测。
3 慢阻肺的预防和管理
3.1 关键点与更新要点
3.1.1 关键点:(1)戒烟是关键。药物治疗和尼古丁替代疗法确实提高了长期戒烟率。由医疗专业人员提供的立法禁烟和咨询提高了戒烟率。目前,电子烟作为戒烟辅助手段的有效性和安全性尚不确定。(2)慢阻肺治疗的主要目标是减少症状和未来急性加重的风险。(3)稳定期慢阻肺的管理策略应主要基于临床症状和对急性加重史的评估。(4)药物治疗可减轻慢阻肺症状,降低急性加重发生频率和严重程度,改善患者健康状况和运动耐量,延缓肺功能下降速率和降低死亡率。(5)每种药物治疗方案均应根据症状的严重程度、急性加重的风险、不良反应、合并症、药物的可用性和成本以及患者的反应、偏好和使用各种药物递送装置的能力进行个体化指导。(6)需要定期评估吸入技术。(7)新冠疫苗可以有效预防新冠感染,慢阻肺患者应根据国家建议接种新冠疫苗。(8)流感疫苗和肺炎链球菌疫苗可降低下呼吸道感染的发生率。(9)CDC 建议青春期未接种Tdap 疫苗(dTaP/dTPa)的慢阻肺患者应该补接种,预防百日咳、破伤风和白喉的发生,并建议50 岁及以上的慢阻肺患者接种带状疱疹疫苗。(10)肺康复核心内容包括运动训练与健康教育相结合,可改善不同级别严重程度慢阻肺患者的运动能力、症状和生活质量。(11)在严重静息慢性低氧血症[PaO2≤55 mmHg(1 mmHg=0.133 kPa)或<60 mmHg 同时存在肺心病或继发性红细胞增多症]患者中,长期氧疗可提高其生存率。(12)对于稳定期慢阻肺患者和静息或运动引起的中度氧合下降,不应常规进行长期氧疗。但是,在评估患者对补充氧气的需求时,必须考虑患者的个体因素。(13)对于有严重慢性高碳酸血症和急性呼吸衰竭住院史的患者,长期无创通气可降低死亡率并防止再次住院。(14)对于某些内科治疗无效的晚期肺气肿患者,外科手术或支气管镜介入治疗可能获益。(15)姑息治疗是控制晚期慢阻肺症状的有效方法。
3.1.2 更新要点:GOLD 2024 将既往GOLD 指南中的第3 章和第4 章合并到了一起,统称慢阻肺的预防和管理,修订了戒烟部分,更新了室内外空气污染、职业暴露、呼吸道合胞病毒疫苗推荐、吸入治疗管理以及戒烟的药物疗法等方面。GOLD 2024 慢阻肺初始和随访期间药物治疗的原则如图3、4 所示。
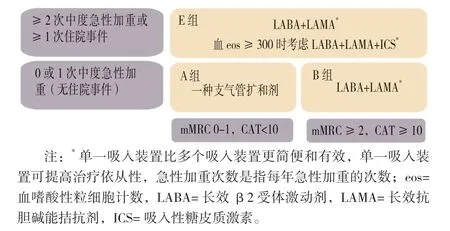
图3 慢阻肺初始阶段的药物治疗Figure 3 Initial pharmacological treatment of COPD
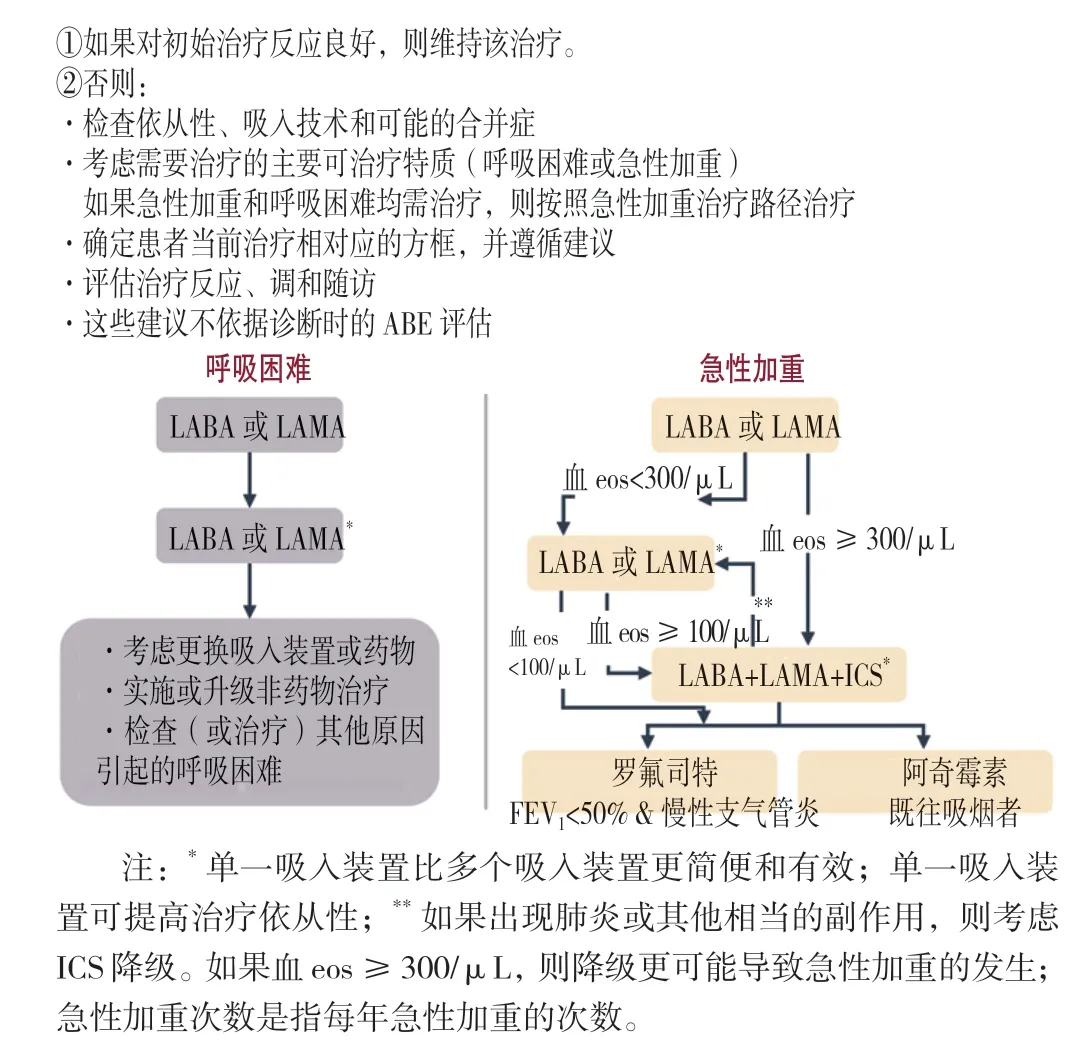
图4 慢阻肺随访期的药物治疗Figure 4 Initial pharmacological treatment of COPD
3.2 修订戒烟部分
戒烟是所有还在继续吸烟的慢阻肺患者的关键干预措施。医疗专业人员在戒烟宣教和进行干预等方面发挥了关键作用,应尽可能利用所有机会鼓励患者戒烟。戒烟对慢阻肺的自然病程影响最大,其还可以改善日常症状,并降低急性加重的频率。相较于未患慢阻肺的吸烟者,戒烟对于患有慢阻肺的吸烟者更具挑战性,因为这类人群对尼古丁的依赖程度更高、自我效能感较低且更缺乏戒烟的自信。此外,抑郁症在患有慢阻肺的吸烟者中更为常见,这可能导致尝试戒烟失败。尽管存在这些不利条件,但如果将有效的时间和资源用于戒烟,长期戒烟率可达14%~27%[29]。
慢阻肺患者的戒烟治疗应根据个人需求和烟草依赖程度进行调整。有证据表明,咨询和药物治疗相结合是慢阻肺患者最有效的戒烟治疗方法[29]。戒烟过程的复杂性很大程度上取决于尼古丁成瘾的程度。因此,应准确评估所有患者的尼古丁依赖性。尼古丁高度依赖的指标包括:起床后30 min 内想要吸烟,夜间吸烟,每天吸烟≥20 支,Fagerström 量表得分为7~10 分,吸烟严重程度指数得分为5~6分[30]。除了采取个人戒烟方法外,立法禁烟令还可以有效提高戒烟率并降低二手烟暴露的危害。
3.3 室内外空气污染
减少家庭和室外空气污染的暴露需要综合运用公共政策、地方和国家资源、文化变革以及患者个人采取的保护措施。减少对生物燃料烟雾的暴露是降低全球慢阻肺患病率的一个关键目标。高效通风、无污染炉灶和类似的干预措施应予以推荐。
3.4 职业暴露
目前尚无研究证明减少职业暴露的干预措施是否也可减轻慢阻肺疾病负担,但建议患者尽可能避免持续暴露于潜在刺激物(如粉尘、烟雾和气体)中。
3.5 呼吸道合胞病毒(RSV)疫苗
CDC、免疫实践咨询委员会(ACIP)和欧盟委员会建议60 岁及以上人群使用新型呼吸道合胞病毒二价融合F 蛋白疫苗[31]和预融合F 蛋白疫苗[32]。严重RSV疾病风险最高的人群包括患有慢性心脏或肺部疾病、免疫功能低下以及住在养老院或长期护理机构的成年人。CDC 估计,每年RSV 在老年人中导致60 000~160 000例住院患者和6 000~10 000 例死亡患者[33]。
3.6 吸入治疗管理
GOLD 2024 将原GOLD 2023 中第3 章节的“吸入治疗相关问题”与第4 章节的“吸入治疗管理”合并成现有第3 章节中的“吸入治疗管理”,并进一步分为了“正确使用给药系统的能力”和“吸入装置的选择”两部分,用于治疗慢阻肺的大多数药物均为吸入药物。因此,正确使用吸入装置对于优化吸入治疗的获益-风险比至关重要。为达成这一目标需选择合适的装置、提供教育、定期检查吸入装置的使用情况,并在必要时再教育和调整装置。
3.6.1 正确使用给药系统的能力:超过2/3 的患者在使用吸入装置时至少会发生1 次错误。尽管不同装置吸入错误的类型和频率因其特征而异,但任何装置都必须加以讲解、示范和定期检查吸入技术。使用给药装置的主要错误与吸气流量、吸气持续时间、协调性、剂量准备、吸入前呼气动作和吸入后屏气相关。使用“回授”方法(要求患者展示如何使用该装置)效果更加,即由药剂师、医生、理疗师和护士指导的干预及非专业的健康指导可改善慢阻肺患者的吸入技术和依从性。
3.6.2 吸入装置的选择:如果患者正在接受吸入治疗并能够正确使用其当前装置,则新的治疗方案最好使用同一装置。若患者无法正确使用当前装置,或没有其他同一装置的适用药物,则应使用系统性的程序选择新的给药装置,并确保患者能够使用该装置。吸入装置的选择取决于药物的可及性、设备的特点、患者的接受能力和偏好以及照顾患者的专业医护人员对正确使用装置的了解和正确使用程度,最终由医生和患者共同决策做出治疗选择。医护人员必须提供适当的教育,包括身体力行的演示、视频或基于正确技术的演示,以及现场验证患者是否掌握吸入技术。定期(最好是每次就诊时)检查患者是否继续正确使用装备至关重要。临床上缺乏安慰剂装置通常限制和阻碍了向患者提供高质量吸入装置的技术指导。鼓励患者将个人使用的装置带去诊所,也是一种有效的选择。
3.7 戒烟的药物疗法
戒烟的药物治疗包括旨在实现长期戒烟的控制药物(尼古丁贴片、安非他酮和伐尼克兰)和快速缓解急性戒断症状的药物(短效尼古丁)。
3.7.1 尼古丁替代产品:尼古丁替代疗法(尼古丁口香糖、吸入剂、鼻腔用喷雾剂、透皮贴剂、舌下片剂或含片)可有效提高长期戒烟率,并且比安慰剂更有效。尼古丁替代疗法经常会引起给药部位的刺激,并可能导致非缺血性胸痛和心悸,因此尼古丁替代疗法的医学禁忌证包括近期心肌梗死或卒中。目前尚不清楚急性冠脉综合征后尼古丁替代治疗的禁忌证,但数据显示应在心血管事件发生2 周后再开始治疗[34]。持续咀嚼尼古丁口香糖所产生的分泌物会被吞咽而非经口腔黏膜吸收,吸收量很少,并可能引起恶心。
3.7.2 电子烟:电子烟是戒烟的有效尼古丁替代疗法。然而,电子烟在戒烟方面的有效性仍存在争议。电子烟对普通吸烟者,但更重要的是对慢阻肺患者等高危人群的长期健康影响,在很大程度上是未知的。
3.7.3 药品:一项有关慢阻肺吸烟者药物控制治疗(尼古丁替代疗法、安非他酮、去甲替林和伐尼克兰)的荟萃分析结果显示,与安慰剂相比,所有药物治疗组(去甲替林除外)增加了戒烟的概率[29]。药物治疗组的长期戒烟率为14%~27%,而安慰剂组为5%~9%[35]。另一项研究显示,与尼古丁贴片(38.2%)相比,伐尼克兰(58.3%)和安非他酮(55.6%)在第9~24 周内的持续戒烟率更高[36]。伐尼克兰和安非他酮显示出相似的疗效,然而,与安非他酮相比,伐尼克兰组的患者每天吸烟更多[36]。
4 慢阻肺急性加重管理
关键点:(1)慢阻肺急性加重定义为14 d 内以呼吸困难和/或咳嗽和咳痰加重为特征的事件。慢阻肺急性加重通常与气道感染、空气污染或其他肺部损伤引起的局部和全身炎症增加相关;(2)由于这些症状并非慢阻肺的特异性症状,应考虑相关的鉴别诊断,尤其是肺炎、充血性心力衰竭和肺栓塞;(3)治疗慢阻肺急性加重的目标是尽量降低当前急性加重的负面影响,并预防后续事件的发生;(4)单用短效β2受体激动剂,联用或不联用短效抗胆碱能药物,推荐为急性加重的初始治疗;(5)应尽快启用长效支气管舒张剂维持治疗,在频繁急性加重和血嗜酸性粒细胞水平升高的患者中,应考虑在双联支气管舒张剂方案基础上加用ICS;(6)对重度急性加重的患者,全身性糖皮质激素可改善肺功能(FEV1)和氧合并缩短恢复时间(包括住院时间),治疗持续时间通常不应超过5 d;(7)当存在相应的临床指征时,可使用抗生素缩短恢复时间、降低早期复发风险、减少治疗失败和缩短住院持续时间,治疗持续时间应为5 d;(8)不建议使用甲基黄嘌呤,因为这会增加不良反应发生风险;无创机械通气是慢阻肺急性呼吸衰竭无绝对禁忌证患者的首选通气方式,因其可以改善气体交换,减少呼吸功和插管,缩短住院天数,提高生存率;(9)急性加重的恢复时间会有差异,通常需要4~6 周,一些患者无法恢复至急性加重前的功能状态。发生一次急性加重后,应开始采取适当措施预防急性加重。
更新要点:GOLD 2024 与GOLD 2023 基本一致。GOLD 2024 有关慢阻肺急性加重严重程度评估和鉴别诊断的流程如图5 所示。
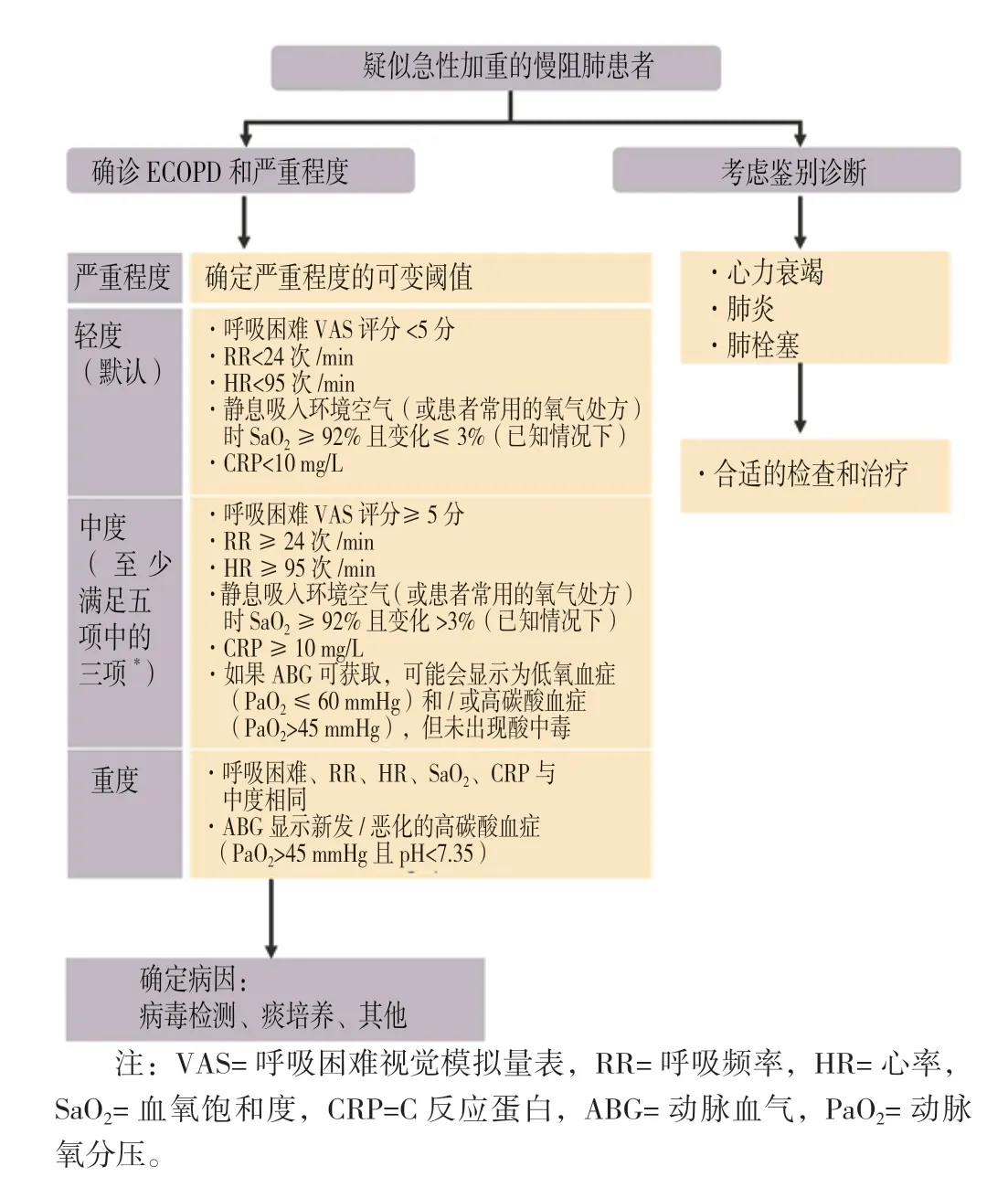
图5 慢阻肺急性加重的严重程度和鉴别诊断流程Figure 5 Severity and differential diagnosis of COPD exacerbations
5 慢阻肺合并症
5.1 关键点与更新要点
5.1.1 关键点:(1)慢阻肺常合并其他疾病,对预后有显著影响;(2)总体来说,合并症的存在不应改变慢阻肺的治疗方案,并且合并症应按照常规标准进行治疗,与慢阻肺的存在无关;(3)心血管疾病是慢阻肺常见且重要的合并症;(4)肺癌在慢阻肺患者中很常见,并且是导致死亡的主要原因。每年应对因吸烟导致慢阻肺的人群进行一次LDCT 筛查肺癌。由于暂无数据确定获益大于危害,因此不建议每年对非吸烟导致慢阻肺的人群进行LDCT 筛查肺癌;(5)骨质疏松和抑郁/焦虑是慢阻肺常见的重要合并症,常被漏诊,并与不良的健康状况和预后相关;(6)胃食管反流(GERD)与慢阻肺急性加重风险增加和健康状况差有关;(7)当慢阻肺是多种疾病治疗计划的一部分时,应注意确保治疗的简洁性,并尽量减少多药治疗。
5.1.2 更新要点:与GOLD 2023 相比,GOLD 2024 在心血管疾病、阻塞性呼吸暂停与失眠和衰弱这3 个合并症中增添了几项研究。
5.2 心血管疾病
一项在无心血管疾病史的慢阻肺患者中进行的大型研究发现,主要心脏不良事件(包括急性心肌梗死、卒中或心血管死亡)的风险增加了25%[37]。该研究是利用加拿大安大略省的卫生行政、药物、实验室、电子病历和其他数据进行的回顾性研究,在2008—2016 年对无心血管疾病史且患或不患有慢阻肺的患者进行了随访,并对心脏危险因素和合并症进行了比较,研究发现,在安大略省约580 万例年龄≥40 岁且无心血管疾病史的人中,有152 125例患有慢阻肺;调整心血管危险因素、合并症和其他变量后,慢阻肺患者的主要不良心血管事件(包括急性心肌梗死、卒中或心血管死亡)发生率比非慢阻肺患者高25%(OR=1.25,95%CI=1.23~1.27)。
5.3 阻塞性睡眠呼吸暂停与失眠
慢阻肺患者的失眠与较高的门诊就诊率和住院率相关[38]。在该研究中,作者调查了慢阻肺患者的失眠与医疗保健利用和费用之间的关联。根据国家退伍军人事务管理局2012—2017 财年的数据,建立了患有慢阻肺的退伍军人回顾性队列。在1 011 646 例被诊断患有慢阻肺的患者中,407 363 例患者(38.8%)患有失眠,调整混杂因素后,失眠与较高的门诊就诊率、住院率以及皮质类固醇和/或抗生素的使用率、较长的住院时间以及12 个月内住院费用增加相关。这些发现强调了治疗失眠对于减轻慢阻肺对患者和医疗保健系统负担的重要性。
5.4 衰弱
一项荟萃分析的结果显示,衰弱和衰弱前期与慢阻肺患者的全因死亡率、急性加重和住院相关[39]。该研究由我国连云港市赣榆区人民医院的团队完成,共纳入了10 项研究,包含了13 203 例慢阻肺患者,衰弱的患病率为6.0%~51.0%,而与非衰弱状态相比,衰弱前期和衰弱状态的全因死亡率的风险比(HR)分别为1.48(95%CI=0.92~2.40) 和2.64(95%CI=1.74~4.02),衰弱前期的全因住院治疗的OR 为1.35(95%CI=1.05~1.74),衰弱期OR 为1.65(95%CI=1.05~2.61);此外,衰弱可显著预测稳定期慢阻肺患者的急性加重(OR=2.20,95%CI=1.26~3.81),但不能预测中度至重度急性加重(OR=1.42,95%CI=0.94~2.17)。然而,全因住院的汇总结果在敏感性分析中并不可靠,即使在调整常见混杂因素后,衰弱仍可显著预测慢阻肺患者的全因死亡率。对慢阻肺患者的衰弱状态进行评估可以促进二级预防和早期干预。
欧洲呼吸学会发表了一篇关于慢性呼吸系统疾病成人衰弱治疗的综述,其中包括老年护理、康复、营养、药物和心理治疗等临床管理方案[40]。衰弱是一种复杂的综合征,其特征是生理储备的丧失,增加了人对不良健康结果的敏感性。大多数关于衰弱的知识都源自老年医学。然而,人们逐渐认识到其作为慢性呼吸道疾病(包括哮喘、慢阻肺和间质性肺病)患者的可治疗特征的重要性,更清楚地了解衰弱及其对慢性呼吸道疾病的影响是未来优化临床管理的先决条件。
6 COVID-19 与慢阻肺
6.1 关键点与更新要点
6.1.1 关键点:(1)慢阻肺患者如果出现新的或加重的呼吸系统症状,如发热和/或任何其他可能与COVID-19 相关的症状,即使这些症状较轻,也应该检查是否可能感染了严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARSCoV-2);(2)患者应按照医嘱继续使用口服和吸入性药物治疗慢阻肺;(3)在社区COVID-19 高流行期,肺功能检查应限制使用,仅限紧急或必须通过检查以诊断慢阻肺的患者,和/或评估介入治疗或手术患者的肺功能状态;(4)保持社交距离和防护,或适当的隔离,不应导致社会孤立和不活动;患者可通过远程沟通手段与朋友和家人保持联系,并继续保持活动,并应该确保他们有足够的药物;(5)应鼓励患者使用权威可信的资源获取有关COVID-19 及其管理的医疗信息;(6)远程(电话/虚拟/在线)对慢阻肺患者进行随访指导,并提供打印清单。
6.1.2 更新要点:针对疑似或确诊为COVID-19 的慢阻肺患者的药物治疗:如果有雾化指征,可以使用雾化治疗;此外,可以使用抗病毒药物、糖皮质激素、免疫调节治疗进行COVID-19 治疗。
6.2 为慢阻肺合并COVID-19 患者提供慢阻肺相关药物治疗
在为疑似或确诊为COVID-19 的慢阻肺患者提供药物治疗时,维持原有的慢阻肺治疗不变,需要确保充足的药物供应,采用与治疗急性加重一致的建议而应用抗生素和口服糖皮质激素。GOLD 2024 补充,必要时雾化治疗可以和个人防护设备一起使用。
ICS 可降低有急性加重史的慢阻肺患者的急性加重风险,但与ICS 使用相关的肺炎风险会增加。实验室研究显示,糖皮质激素可减少抗病毒干扰素(Ⅰ型和Ⅲ型)的产生,导致鼻病毒和流感病毒的复制增加[41]。ICS损害先天性和获得性抗病毒免疫反应,导致病毒清除延迟和黏液分泌增强、抗菌肽分泌受损和病毒引起的急性加重期间肺部细菌负荷增加等不良反应[42]。实验室数据显示,用格隆溴铵或福莫特罗预处理原代人鼻腔和气道上皮细胞可降低病毒RNA 水平和/或滴度、HCoV-229E 受体CD-13 的表达、HCoV-229E RNA 进入细胞质的酸性内体的数量和荧光强度,以及感染诱导的细胞因子[包括白介素(IL)-6、IL-8 和干扰素(IFN)-β]的产生。用3 种药物(格隆溴铵、福莫特罗和布地奈德)组合对细胞进行预处理,对病毒滴度和细胞因子产生具有累加抑制作用。这表明ICS 对COVID-19 具有潜在的保护作用,但尚未得到临床研究的验证[43]。尚无确凿的数据支持为了降低患COVID-19 的风险或反过来因为担心药物治疗可能会增加发生COVID-19 的风险,而改变慢阻肺的药物维持治疗。同样,尚无关于慢阻肺患者使用长效支气管舒张剂、LAMA 或LABA、罗氟司特、大环内酯类药物和SARS-CoV-2 感染的临床结局/风险相关的数据。因此,除非有证据支持,否则这些患者应继续使用上述治疗慢阻肺所需的药物。
雾化治疗可增加气溶胶生成和疾病传播的风险,现已证实SARS-CoV-2 可在气溶胶中存活达3 h[44]。此外,有研究报道,SARS-CoV-2 会传播给接触过接受雾化治疗的 COVID-19 住院患者的医护人员[45]。因此在为患者提供雾化治疗时,医护人员应该佩戴个人防护装备(PPE)。
6.3 为慢阻肺合并COVID-19 患者提供COVID-19 的药物治疗
在为疑似或确诊为COVID-19 的慢阻肺患者提供COVID-19 治疗时,可以使用抗病毒药物、糖皮质激素和免疫调节剂。针对COVID-19 治疗的随机临床试验重点关注抗病毒治疗和抗炎治疗。一些药物对治疗重症COVID-19 住院患者产生了积极结果,包括全身性糖皮质激素。目前的研究缺乏慢阻肺患者的亚组数据及分析,推荐患有COVID-19 的慢阻肺患者应接受与其他COVID-19 患者相同的标准治疗,包括使用抗病毒药物、糖皮质激素、IL-6 受体阻滞剂和巴瑞替尼。
7 “中国好声音”
值得一提的是,GOLD 2024 新增引用的148 篇文献中,有10 篇文献来自中国的研究团队,在国际平台上发出了“中国好声音”。这10 篇文章覆盖了慢阻肺的流行病学、诊断、治疗等各个方面,为GOLD 2024 的更新提供了强有力的证据支持。陈彦凡教授团队基于2019 年GBD 的数据发现,慢性呼吸系统疾病仍然是全球患病率、死亡率和DALY 的主要原因。自1990 年以来,慢性呼吸系统疾病的绝对数量有所增长,但在一些年龄标准化估计量中有所下降[46]。王召军教授团队同样基于2019 年GBD 的数据发现,社会经济地位差异造成的健康不平等正在加剧,全球财富日益集中可能会加剧与慢阻肺相关的健康差异[47]。曹超教授团队研究结果表明,二手烟暴露与慢阻肺患病风险相关,尤其是对于长期暴露于二手烟的个体[48]。钟南山院士团队发现慢阻肺评估以鉴定未诊断肺部疾病及恶化风险问卷(CAPTURE)可以敏锐识别因症状加重或急性加重/住院风险增高而需要干预治疗的慢阻肺患者,且CAPTURE 还可以排除不需要治疗的群体[49]。范钰教授团队的荟萃分析结果显示,慢阻肺患者的虚弱状态与全因死亡率、急性加重以及住院风险密切相关[39]。杨克虎教授团队评估了电子烟和尼古丁替代疗法在戒烟方面的有效性和安全性,发现电子烟在6 个月连续戒断率和7 d 点戒断率上均优于尼古丁替代疗法[35]。李有教授团队则深入研究了呼吸道合胞病毒相关住院率和死亡率负担的年龄谱,发现仅依赖于实验室检查记录的呼吸道合胞病毒疾病负担在5 岁年龄组中可能存在严重少报[33]。林佩瑾教授团队综述了早期肺康复对慢阻肺急性加重住院患者的影响,发现早期肺康复可以显著改善慢阻肺患者的再入院率[50]。张晓慧教授团队则综述了不同干预措施对慢阻肺患者戒烟的影响,发现行为疗法和药物疗法的结合对帮助慢阻肺患者戒烟最为有效。研究人员应更多关注药物治疗干预措施的安全性[51]。吴娴波教授团队则在一项大型前瞻性队列研究中探讨了PRISm 与心血管事件预后的关系,发现PRISm 个体有较高的心血管疾病风险,而从PRISm 过渡到正常结果的个体与肺功能正常的个体表现出相似的心血管疾病风险[52]。感谢以上各位中国的专家学者,为推动慢阻肺的“促防诊控治康”做出了宝贵的贡献!
8 总结
GOLD 2024 与GOLD 2023 相比,基本框架进行了较大调整,重要更新主要集中在前3 章中。原有的第3章“预防和维持治疗的支持证据”和第4 章“稳定期慢阻肺的管理”合并为现有的第3 章“慢阻肺的预防和管理”,围绕戒烟、疫苗接种和吸入治疗进行了相应的补充和修订。戒烟方面补充了相关的药物治疗说明以及现有文献的证据支持,强调了对电子烟使用应持有谨慎态度。疫苗接种方面与目前美国CDC 的指南保持一致,新增了接种RSV 疫苗的说明。吸入治疗方面极大扩充了原有的内容,并相应分为了两个部分,包括如何教导患者正确使用给药系统以及选择合适的吸入装置,体现了GOLD 2024 对确保患者正确进行吸入给药的重视。此外,GOLD 2024 在慢阻肺定义、诊断和评估方面也进行了更新和修订。自GOLD 2023 首次写入PRISm 概念后,GOLD 2024 对其进一步扩展,更新了PRISm 的患病率数据并强调对这一部分人群的治疗和管理。其次,GOLD 2024 新增对肺过度充气的说明,补充了既往对这一病理生理改变认识的不足。肺功能方面则打破了既往对吸入支气管舒张剂后肺功能指标的固定认知,提出在临床上应用吸入支气管舒张剂前的肺功能检查,以提高慢阻肺的检出率。此外,为提高对慢阻肺人群的筛查效率,GOLD 2024 推荐尽可能地利用LDCT 检查机会筛选潜在的慢阻肺患者,包括利用肺癌成像筛查慢阻肺以及利用偶然的肺部影像学异常筛查慢阻肺。既往GOLD 指南围绕血嗜酸性粒细胞异常与慢阻肺的关系已经进行了反复强调和说明,GOLD 2024 进一步补充了相应临床研究的证据支持。最后,在影像学方面,GOLD 2024 新增了有关肺间质异常的内容,强调对这一部分患者进行临床评估和随访检测。可以看出,GOLD 2024 在提高慢阻肺筛查率方面做了极大的更新和补充,为日后对慢阻肺患者的预防和管理指明了方向。
作者贡献:陈典负责指南解读及论文撰写;隆寰宇负责修改论文及核对文献;李姝润负责参考文献整理及核对;陈亚红负责论文指导和修改,对论文负责。
本文无利益冲突。

