约氏疟原虫红内期不同发育阶段虫体蛋白电泳分析
乔继琛 张玲红 陈艳丽 倪艺轩 崔令花

【摘要】 目的 探討约氏疟原虫红内期不同发育阶段虫体蛋白电泳差异情况。方法 采用约氏疟原虫17XNL虫株感染6~8周龄昆明小鼠,制备疟疾小鼠模型;每天尾静脉采血计数小鼠红细胞疟原虫感染率。待疟疾小鼠红细胞感染率达到10%以上,将小鼠摘眼球取血滴入肝素管抗凝,后经过白细胞滤器滤除白细胞。将含虫红细胞分为混合阶段组(对照组)和不同发育阶段组,不同发育阶段组红细胞通过Percoll分离液分离为裂殖体组和滋养体(含大、小滋养体)组。分别裂解3组疟原虫虫体,获得虫体蛋白;测定蛋白浓度后每孔上样20μg总蛋白,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分析;并对差异蛋白条带进行灰度值检测。结果 使用Percoll分离液可以分离出滋养体、裂殖体阶段疟原虫虫体,不同发育阶段可溶性虫体蛋白条带数量差异不明显;有7个蛋白条带差异肉眼可见。其中,3个蛋白混合阶段、滋养体阶段、裂殖体阶段蛋白表达量均由高逐渐减低;3个蛋白混合阶段、滋养体阶段、裂殖体阶段蛋白表达量均由低逐渐增高;1个蛋白滋养体阶段表达量最高,混合阶段次之,裂殖体阶段最低。结论 使用Percoll分离液可以分离出不同发育阶段疟原虫,不同发育阶段可溶性蛋白在蛋白表达量上有一定差异,为后续不同发育阶段虫体蛋白研究奠定基础。
【关键词】 约氏疟原虫;红内期;不同发育阶段;虫体蛋白;电泳分析
中图分类号 R381 文献标识码 A 文章编号 1671-0223(2024)07--04
Electrophoretic analysis of parasite proteins in different developmental stages of Plasmodium Yoelii Qiao Jichen, Zhang Linghong, Chen Yanli, Ni Yixuan, Cui Linghua. Department of Basic Medical Science, Jiangxi College of Traditional Chinese Medicine, Fuzhou 344000, China
【Abstract】 Objective To investigate the difference of parasite protein electrophoresis in different developmental stages of Plasmodium Yoelii. Methods Kunming mice aged 6-8 weeks were infected with 17XNL strain of Plasmodium yoelii and the malaria mouse model was prepared. The infection rate of plasmodium in mouse red blood cells was counted by daily tail vein sampling. When the red blood cell infection rate of malaria mice reached more than 10%, the mice were removed from the eyeballs and blood was dropped into the heparin tube for anticoagulation, and then the white blood cells were filtered through the white blood cell filter. The red blood cells were divided into mixed stage group (control group) and different developmental stage groups, and the red blood cells in different developmental stage groups were separated into schizozoite group and trophoblast group (including large and small trophoblast) by percoll separation solution. Three groups of Plasmodium bodies were cleaved to obtain the body protein. After the protein concentration was determined, 20μg of total protein was taken from each well and analyzed by SDS-PAGE. The gray values of the different protein bands were detected. Results The Plasmodium of trophozoite and schizozoite stages could be isolated with Percoll solution, and the number of soluble plasmodium protein bands was not significantly different at different developmental stages. There were 7 differences in protein bands visible to the naked eye. Among them, the protein expression levels in 3 protein mixing stage, trophoblast stage and schizozoite stage were high and gradually decreased. The protein expression in 3 protein mixing stage, trophoblast stage and schizozoite stage increased gradually from low. The expression level of 1 protein trophoblast stage was the highest, followed by the mixed stage and the lowest in the schizozoite stage. Conclusion Plasmodium parasites at different developmental stages can be isolated with Percoll solution, and there are some differences in the expression of soluble protein at different developmental stages, which lays a foundation for the subsequent study of parasite protein at different developmental stages.
【Key words】 Plasmodium yoelii; Red endopause; Different developmental stages; Insect body protein; Electrophoretic analysis
疟疾是一种严重危害人类生命健康的蚊媒传播疾病,曾在全球范围内多次大规模流行,至今仍是全球关注的三大公共卫生问题之一[1-2]。据WHO统计,2020年全世界约有2.41亿疟疾感染病例和62.70万疟疾死亡病例[3]。据文献报道,自2017年以来我国已连续5年无本土疟疾病例发生,但输入性疟疾发病率明显增高[4]。因此,国内外疟疾防控工作依然面临着严峻挑战。疟原虫是疟疾的病原体,在终宿主按蚊体内进行配子生殖和孢子生殖,在中间宿主人体的肝细胞和红细胞内进行无性生殖。疟原虫在红细胞内寄生时期简称为红内期,该时期是疟原虫主要的生存和致病阶段[5]。在红内期,疟原虫裂殖子侵入红细胞,在红细胞内摄取血红蛋白为营养进行生长发育;经过小滋养体期、大滋养体期、裂殖子期,最终形成多个裂殖子胀破红细胞,裂殖子在侵入新的红细胞进行下一轮的生长发育[6]。红内期疟原虫对人体损伤较大,患者会出现周期性的寒战发热,伴有不同程度的贫血和脏腑功能损伤,严重可导致孕妇流产和患者死亡[7]。近年来随着分子生物学和免疫学技术方法的进步,特别是CRISPR/Cas9基因编辑技术的使用,疟原虫基因功能和表观遗传学的研究取得了较大进展[8]。但现阶段,对于疟原虫的免疫逃避机制、抗药性虫株产生机理和疟原虫侵入红细胞的具体作用蛋白等方面尚不明确。因此,发掘疟原虫的关键功能蛋白至关重要。
以感染小鼠的约氏疟原虫作为研究对象,通过腹腔接种小鼠复苏并培养约氏疟原虫,对疟原虫进行高度同步化培养后大量制备红内期不同发育阶段虫体蛋白。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析各个时期疟原虫可溶性虫体的表达差异情况,进而筛选出差异表达的相关功能蛋白,为红内期疟原虫生长发育、致病机理以及后续疫苗研究和药物研发奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 昆明小鼠10只,6~8周龄,雌雄随机;购于江苏省常州市实验动物中心。约氏疟原虫17XNL虫株由蚌埠医学院方强老师课题组惠赠,本实验室保种。
1.1.2 仪器与试剂 非接触式超声波细胞粉碎机(SCIENTZ 08-III)购自宁波新芝生物科技股份有限公司;超微量紫外分光光度计(NanoDrop? One/OneC)购自美国Thermo公司;蛋白凝聚成像系统购自美国伯乐公司。白细胞滤器、Percoll分离液购自生工生物工程(上海)股份有限公司;红细胞裂解液、蛋白酶抑制剂、SDS-PAGE电泳上样缓冲液、蛋白maker、蛋白胶配制试剂等均购自上海碧云天生物技术有限公司;磷酸盐缓冲液(PBS)、蛋白脱色液等试剂为实验室配制,均为国产分析纯。
1.2 实验方法
1.2.1 制备疟疾小鼠模型 从超低温冰箱取出保存的约氏疟原虫17XNL虫株,进行疟原虫复苏,后续进行传代培养。使用1×106个约氏疟原虫17XNL虫株腹腔注射感染小鼠,制备疟疾小鼠模型。
1.2.2 分组取疟原虫虫体、制备虫体蛋白 每日对疟疾小鼠模型进行尾静脉采血、制作血涂片染色并通过显微镜油镜镜检,观察小鼠疟原虫的感染情况,计数小鼠红细胞疟原虫感染率,待感染率>10%将小鼠摘眼球采血,收集到肝素抗凝管。将抗凝管内红细胞充分混匀,加入等体积PBS稀释1倍后,使用白细胞滤器滤除白细胞。将过滤后的红细胞充分混匀按1∶3的比例分到两个试管,量少的即为混合阶段组。将量多的一组使用50%percoll分离液分离,3100rpm離心20分钟,离心结束后小心取出,吸取中间层红细胞,即为含裂殖体红细胞;底层为滋养体红细胞。分别使用PBS清洗3组含虫红细胞,并分别取2μl制作血涂片染色观察。后使用红细胞裂解液裂解3组含虫红细胞,12000rpm离心5分钟,后使用PBS多次离心清洗至上清液由红色变成无色澄清。去除上清液,底部即为黑色虫体。根据疟原虫数量加入适量PBS溶液和蛋白酶抑制剂,反复冻融2次后,使用非接触式超声波细胞粉碎机裂解疟原虫(参数:超声功率400W,超声9秒,暂停4秒,共9个循环)。裂解后的疟原虫12000rpm离心5分钟,上清液即为疟原虫可溶性虫体蛋白。
1.2.3 SDS-PAGE电泳分析 使用超微量紫外分光光度计分别测量3组不同阶段的疟原虫虫体蛋白浓度,根据每孔均上样8μl(含20μg总蛋白)调整上样体系,加入蛋白上样缓冲液,使用PBS补充上样标本溶液。标本液充分混匀,瞬时离心后使用99℃、10分钟使样品蛋白变性。瞬时离心后常规上样maker和标本,使用12%分离胶,100V恒压进行SDS-PAGE电泳分析。电泳结束后切去分离胶及多余部分,使用考马斯亮蓝快速染液染色30分钟,后使用脱色液在摇床70rpm脱色2小时。脱色完成后,使用蛋白凝聚成像系统进行成像;使用Iamge J1.80软件进行条带灰度值对比,检测相应蛋白表达差异情况。
2 结果
2.1 不同阶段疟原虫镜检
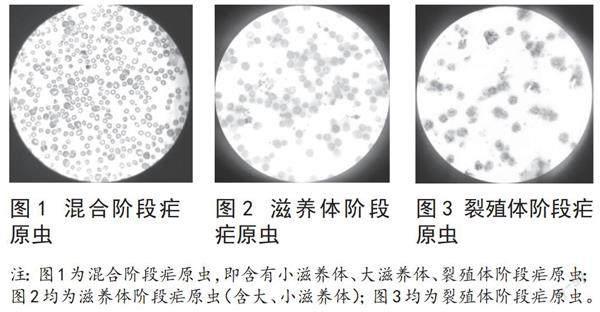
分别取混合阶段组、滋养体组、裂殖体组含虫红细胞2μl制作血涂片,并进行吉姆萨染色观察;成功获得混合阶段疟原虫,滋养体阶段疟原虫和裂殖体阶段疟原虫,见图1~3。
2.2 不同阶段虫体蛋白SDS-PAGE蛋白电泳分析差异情况
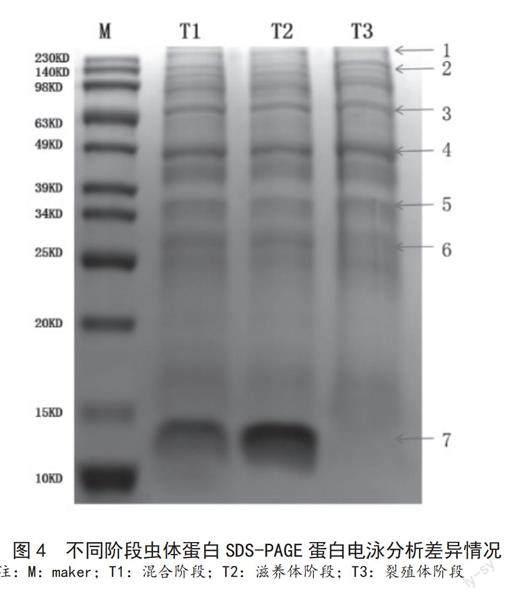
从SDS-PAGE蛋白电泳图谱上来看,肉眼可见的蛋白条带数量有20余条,多数蛋白条带位于25~230KD之间,疟原虫可溶性虫体蛋白分子量高于230KD的有1条,蛋白分子量低于15KD有1条。其中,相对清晰且肉眼可见蛋白表达量有明显差异蛋白有7条,以红色箭头标注并进行编号,见图4。
2.3 蛋白电泳条带灰度值分析
根据蛋白图谱,多数蛋白条带灰度值无明显差异,对肉眼可见蛋白表达量有明显差异且以红色箭头标注编号的7条蛋白进行灰度值检测,其中3、5、6号蛋白混合阶段、滋养体阶段、裂殖体阶段蛋白表达量均由高逐渐减低。1、2、4号蛋白混合阶段、滋养体阶段、裂殖体阶段蛋白表达量均由低逐渐增高。7号蛋白滋养体阶段表达量最高,混合阶段次之,裂殖体阶段最低。见表1。
3 讨论
疟疾是一种由疟原虫感染经按蚊传播的全球性传染病[1],曾在全球多个地区广泛流行传播,病死率较高[2]。关于疟原虫相关蛋白的研究取得了较多成果,有研究显示,恶性疟原虫裂殖子成功入侵红细胞后,在红细胞表面表达恶性疟原虫红细胞膜表面抗原蛋白(PfEMP1),此类蛋白可帮助疟原虫在宿主体内实现免疫逃逸[9]。PfEMP1分子量大小在200~450KD之间,本研究表明在约氏疟原虫裂殖体阶段高表达的蛋白有1、2、4号3个蛋白,可能同样与疟原虫入侵红细胞相关。
据文献报道,通过SDS-PAGE蛋白电泳对5种疟原虫红内期可溶性蛋白质图谱比较,发现各种疟原虫红内期蛋白组分差异较大[10],为疟原虫虫种鉴定及生物学特性分析奠定了基础。但研究者并未对疟原虫进行同步化操作,没有对不同发育阶段各蛋白表达差异进行深入研究。本研究以约氏疟原虫为研究对象对混合阶段虫体、滋养体阶段虫体及裂殖体阶段虫体分别进行了SDS-PAGE蛋白电泳分析,并成功找到了7个明显表达差异的蛋白。
综上,本研究使用Percoll分离液分离出不同发育阶段疟原虫,初步揭示了不同发育阶段可溶性蛋白在蛋白表达量上有一定差异,为后续不同发育阶段虫体蛋白研究奠定基础。
4 参考文献
[1] Milner DA Jr.Malaria pathogenesis[J].Cold Spring Harb Perspect Med, 2018,2,8(1):a025569.
[2] Lover AA,Baird JK,Gosling R,et al.Malaria elimination: Time to target all species[J].American Journal of Tropical Medicine & Hygiene,2018,7,99(1):17-23.
[3] WHO.WHO World Malaria Report 2021[R].Geneva:World Health Organization, 2021.
[4] 高琪.输入性疟疾对巩固消除疟疾成果防止再传播的挑战和对策[J].中国热带医学,2021,21(1):1-4.
[5] Goswami D,Betz W,Locham NK,et al.A replication-competent late liver stage-attenuated human malaria parasite[J].JCI Insight,2020,5(13):e135589.
[6] Cowman AF,Healer J,Marapana D,et al.Malaria: Biology and disease[J].Cell,2016,167(3):610-624.
[7] Milner DA Jr.Malaria pathogenesis[J].Cold Spring Harb Perspect Med,2018,8(1):a025569.
[8] Lee MCS,Lindner SE,Lopez-Rubio JJ,et al.Cutting back malaria: CRISPR/Cas9 genome editing of plasmodium[J].Brief Funct Genomics,2019,18(5):281-289.
[9] Jensen AR,Adams Y,Hviid L.Cerebral plasmodium falciparum malaria: The role of PfEMP1 in its pathogenesis and immunity, and PfEMP1-based vaccines to prevent it[J].Immunol Rev,2020,293(1):230-252.
[10] 史明珠,張海珠,冯元凤.5种疟原虫红内期可溶性蛋白质图谱比较[J].新乡医学院学报,2001(4):253-255.
[2023-09-25收稿]
基金项目:江西省教育厅科学技术研究项目(编号:GJJ 213313)
作者单位:344000 江西省抚州市,江西中医药高等专科学校医学基础部(乔继琛、崔令花); 蚌埠医科大学安徽省感染与免疫重点实验室(张玲红、陈艳丽、倪艺轩)
*通讯作者

