川陈皮素的体外抑癌活性及其机制研究
苏明媛, 牛江龙, 李 林, 袁才根, 卢艳花*
(1.华东理工大学生物反应器工程国家重点实验室,上海,200237;2.联合利华中国研究所,联合利华研发中心(上海),上海,200335)
川陈皮素(Nobiletin,5,6,7,8,3,4-hexamethoxy flavone)是从芸香科柑桔属橘子 Citrus reticulaia Blanco果皮中提取的一种黄酮化合物,按结构分类,它是一种多甲氧基黄酮类物质[1]。目前已经证实川陈皮素具有抗氧化[2-3]、抗炎[3]、抗肿瘤[2-4]、抗病毒[5]等多种生物活性,因此它的开发利用越来越受到人们的关注。本实验旨在研究川陈皮素对多种肿瘤细胞生长的抑制作用及其可能的作用机制,以进一步揭示川陈皮素在抗肿瘤方面的活性及分子作用机制。
1 材料与方法
1.1 仪器与试剂 96孔细胞培养板、6孔细胞培养板购自 Corning公司;流式细胞仪购自 Becton Dickinson公司;MK3酶标仪购自Thermo Labsystem公司;荧光显微镜购自德国徕卡仪器有限公司。
RPMI-1640培养基、DMEM培养基购自 Gibco公司;小牛血清购自杭州四季青公司;Caspase-3分光光度法检测试剂盒购于南京凯基生物公司;AV/PI双染试剂盒购自Mbchemic生物公司;MTT、罗丹明123、DCFH-DA、Hochest33258均为 sigma公司产品;川陈皮素,纯度>98%,购自南京泽朗医药科技有限公司。阳性药物阿霉素(Adriamycin,ADM)购自浙江海正药业有限公司。其余试剂均为AR级。
1.2 细胞株及培养条件 Caco-2(人结肠癌细胞)、HeLa(人宫颈癌细胞)、HepG2(人肝癌细胞)、A375(人黑色素瘤细胞),培养基为高糖的DMEM,添加10%小牛血清;SW1990(人胰腺癌细胞),培养基为RPMI-1640培养基,添加10%小牛血清。细胞置5%CO2培养箱,37℃,饱和湿度下培养,隔天换液1次。所有细胞均购自上海中科院细胞库。
1.3 药物配制 称取16.1 mg川陈皮素,用1 mL的DMSO(二甲基亚砜)溶解,配制成40 mmol/L的贮备溶液。实验时,以新鲜的DMEM或RPMI-1640培养液稀释贮备溶液至终浓度为0~400 μmol/L,并且使DMSO终尝试小于0.1%。空白对照组仅加入测试药物所用溶媒DMSO(0.1%v/v)。称取14.5 mg阿霉素,用5 mL双蒸水溶解,配制成5 mmol/L的储备溶液,过滤除菌。实验时,以新鲜的DMEM或RPMI-1640培养液稀释储备溶液至终浓度0~16 μmol/L。
1.4 MTT法测定川陈皮素对5种肿瘤细胞的毒性取对数生长期的各细胞104cells/mL接种于96孔培养板,每孔100 μL,待细 胞培养6 h后,加入用新鲜培养基稀释的不同浓度的川陈皮素100 μL处理,使其终浓度为0~200 μmol/L,化疗药物阿霉素作为阳性对照,每浓度平行5孔,对照组加等量体积的培养液(含0.1%v/vDMSO),置 37 ℃,5%CO2及饱和湿度的培养箱培养48 h,之后小心吸除上清培养基,每孔加入 0.5 mg/mL MTT100 μL(MTT 用培养基配制),4 h后吸除上清液,每孔加入DMSO150 μL,振荡10 min,使MTT还原产物完全溶解,用酶标仪,以570 nm为实验波长,630 nm为参照波长测定其吸光度值。分别计算川陈皮素及阿霉素对5种肿瘤细胞的毒性,确定半数细胞抑制浓度(IC50)。
半数胞毒的浓度(IC50)=细胞存活率达到一半时的药物作用浓度
1.5 流式细胞仪检测川陈皮素对HeLa细胞凋亡的影响 将HeLa细胞以106cells/mL接种于6孔板中,细胞培养6 h后,加入不同浓度的川陈皮素作用48 h;离心收集上清液中的细胞及贴壁细胞(2000 r/min,离心时间5 min),弃培养基。用冷PBS洗涤细胞两次;用400 μL Binding Buffer悬浮细胞,在细胞悬浮液中加入5 μL Annexin V-FITC,轻轻混匀后于4℃避光条件下孵育15 min。然后加入10 μL PI,轻轻混匀,于4℃避光条件下孵育5 min;用流式细胞仪检测(Ex:488 nm,Em:530 nm)。
1.6 Hochest 33258荧光染料法检测细胞凋亡形态变化 将HeLa细胞以106cells/mL接种于6孔板中,细胞培养6 h后,加入不同浓度的川陈皮素作用48 h;之后吸除上清培养液,用PBS洗涤2次,加入固定液(甲醇-乙酸=3∶1),4℃下固定10 min;吸除固定液,用PBS漂洗1次,加入终质量浓度为5 μg/mL的Hochest33258染液避光染色10 min后,用PBS漂洗1次,然后用90%甘油封固,以356 nm紫外光激发,荧光显微镜下观察细胞的凋亡形态变化并拍照。
1.7 分光光度法检测川陈皮素对HeLa细胞中凋亡蛋白酶Caspase-3活性的影响 将HeLa细胞以106cells/mL接种于6孔板中,细胞培养6 h后,加入不同浓度的川陈皮素作用48 h;离心收集上清液中的细胞及贴壁细胞,并用PBS洗涤2次;在收集的细胞中加入50 μL冰冷Lysis Buffer,吹打均匀,冻融2~3次;4℃下离心(1000 r/min)10 min;小心吸取上清(含裂解的蛋白质)转移至新管中;吸取50 μL含100~200 μg蛋白的细胞裂解上清液,加入50 μL的2 ×Reaction Buffer及 5 μLCaspase-3 Substrate,于37℃避光孵育4 h;用酶标仪在405 nm下测定其吸光度值。
1.8 统计学处理 实验结果以平均值±标准差表示。采用Origin8.0软件对实验数据进行统计学分析。
2 实验结果
2.1 MTT法测定川陈皮素对5种肿瘤细胞的毒性川陈皮素对5种肿瘤细胞的细胞毒性实验结果如图1所示。由结果可知,川陈皮素对5种肿瘤细胞的生长都表现出一定的抑制作用,且呈剂量依赖关系。其中对人宫颈癌细胞HeLa的抑制效果最好,其IC50值为35.21 μmol/L。阳性对照药阿霉素对5种肿瘤细胞作用48 h后表现出较好的抑制活性(见图2)。
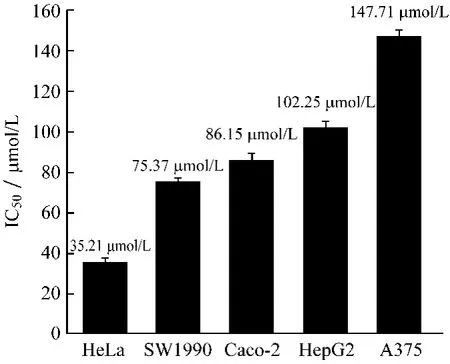
图1 川陈皮素对5种肿瘤细胞的IC50值Fig.1 IC50values of nobiletin on five human cancer cell lines
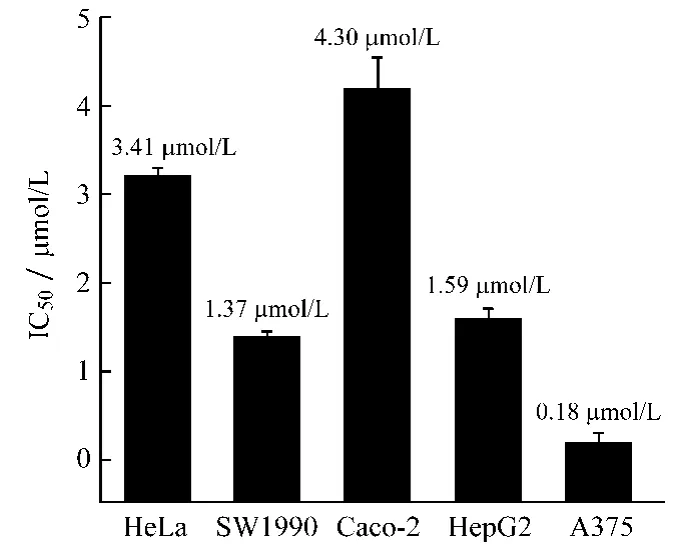
图2 阿霉素对5种肿瘤细胞的IC50值Fig.2 IC50values of ADM on five human cancer cell lines
2.2 AV/PI双染检测川陈皮素对HeLa细胞凋亡的影响 为了检测川陈皮素对HeLa细胞的促凋亡作用,我们采用AV/PI双染-流式细胞仪法检测细胞凋亡。如图3所示,空白对照组的凋亡率为10.21%,而细胞经 17.5 μmol/L、35 μmol/L、70 μmol/L的川陈皮素处理48 h后,细胞凋亡率分别达到17.68%、24.85%、37.27%。表明川陈皮素对人宫颈癌HeLa细胞有良好的促凋亡作用,且随浓度增大,药物对HeLa细胞的促凋亡作用越强。
2.3 Hochest33258荧光染色观察川陈皮素对HeLa细胞凋亡形态的影响 HeLa细胞经川陈皮素处理48 h后,在荧光显微镜下观察,356 nm处紫外光激发,可见典型的凋亡形态学变化(图4B~D):核染色质聚集、核固缩,出现凋亡小体等。且由结果可知,HeLa细胞的凋亡现象与川陈皮素浓度呈正比关系。而对照组的细胞核则呈现较均匀的蓝色荧光(图4A)。
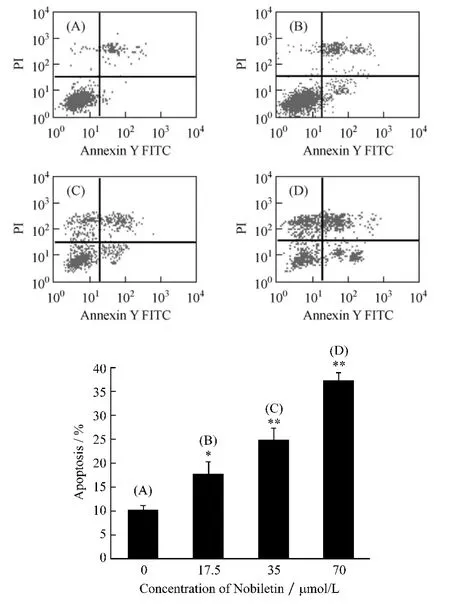
图3 川陈皮素对HeLa细胞凋亡的影响Fig.3 Effects of nobiletin on apoptosis rate of HeLa cells
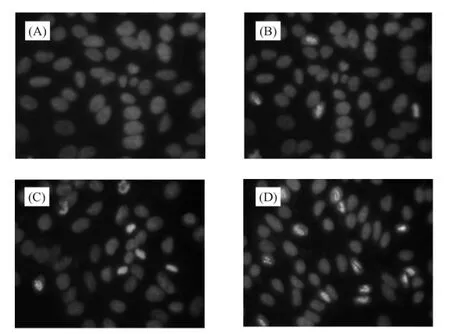
图4 Hochest33258荧光染色结果(×200)Fig.4 The results of Hochest 33258 staining(×200)
2.4 Caspase-3活性测定 不同浓度的川陈皮素药物组与对照组相比,测得的吸光度值有非常明显的差别(P<0.01)。随着川陈皮素剂量的增加,吸光度值也随之增加,见表1。实验结果表明川陈皮素对细胞内caspase-3活化程度呈剂量依赖性,即随药物浓度增加,细胞内的凋亡蛋白酶增加。
表1 川陈皮素对人宫颈癌HeLa细胞内凋亡蛋白酶caspase-3活性表达的影响(n=4,±s)Tab.1 Effect of nobiletin on caspase-3 activity in HeLa cells
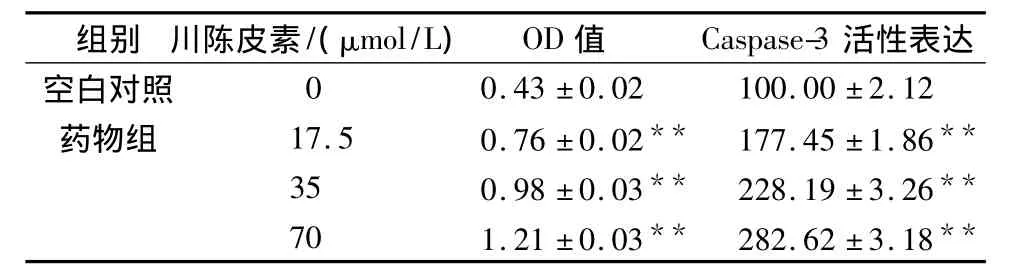
表1 川陈皮素对人宫颈癌HeLa细胞内凋亡蛋白酶caspase-3活性表达的影响(n=4,±s)Tab.1 Effect of nobiletin on caspase-3 activity in HeLa cells
与空白对照组比较,**P <0.01。**P <0.01 vs control group.
?
3 讨论
癌症是人类目前最难对付的顽症之一,亦是世界医学的一大难题。目前针对肿瘤的各种治疗手段和抗癌化学药物的应用都具有一定的危险性和毒副作用,因此,寻找一种使用安全、毒副作用小的纯天然抗肿瘤药物成为人们的焦点。众多研究表明,从天然植物中提取的黄酮类化合物对多种肿瘤细胞具有良好的增殖抑制作用[6-8]。川陈皮素作为从柑橘果皮中提取的一种多甲氧基黄酮类物质,已被证实具有抗肿瘤活性。本实验分别考察了川陈皮素对Caco-2、HeLa、HepG2、A375、SW19905 种肿瘤细胞株的抑制作用,进一步揭示了川陈皮素在抗肿瘤方面的应用前景。
MTT比色法分析结果显示川陈皮素对5种肿瘤细胞都表现出了一定的抑制作用,且抑制效果随川陈皮素浓度的增加而增强,存在明显的剂量依赖关系。其中,川陈皮素对人宫颈癌细胞HeLa的抑制效果最好,其半数致死浓度 IC5035.21 μmol/L,其次为人胰腺癌细胞 SW1990,其 IC50为75.37 μmol/L。川陈皮素的抑癌活性与化疗药物阿霉素相比,虽然略有差距,但是化疗药物具有高效高毒的特点,而川陈皮素作为从柑橘植物中提取的天然活性物质,其表现出的高效抑癌活性,为进一步开发高效低毒的天然抗癌药物提供了科学依据。
细胞凋亡普遍存在于生物界,对胚胎发育及形态发生、组织内正常细胞群的稳定、机体的防御和免疫反应、疾病或中毒时引起的细胞损伤、老化、肿瘤的发生进展[9]起着重要作用 。在正常的细胞中,磷脂酰丝氨酸(Phosphatidylserine,PS)位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是一种分子量为35.8KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力特异性结合。将Annexin-V进行荧光素FITC标记,利用流式细胞仪可检测到细胞凋亡的发生。碘化丙啶(Propidine Iodide,PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和死细胞,PI能够透过细胞膜而使细胞核红染。因此Annexin-V与PI匹配使用,就可以将凋亡早晚期的细胞及死细胞区分开来[10]。Hochest33258是一种亲核染料,可被活细胞摄取,Hochest33258染色可见凋亡细胞核致密、浓缩呈现强荧光团块,而正常细胞核则呈均匀荧光[11]。通过 AV/PI双染-流式细胞仪法及 Hochest33258荧光染色法对不同剂量川陈皮素处理后的HeLa细胞进行检测,发现随川陈皮素浓度增大,细胞的凋亡率随之增大,凋亡形态学变化增多。说明川陈皮素可以明显促进HeLa细胞的凋亡。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3为关键的执行分子,与DNA断裂、染色质凝聚和凋亡小体形成有关。Caspase-3在正常状态下以酶原的形式存在于胞浆中,没有活性;但在细胞发生凋亡阶段,它被激活,裂解相应的胞浆胞核底物,最终导致细胞凋亡[12]。本实验利用分光光度法检测不同浓度川陈皮素处理的HeLa细胞中Caspase-3的活性,结果显示Caspase-3活性随川陈皮素浓度的增加而增高。因此可以认为川陈皮素可能是通过活化凋亡蛋白酶Caspase-3进而诱导HeLa细胞凋亡的。
本实验结果显示,川陈皮素可对实验中的5种肿瘤细胞产生抑制作用,并且川陈皮素诱导HeLa细胞的凋亡过程与凋亡调节蛋白酶Caspase-3的表达之间存在显著相关性,但是川陈皮素在抗肿瘤过程中与其他凋亡蛋白酶及凋亡信号之间的关系还有待进一步的研究。
[1]Lu Yanhua,Zhang Chongwei,Bucheli P,et al.Citrus flavonoids in fruit and traditional Chinese medicinal food ingredients in China[J].Plant Foods Hum Nutr,2006,61:57-65.
[2]Murakami A,Nakamura Y,Torikai K,et al.Inhibitory effect of citrus nobiletin on phorbol ester-induced skin inflammation,oxidative stress,and tumor promotion in mice[J].Cancer Res,2000,60:5059-5066.
[3]Lina N,Satoa T,Takayamaa Y,et al.Novel anti-inflammatory actions of nobiletin,a citrus polymethoxy flavonoid,on human synovial fibroblasts and mouse macrophages[J].Biochem Pharmacol,2003,65(12):2065-2071.
[4]Luo Gang,Guan Xiaoling,Zhou Liming.Apoptotic effect of citrus fruit extract nobiletin on lung cancer cell line A549 in vitro and in vivo[J].Cancer Biol Ther,2008,7(6):966-973.
[5]Iwasea Y,Takemuraa Y,Ju-ichia M,et al.Inhibitory effect of flavonoid derivatives on Epstein-Barr virus activation and twostage carcinogenesis of skin tumors[J].Cancer Lett,2001,173(2):105-109.
[6]YeB,Aponte M,Dai Y,et al.Ginkgo biloba and ovarian cancer prevention:epidemiological and biological evidence[J].Cancer Lett,2007,251(1):43-52.
[7]Lu Yanhua,Ye Chunlin,Liu Jianwen,et al.In vitro anti-tumor activity of 72’,4’-dihydroxy-6’-methoxy-3’,5’-dimethylchalcone against six established human cancer cell lines[J].Pharmacol Res,2004,50:505-510 .
[8]Choi S U,Ryu S Y,Yoon S K,et al.Effects of flavonoids on the growth and cell cycle of cancer cells[J].Anticancer Res,1999,19(6B):5229-5233.
[9]Evans G I,Vousden K H.Proliferation,cell cycle and apoptosis in cancer[J].Nature,2001,411(6835):342-348.
[10]Verma M,Singh S.K,Bhushan S,et al.In vitro cytotoxic potential of polyalthia longifolia on human cancer cell lines and induction of apoptosis through mitochondrial-dependent pathway in HL60 cells[J].Chem-Biol Interact,2008,171:45 – 56.
[11]NaritaY,Asai A,Kuchino Y,et al.Actinomycin D and staurosporine,potent apoptosis inducers in vitro,are potentially effective chemotherapeutic agents against glioblastoma multiforme[J].Cancer Chemoth Pharm,2000,45:149-156.
[12]Cheung H H,Lynn Kelly N,Liston P,et al,Involvement of caspase-2 and caspase-9 in endoplasmic reticulum stress-induced apoptosis:a role for the IAPs,Exp[J].Cell Res.2006,312:2347–2357.