酪氨酸激酶受体RON在慢性阻塞性肺疾病大鼠肺内表达的研究
陈小菊,王涛
(川北医学院附属医院呼吸内科,四川 南充 637000)
酪氨酸激酶受体RON在慢性阻塞性肺疾病大鼠肺内表达的研究
陈小菊,王涛
(川北医学院附属医院呼吸内科,四川 南充 637000)
目的:探讨酪氨酸激酶受体RON在慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)大鼠气道炎症中的作用。方法:单纯熏香烟法建立COPD大鼠模型;支气管肺泡灌洗计数支气管肺泡灌洗液(BALF)中细胞总数与肺泡巨噬细胞(alveolar macrophage,AM)数,培养正常和COPD大鼠AM,采用逆转录-聚合酶链式反应法检测大鼠肺组织中酪氨酸激酶受体RON mRNA的表达情况,免疫组化法观察大鼠气道和离体培养的AM中RON蛋白的表达水平,图像分析系统测定肺平均内衬间隔(MLI)、平均肺泡数(MAN)和肺泡腔面积与总面积比(PAA)。结果:COPD组MLI、PAA较正常对照组明显增高[MLI:(111.451±49.334)×10-6m vs(44.803±10.624)×10-6m;PAA:(79.653±7.594)%vs(48.352±13.063)%],而MAN则明显低于正常对照组[(81.621±20.394)×106/m2vs(170.098±42.398)×106/m2],差异均有统计学意义(P<0.01)。COPD组BALF中细胞总数和AM计数均明显高于正常对照组[细胞总数:(6.029±0.420)×108/L vs(1.463±0.0692)×108/L;AM数:(5.752±0.571)×108/L vs(1.387±0.105)×108/L,P<0.01)]。COPD组大鼠肺组织RON mRNA表达较正常对照组明显上调[(0.892±0.088)vs(0.353±0.080),P<0.01],COPD组大鼠气道上皮及AM中RON蛋白水平也较正常对照组显著增加[气道RON蛋白:(0.171±0.027)vs(0.073±0.009);AM RON蛋白:(0.310±0.101)vs(0.110±0.006),P<0.01]。结论:RON与COPD气道炎症调节密切相关。
酪氨酸激酶受体RON;慢性阻塞性肺疾病;肺泡巨噬细胞
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统的常见病和多发病,其发病率和死亡率均逐年增加,严重威胁人类健康。COPD的主要特征是慢性进行性的不可逆气流受限,气道的慢性炎症是其重要的病理学基础之一。有研究表明[1],肺泡巨噬细胞(alveolar macrophage,AM)及其释放的细胞因子和氧化应激在其中起重要作用。RON为酪氨酸激酶受体家族中的一员,是一种细胞膜受体蛋白,具有内在酪氨酸激酶活性,其配体为巨噬细胞刺激蛋白(macrophage stimulating protein,MSP)。RON和MSP结合后能刺激巨噬细胞产生氧自由基和细胞因子、诱导NF-κB的活化,调节细胞分化、迁移和基质的侵袭等功能[2-3]。Brunelleschi等[4]发现,肺癌、肺纤维化及肺结节病患者的AM表面有酪氨酸激酶受体RON表达,其在MSP介导下能诱导巨噬细胞的呼吸爆发。但RON在COPD中的作用,目前尚未见到相关报道。本研究通过烟熏3月建立COPD大鼠模型,分离培养正常和COPD大鼠的AM,检测正常组和COPD组大鼠肺组织中酪氨酸激酶受体RON mRNA的表达情况、两组大鼠气道上皮和培养的AM中RON蛋白的表达水平,旨在进一步探讨RON在COPD炎性机制中的作用。
1 材料与方法
1.1 材料和对象
1.1.1 试剂瑞氏-姬姆萨复合染液(南京建成科技有限公司);低糖DMEM培养基(Hyclone公司);胎牛血清(Hyclone公司);引物合成(上海生工生物技术公司);逆转录试剂盒(成都博瑞克生物技术有限公司);PCR反应体系(天根生物技术有限公司);RONβ(E-3)鼠抗人单克隆抗体(SANTA公司);RON免疫组化试剂盒(Neobioscience公司)。红梅牌香烟(玉溪卷烟厂,焦油12mg、烟碱1.1 mg、烟气CO含量13 mg)。
1.1.2 实验动物清洁级健康Wistar大鼠16只,雄性,体重(190±10)g,由川北医学院实验动物中心提供,符合SPF级别标准。
1.1.3 实验仪器鸽牌TDL5A离心机(上海安亭科学仪器厂)、DHP420型电热恒温培养箱(重庆永恒实验仪器厂)、OLYMPUS DP70(日本OLYMPUS公司)、Mycyder梯度PCR仪(美国BIO-RAD公司),HC型凝胶电泳仪(美国BIO-RAD公司),Multi-Heater2800A多用恒温箱(天津奥特赛恩斯仪器有限公司)。Heal Force二氧化碳培养箱HF90(力康生物医疗科技控股公司)。
1.2 实验方法
1.2.1 COPD大鼠模型的建立及动物分组16只Wistar大鼠随机分为正常对照组和COPD组,每组8只。两组大鼠均自由饮水进食,将COPD组大鼠放入大小为60 cm×60 cm×35 cm自制有机玻璃烟熏箱内被动吸烟。每次燃烧10支香烟,每天1次,每次1 h,连续3个月至病理证实COPD形成。
1.2.2 支气管肺泡灌洗和支气管肺泡灌洗液(bronchial alveolar lavage fluid,BALF)细胞学检查大鼠腹腔注射1%戊巴比妥钠(30 mg/kg)麻醉,暴露气管和双肺,夹闭右主支气管,用37℃生理盐水15 mL分4次灌洗左肺。每次灌洗液回收率为90%~95%。将所得灌洗液用单层无菌200目细胞筛过滤,收集全部灌洗液,4℃、1500 r/min离心5 min,细胞沉淀用PBS洗涤后加入含10%胎牛血清、50 μg/mL链霉素和5 U/mL青霉素的无酚红DMEM(低糖)培养液重悬沉淀制成单细胞悬液,瑞氏-姬姆萨复合染液染色进行细胞计数(至少计数200个细胞),并用台盼蓝检测细胞活力。AM的纯度始终>95%,存活率>98%。
1.2.3 AM的培养及处理进行细胞计数和检测细胞活力后,调整细胞密度为1×109个/L,将其接种于放置有盖玻片的6孔培养板内,纯化培养2 h使细胞贴壁,然后继续培养24 h。吸走所有细胞上清液,用PBS洗板,4%多聚甲醛室温固定,取出盖玻片,PBS漂洗2次,自然风干后用锡泊纸包好保存于-20℃备用。
1.2.4 肺组织标本制备取大鼠左肺置于液氮中,用于RNA提取。取大鼠右肺置于4%多聚甲醛中固定24 h,石蜡包埋切片,每只大鼠准备两张切片分别作HE和免疫组化染色。
1.2.5 病理学形态定量分析在OLYMPUS DP70显微镜下观察大鼠HE染色切片,使显微镜处于同一放大倍数(10×20)及电压下,每张切片均选取上、中、下、左、右5个视野,用DP Controller软件进行图像采集,IMAGE-PRO plus 6.0图文分析软件分别测量下列3个指标,测量时避开大、中血管。
肺平均内衬间隔(MLI):以视野正中为中心划“十”字交叉线,计数通过该交叉线的肺泡间隔数(Ns),测出十字线的总长度(L)为1.253×10-3m,以MLI=L/Ns得到平均内衬间隔,其数值反映肺泡平均直径。
平均肺泡数(MAN):计数每个视野内的肺泡数(Na),测出每个视野的面积(S)为0.54×10-6m2。以MAN=Na/S计算各个视野的平均肺泡数,其数值反映肺泡密度。
肺泡腔面积与总面积比(PAA):测量每个视野内的肺实质的灰度百分比,计算出每个视野中肺泡腔面积在肺总面积中所占的比例。
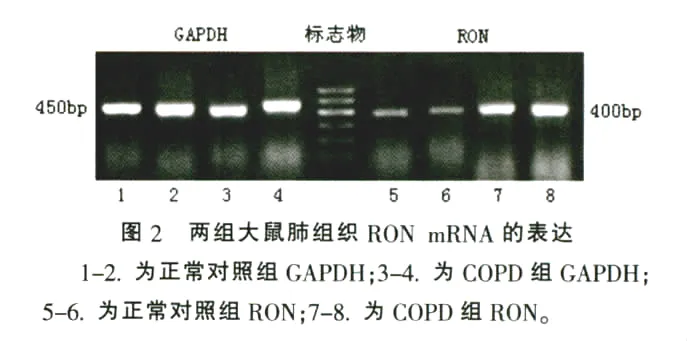
1.2.6 RON mRNA的检测采用RT-PCR法检测大鼠肺组织中RON mRNA的表达,内参照为甘油醛-3-磷酸脱氢酶。引物序列:RON上游引物:5-GAGAGCCTTCAGACCTACAGA-3',下游引物:5'-TTGACGTGCTCCTGTGATGCA-3',扩增片段长度400 bp。GAPDH上游引物:5'-ACCACAGTCCATGCCATCAC-3',下游引物:5-TCCACCACCCTGTTGCTGTA-3',扩增片段长度450 bp。
1.2.7 免疫组化染色AM细胞爬片及肺组织切片的免疫组化染色均采用链亲和素过氧化物酶法(SP法),检测按试剂盒说明书进行。RONβ(E-3)鼠抗人单克隆抗体工作浓度为1∶20。组织切片需热修复抗原。采用DAB显色,苏木素套染,阳性结果呈棕黄色。
在OLYMPUS DP70显微镜高倍镜视野下,每张免疫组化染色切片或细胞爬片随机不重复采图5张,应用IMAGE-PRO plus 6.0图文分析软件测量每张图片的平均光密度值,再取其平均值。
1.3 统计学分析
2 实验结果
2.1 两组大鼠肺组织病理形态学改变
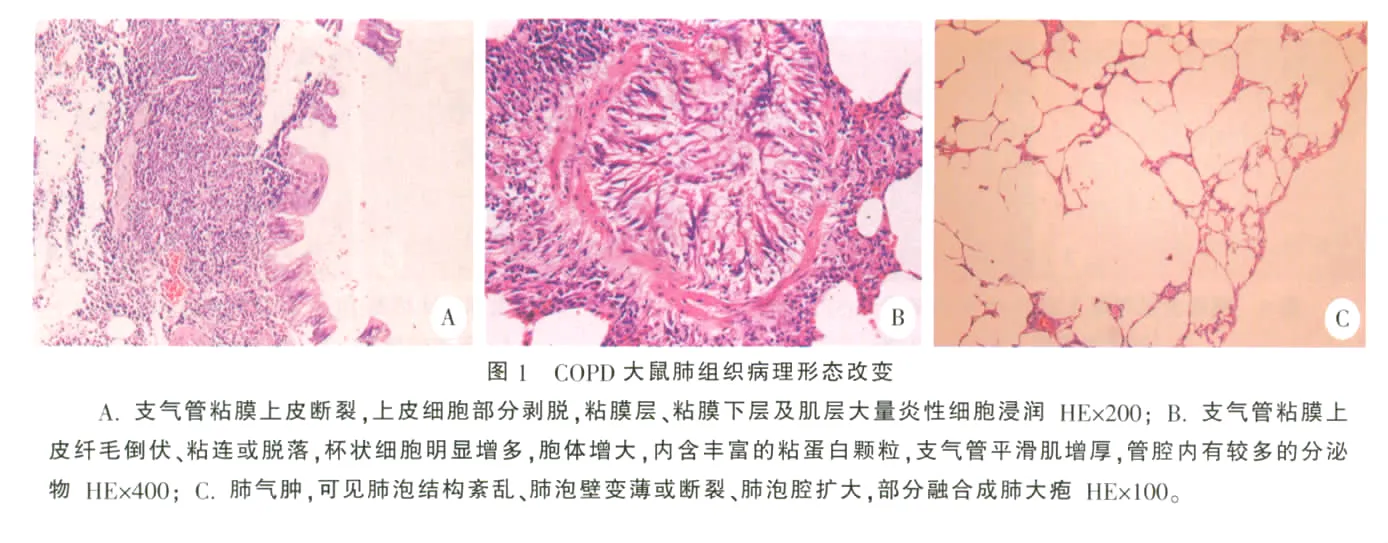
大体形态观察可见:COPD模型组大鼠肺体积比正常对照组明显增大,颜色苍白,弹性减弱,肺表面不平,可见小囊泡状突起,表面无出血,无液体渗出。光镜观察可见:正常对照组气管及各级支气管粘膜纤毛柱状上皮细胞完整丰富,纤毛排列整齐,纤毛细胞间仅见散在的杯状细胞,管壁内有少量淋巴细胞。COPD组大鼠气管及各级支气管可见不同程度的慢性炎症细胞(包括淋巴细胞、浆细胞及单核细胞)和少量中性粒细胞浸润。支气管纤毛上皮细胞变性、坏死、脱落。杯状细胞明显增多,胞体增大,内含丰富的粘蛋白颗粒。支气管平滑肌增厚。管腔内有较多的分泌物以及巨噬细胞和中性粒细胞,周边肺组织普遍存在肺气肿,表现为肺泡结构紊乱、肺泡壁变薄或断裂、肺泡腔扩大,部分融合成肺大疱。结果,见图1。
2.2 肺气肿形态学定量分析
COPD组的MLI和PAA显著高于正常对照组,MAN显著低于正常对照组,具有统计学差异(P<0.01),结果见表1。
表1 两组大鼠肺气肿形态学定量指标±s)
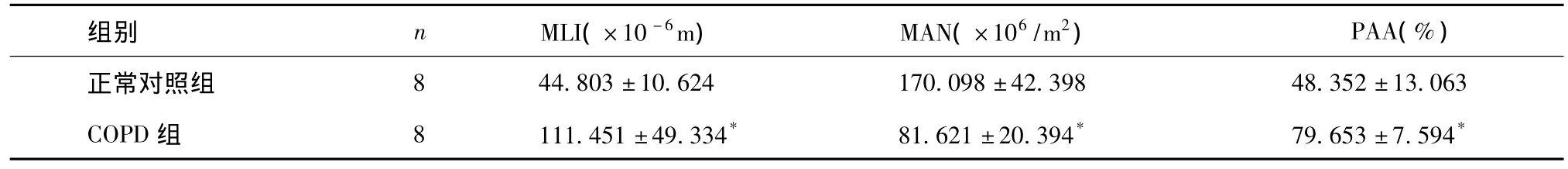
表1 两组大鼠肺气肿形态学定量指标±s)
*:P<0.01,与正常对照组比较。
正常对照组844.803±10.624170.098±42.39848.352±13.063 COPD组8111.451±49.334*81.621±20.394*79.653±7.594*
2.3 两组大鼠BALF中细胞总数和AM计数
COPD组大鼠BALF中细胞总数和AM计数显著高于正常对照组(P<0.01),结果见表2。
表2 两组大鼠BALF中细胞总数和AM计数±s)

表2 两组大鼠BALF中细胞总数和AM计数±s)
*:P<0.01,与正常对照组比较。
正常对照组81.463±0.06921.387±0.105 COPD组86.029±0.420*5.752±0.571*
2.4 两组大鼠肺组织RON mRNA的表达
COPD组大鼠肺组织RON mRNA的表达显著高于正常对照组,差异有统计学意义(P<0.01),结果见表3和图2。
表3 大鼠肺组织RON mRNA、气道RON蛋白及AMRON蛋白表达±s)

表3 大鼠肺组织RON mRNA、气道RON蛋白及AMRON蛋白表达±s)
*:P<0.01,与正常对照组比较。
正常对照组80.353±0.0800.110±0.0060.073±0.009 COPD组80.892±0.088*0.310±0.101*0.171±0.027*
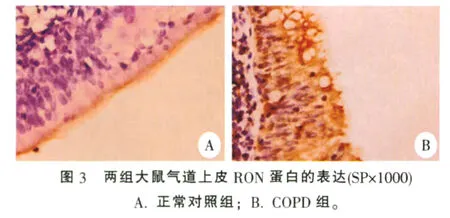
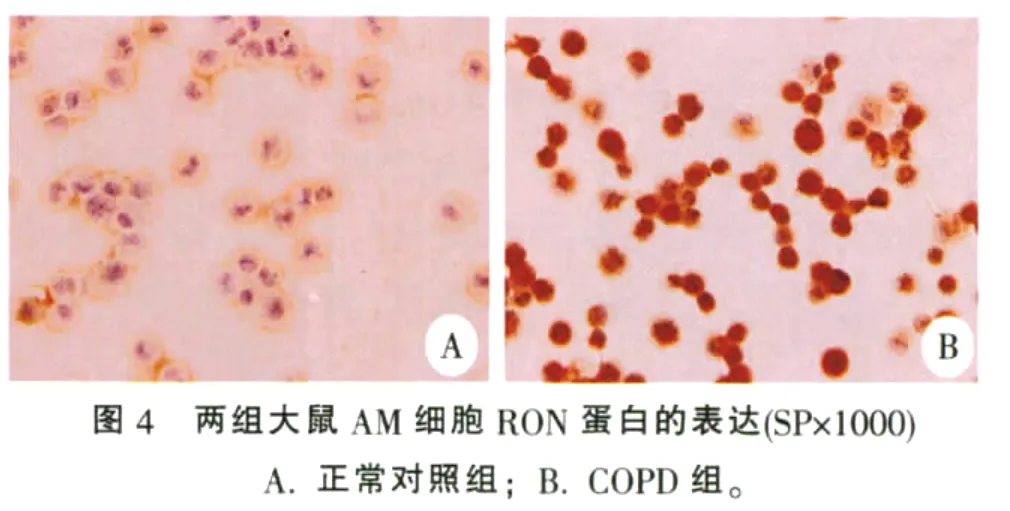
2.5 两组大鼠AM和气道上皮中RON蛋白的表达
免疫组化显示:正常和COPD组大鼠气道纤毛上皮和AM中均有RON蛋白表达,正常大鼠气道纤毛上皮层仅见其纤毛顶端表面有RON蛋白表达,而COPD大鼠气道纤毛上皮胞浆和纤毛顶端均可见RON蛋白表达。在正常大鼠AM中RON蛋白主要表达在细胞胞膜上,而COPD大鼠AM胞膜和胞浆中均有RON蛋白表达。统计分析显示:COPD组大鼠气道上皮和AM中RON蛋白表达明显强于正常组大鼠(P<0.01),见表3,图3、图4。
3 讨论
本研究发现:COPD模型组大鼠肺体积比正常对照组明显增大,颜色苍白,弹性减弱,肺表面不平,可见小囊泡状突起,提示肺气肿形成。进一步光镜观察可见:COPD组大鼠气管及各级支气管可见不同程度的慢性炎症细胞(包括淋巴细胞、浆细胞及单核细胞)和少量中性粒细胞浸润;支气管纤毛上皮细胞变性、坏死、脱落;杯状细胞明显增多,胞体增大,内含丰富的粘蛋白颗粒;支气管平滑肌增厚;管腔内有较多的分泌物以及巨噬细胞和中性粒细胞;肺泡结构紊乱、肺泡壁变薄或断裂、肺泡腔扩大,部分融合成肺大疱。上述改变符合COPD的形态学诊断指标。应用图像分析系统检测发现,COPD组大鼠MLI、PAA较正常对照组明显增高,而MAN则明显低于正常对照组。提示COPD组大鼠肺泡平均直径和肺泡腔面积在肺总面积中所占比例明显高于正常对照组,而肺泡密度则明显低于正常对照组。说明COPD模型组肺气肿的病理学诊断成立,表明本实验单纯熏香烟法制备的COPD动物模型是成功的。
现己公认吸烟是COPD的最主要危险因素,约15%的长期吸烟者发生COPD。有资料表明,吸烟者下呼吸道内炎性细胞数目明显增多[5],其中AM数目在吸烟者和COPD患者的BALF中升高达数倍以上。本实验研究也证实COPD组大鼠BALF中细胞总数和AM计数显著高于正常对照组,与其它报道结果一致[6]。再次证实了在COPD的气道腔中存在着以AM增多为特征的慢性非特异性炎症。
RON是MSP的特异性受体,其基因位于人类染色体3p21,含有20个外显子和19个内含子。成熟的RON蛋白是由α和β亚单位组成的杂二聚体,α链和β链之间由二硫键相连[7-8],其基因在人体上皮组织、粒细胞、单核细胞、巨噬细胞以及扁桃体生发层、小肠、结肠、肾脏、肺、骨髓中都有表达[9];人纤毛上皮如气管支气管上皮层纤毛顶端表面亦发现了RON蛋白的表达[10]。本实验免疫组化结果显示:正常和COPD组大鼠气道纤毛上皮和AM中均有RON蛋白表达,正常大鼠气道纤毛上皮层仅见其纤毛顶端表面有RON蛋白表达,与文献报道一致;而COPD大鼠气道纤毛上皮胞浆和纤毛顶端均可见RON蛋白表达。在正常大鼠AM中RON蛋白主要表达在细胞胞膜上,而COPD大鼠AM细胞胞膜和胞浆中均有RON蛋白表达。统计分析显示:COPD组大鼠气道纤毛上皮和AM细胞中RON蛋白的表达明显强于正常对照组。PCR结果显示:COPD组大鼠肺组织RON mRNA的表达也明显强于正常对照组。因此,我们推测RON在COPD气道炎症中起较为重要的作用,其详细机制有待进一步研究。
[1]Tetley TD.Macrophages and the pathogenesis of COPD[J].Chest,2002,121(5 Suppl):l56-159
[2]Nikolaidis NM,Gray JK.Gurusamy.Ron receptor tyrosine kinase negatively regulates TNFalpha production in alveolar macrophages by inhibiting NF-kappaB activity and Adam17 production[J].Shock,2010,33(2):197-204
[3]Camp ER,Liu W,Fan F,et al.RON a tyrosine kinase receptor involved in tumor progression and metastasis[J].Ann Surg Oncol,2005,12(4):273-281
[4]Brunelleshi S,Penego L,Lavagno L,et al.Macrophage stimulation protein(MSP)evokes superoxide anion production by human macrophages of different origin[J].Br J Pharmacol,2001,134(6):1285-1295
[5]Taylor JD.COPD and the response of the lung to tobacco smoke exposure[J].Pulm Pharmacol Ther,2010,23(5):376-383
[6]刘先胜,徐永健,杨丹蕾,等.慢性阻塞性肺疾病大鼠肺泡巨噬细胞延迟整流钾通道的活性研究[J].中国病理生理杂志,2005,21(9):1728-1730
[7]Ronsin C,Muscatelli F,Mattei MG,et al.A novel putative receptor protein tyrosine kinase of the met family[J].Onco gene,1993,8(5):1195-1202
[8]Wang MH,Ronsin C,Gesnel MC,et al.Identification of the ron gene product as the receptor for the human macrophage stimulating protein[J].Science,1994,266(5182):117-119
[9]Wang MH,Padhye SS,Guin S,et al.Potential therapeutics specific to c-MET/RON receptor tyrosine kinases for molecular targeting in cancer therapy[J].Acta Pharmacol Sin,2010,31(9):1181-1188
[10]Sakamoto O,Iwama A,Amitani R,et al.Role of macrophage-stimulating protein and its receptor,RON tyrosine kinase,in ciliary motility[J].J Clin Invest,1997,99(4):701-709
The expression of receptor tyrosine kinase RON in lung tissue of rats with chronic obstructive pulmonary disease
CHEN Xiao-ju,WANG Tao
(Department of Respiratory Medicine,Affiliated Hospital of North Sichuan Medical College,Nanchong 637000,Sichuan,China)
Objective:To explore the role of receptor tyrosine kinase RON in the airway inflammation of chronic obstructive pulmonary disease(COPD)in rats.MethodsA rat COPD model was established by exposing the rats to cigarette smoke daily for three mouth.Total cell counts and alveolar macrophage(AM)counts in bronchoalveolar lavage fluid(BALF)were examined.Rat AMs from the control group and COPD group were cultured.The expression of RON mRNA in lung tissue of rats was assessed by reverse transcription-polymerase chain reaction(RT-PCR).The levels of RON protein in the airway of rats and AM cultured in vitro were observed by immuno-histochemistry.ResultsThe MLI and PAA in COPD group were higher than those of the control group while MAN was just on the contrary(P<0.01).The total cell counts and AM counts in BALF of the COPD group were significantly higher than those of control group(P<0.01).Compared to the control group,the levels of RON mRNA in lung tissue from COPD rats were up-regulated significantly(P<0.01).The levels of RON protein in the COPD rats airway and AM were higher than those of control group signifi-cantly(P<0.01).ConclusionThere is a close correlation between RON and airway inflammatory mechanism of COPD.
Tyrosine kinase receptor RON;Chronic obstructive pulmonary disease;Alveolar macrophages
1005-3697(2012)04-0355-05
R734.2;R563.9
A
10.3969/j.issn.1005-3697.2012.04.014
四川省卫生厅科研项目(070293)
2012-04-09
陈小菊(1971-),四川岳池人,博士,副教授,主要从事慢性阻塞性肺疾病和肺动脉高压发病机制方面的研究工作。E-mail:cxj9592@163.com
时间:2012-7-80∶29
网络出版地址:http://www.cnki.net/kcms/detail/51.1254.R.20120708.0029.201204.352_013.html
(学术编辑:陈绍平)

