白酒糟发酵菌种组合的筛选
郭素环 周碧君,2 文 明,2 程振涛,2 王开功,2 夏先林 吴 艳 李晓丹
(1.贵州大学动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病研究室,贵州 贵阳 550025)
我国每年白酒糟产量高达2100多万吨,基于酒糟中含有一定的蛋白质、丰富的氨基酸、维生素和多种微量元素等,传统的做法是将鲜酒糟直接饲喂牲畜当饲料原料,此方法有两个弊端:一是鲜酒糟内粗纤维含量高、家畜适口性差、消化率低,霉烂酒糟易产生病害;二是鲜酒糟含水率高,难运输,酸度高,易腐败变质。为此,人们对其资源化利用问题进行了多方面的研究,例如:利用白酒糟制取甘油[1-2],培养食用菌[3-5],提取复合氨基酸及微量元素[6],提取植酸和植酸钙[7],酿醋[8-9]等;利用酒精糟厌氧发酵回收沼气[10-11],提取蛋白质[12],生产干全饲料(DDGS)[13],制取单细胞蛋白(SCP)饲料[14],酒糟发酵生产燃料乙醇[15],生产粗酶制剂[16]等。以上方法由于规模小、能源消耗大、营养物质转化不充分等问题多数处于停顿状态。为此我们采用微生物固态发酵白酒糟生产生物饲料,此法有以下优点:微生物生长速度快,周期短、蛋白质含量高,含丰富的必需氨基酸、B族维生素、辅酶等,生产不受气候条件,生产季节变化,仅需少量土地和劳力,酒糟中营养物质得到有效的利用。此法的效益在生产上得到很好的验证:日本大阪市的田金公司在酒糟内加入部分乳酸菌,发酵后成为牛的“上等食品”。吃了这种饲料,牛就可以长出脂肪均匀的“五花上等肉”[17]。在国内,蔡治华等[18]用微贮酒糟饲喂黑白花奶牛,经过30 d的试验,结果表明:添加微贮酒糟的试验组比添加鲜酒糟的对照组奶牛的日均产乳量提高了4.43%,差异显著,乳脂率提高了2.34%。
本试验将班图酒香酵母、枯草芽孢杆菌、绿色木霉、嗜酸乳杆菌这4种菌进行不同组合发酵以鲜白酒糟、玉米粉及菜籽粕为基质原料,观察发酵前后成分的变化,为生产酒糟生物饲料选择适合的菌种组合提供参考。
1 实验材料与方法
1.1 材料
1.1.1 供实验菌种
Y1嗜酸乳杆菌(Lactobacillus acidophilus)、Y2班图酒香酵母菌(Brettanomyces custersianus)、Y3绿色木霉(Trichoderma viride)和Y4枯草芽孢杆菌[Bacillus subtilis(Ehrenberg)Cohn]均为贵州大学动物科学学院试验室保存菌种。
1.1.2 培养基配制
普通培养基:嗜酸乳杆菌培养用MRS培养基,班图酒香酵母培养用YPD培养基,绿色木霉培养用综合马铃薯培养基,枯草芽孢杆菌培养用普通肉汤培养基[19]。
酒糟饲料发酵培养基:鲜白酒糟60%、玉米粉10%、菜籽粕10%、水20%,另加硫酸亚铁15 mg/100 g、硫酸锌12 mg/100 g、硫酸锰 10 mg/100 g、硫酸铜 15 mg/100 g、磷酸氢钙2 g/100 g,pH值6.0,121℃、0.1 MPa条件灭菌30 min。
鲜白酒糟:由贵州省青酒集团提供,玉米粉、菜籽粕于当地购买。
1.2 实验方法
1.2.1 拮抗实验
将班图酒香酵母、枯草芽孢杆菌、绿色木霉、嗜酸乳杆菌4种菌两两组合分组,将每组的其中1种菌以10 mm的间隔划线接种于普通培养基上,然后取另外一种菌垂直划一条直线,30℃培养24 h,观察十字交叉处是否有被抑制而发生菌落萎缩和消失的现象。
1.2.2 酒糟微生物固态发酵
分别挑取Y1~Y44种菌纯培养物,各接种一环于100 ml液体培养基中,150 r/min、30℃摇菌。摇菌后将4种菌以单菌、双菌、三菌、四菌搭配分为14组每组3个重复,每个重复按相等比例,总接种量为6%[20]的比例接种到酒糟饲料发酵培养基中。绿色木霉接种摇菌后第36 h的,活菌数达到 7.00×1010cfu/ml、酵母菌接种摇菌后第32 h的,活菌数达到3.50×1011cfu/ml、乳酸菌接种摇菌后第16 h的,活菌数达到2.10×1010cfu/ml、枯草芽孢杆菌接种摇菌后第22 h的,活菌数达到1.33×1011cfu/ml。接种后以 1~4 d 有氧,5~10 d 为厌氧,发酵温度均为30℃。具体分组为:第1组:对照组(发酵前的样品,未接菌、未发酵)、第2组:单接Y1、第3组:单接 Y2、第4组:单接 Y3、第5组:单接 Y4、第6组:Y1+Y2、第7组:Y1+Y3、第8组:Y2+Y3、第9组:Y1+Y4、第10组:Y2+Y4、第11组:Y3+Y4、第12组:Y1+Y2+Y4、第13组:Y2+Y3+Y4、第14组:Y1+Y2+Y3、第15组:Y1+Y2+Y3+Y4。
1.2.3 营养成分的测定
酶活测定:发酵第7 d取样采用ELISA试剂盒测定蛋白酶、淀粉酶、脂肪酶、纤维素酶活性浓度。
酒糟饲料发酵培养基各养分指标:将发酵前及发酵第10 d的饲料样品混匀、烘干、粉碎制备成分析试样。干物质测定采用直接干燥法 (GB/T6435—2006);马福炉550℃高温灼烧法(GB/T6438—2007)测定粗灰分;凯氏定氮法(GB/T6432—1994)测粗蛋白;中性洗涤纤维、酸性洗涤纤维含量参照 Van Soest等[21]的方法测定;氨基酸含量按照GB/T5009.124—2003法采用日立835-50氨基酸分析仪测定;脂肪酸含量按照GB/T 9695.2—1988,采用日本岛津GC-14C气相色谱仪测定。
1.2.4 数据处理
采用SAS9.21 GLM Duncan法对数据进行方差分析,显著标准为0.05。统计结果均以平均值或平均值±标准差表示。
2 结果与分析
2.1 拮抗实验结果
各组菌种十字交叉处均未出现菌落萎缩和消失的现象,得出结论各菌间均不存在拮抗效应,适合组合发酵酒糟培养基。
2.2 不同菌种组合酒糟生物饲料的酶活结果(见表1)
由表1可知,发酵第7 d与对照组相比各处理组蛋白酶、淀粉酶、脂肪酶、纤维素酶活性浓度都有增加,其中蛋白酶活性浓度为229.21~336.05 U/g,增率为 8.20%~58.60%,差异最显著的为第2、7、15组(P<0.05);淀粉酶活性浓度为247.95~371.08 U/g,增率为2.5%~53.5%,与对照组相比差异最显著的为第12组其次为第15组(P<0.05);脂肪酶活性浓度为89.93~158.89 U/g,增率为0.4%~77.4%,与对照组相比差异最显著的为第3组(P<0.05);纤维素酶活性浓度为31.27~104.78 U/g,增率为4.6%~250.6%,与对照组相比差异最显著的为第5组其次为第15组(P<0.05)。从而可知在添加量一定的情况下添加一种或三种菌只能使其中一种酶活性浓度达最大,产酶不全面。综合考虑4种酶的活性浓度,第15组的结果比较理想。4种菌一起添加不仅能使酶的分泌全面而且酶活浓度与单一添加相差很小。
2.3 不同菌种组合酒糟生物饲料的常规营养成分结果(见表 2)
由表2可知与对照组相比各处理组干物质含量为92.92%~95.31%,增率为0.20%~2.80%,差异最显著的是第15、13、10组(P<0.05),其中第15组含量达95.31%比对照组提高2.80%;与对照组相比各处理组粗蛋白含量为21.03%~23.20%,增率为36.80%~50.90%,差异最显著的是第15组(P<0.05),含量为23.20%比对照组提高50.90%;与对照组相比各处理组酸性洗涤纤维、中性洗涤纤维降低率分别为23.70%~50.20%、16.80%~41.20%,差异最显著的都是第15组(P<0.05)分别比对照组降低了50.20%、41.20%;与对照组相比各处理组粗灰分含量为9.35%~11.15%增率为59.60%~90.30%,差异最显著的是第15组(P<0.05),含量达11.15%比对照组提高90.30%。综合考虑以上5种常规成分,第15组的效果最理想。
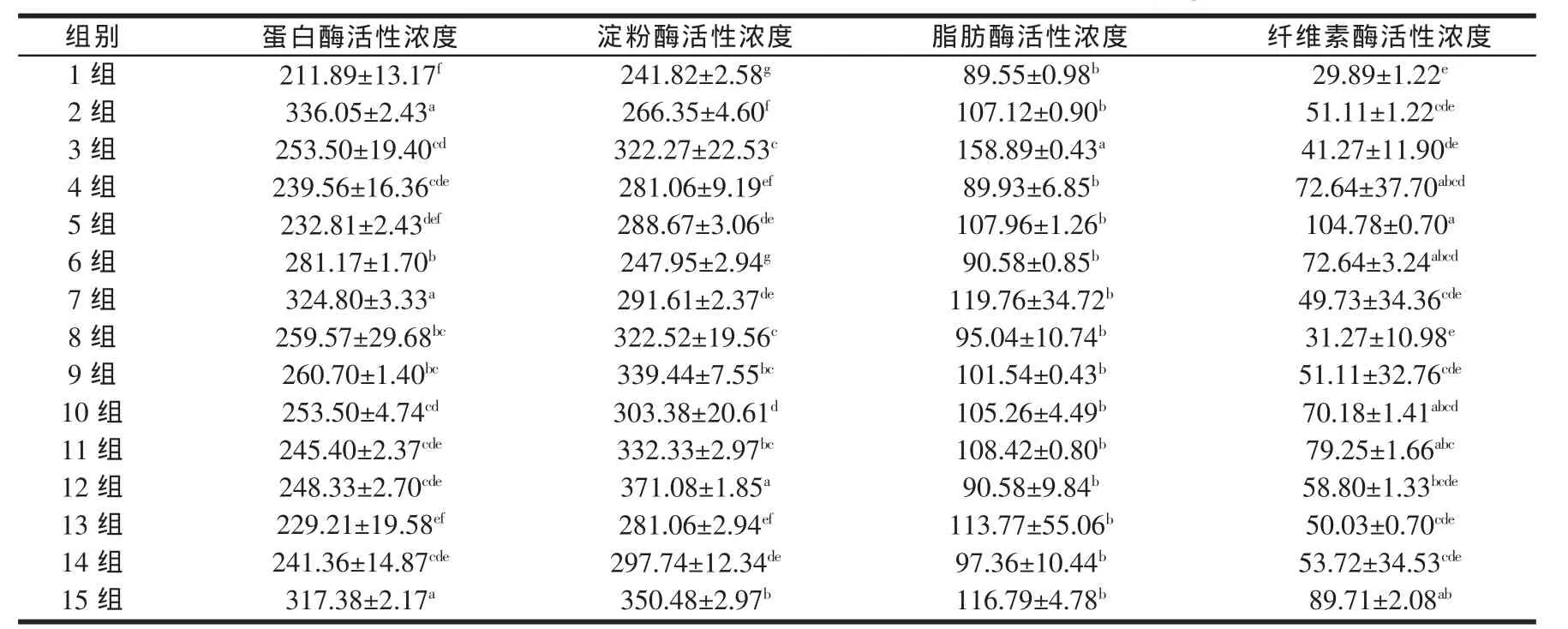
表1 各组蛋白酶、淀粉酶、脂肪酶、纤维素酶酶活测定结果(U/g)

表2 发酵前后各组常规成分含量(%,风干基础)
2.4 不同菌种组合酒糟生物饲料的脂肪酸含量(见表3)
由表3可知酒糟培养基料中含有较丰富的脂肪酸,主要含有17种脂肪酸,即饱和脂肪酸 7种,不饱和脂肪酸10种,其中单不饱和脂肪酸4种,多不饱和脂肪酸6种。与对照组相比第15组二十二碳六烯酸(DHA)的含量最高,比对照组提高11.50%。各处理组单不饱和脂肪酸之和为25.65%~26.87%,与对照组相比差异最显著的为第7、8组(P<0.05),分别比对照组提高1.50%、1.60%。各处理组多不饱和脂肪酸之和为30.85%~31.87%与对照组相比差异最显著的为第12、15组(P<0.05),比对照组提高 4.90%。从功能性脂肪酸和多不饱和脂肪含量出发综合来看第15组要优于其它组。
2.5 不同菌种组合酒糟生物饲料的氨基酸含量(见表4)
本实验对酒糟混合料中的17种氨基酸进行了测定,即必需氨基酸9种,非必需氨基酸8种。由表4可知各处理组氨基酸总量为15.74%~19.18%,与对照组相比差异最显著的为第8组(P<0.05)含量达19.18%,其次为11、15组分别为18.65%、18.31%,各比对照组提高23.70%、20.30%、18.10%;必需氨基酸之和为6.81%~8.55%,与对照组相比差异最显著的为第8组(P<0.05)含量达8.55%,其次为11、15组分别为8.31%、8.15%,分别比对照组提高22.00%、18.50%、16.30%;鲜味氨基酸之和为6.59%~7.74%,与对照组相比差异最显著的为第8组(P<0.05),其次是第11、13、15组分别比对照组提高27.50%、22.20%、19.90%、19.80%。综合考虑氨基酸总量、必需氨基酸总量和鲜味氨基酸总量,第8组效果最好其次是第11、15组。
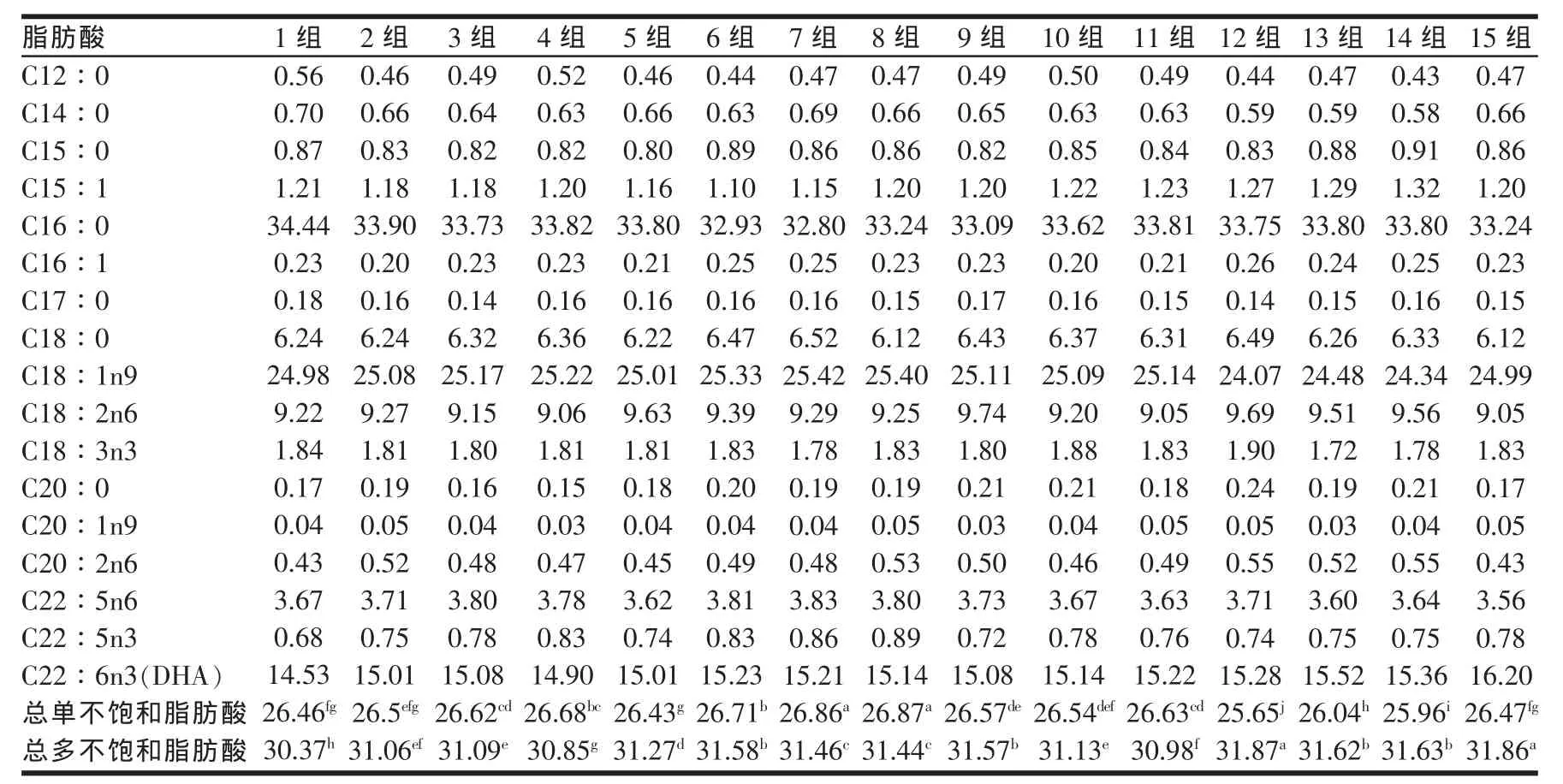
表3 发酵前后各组脂肪酸含量(%)
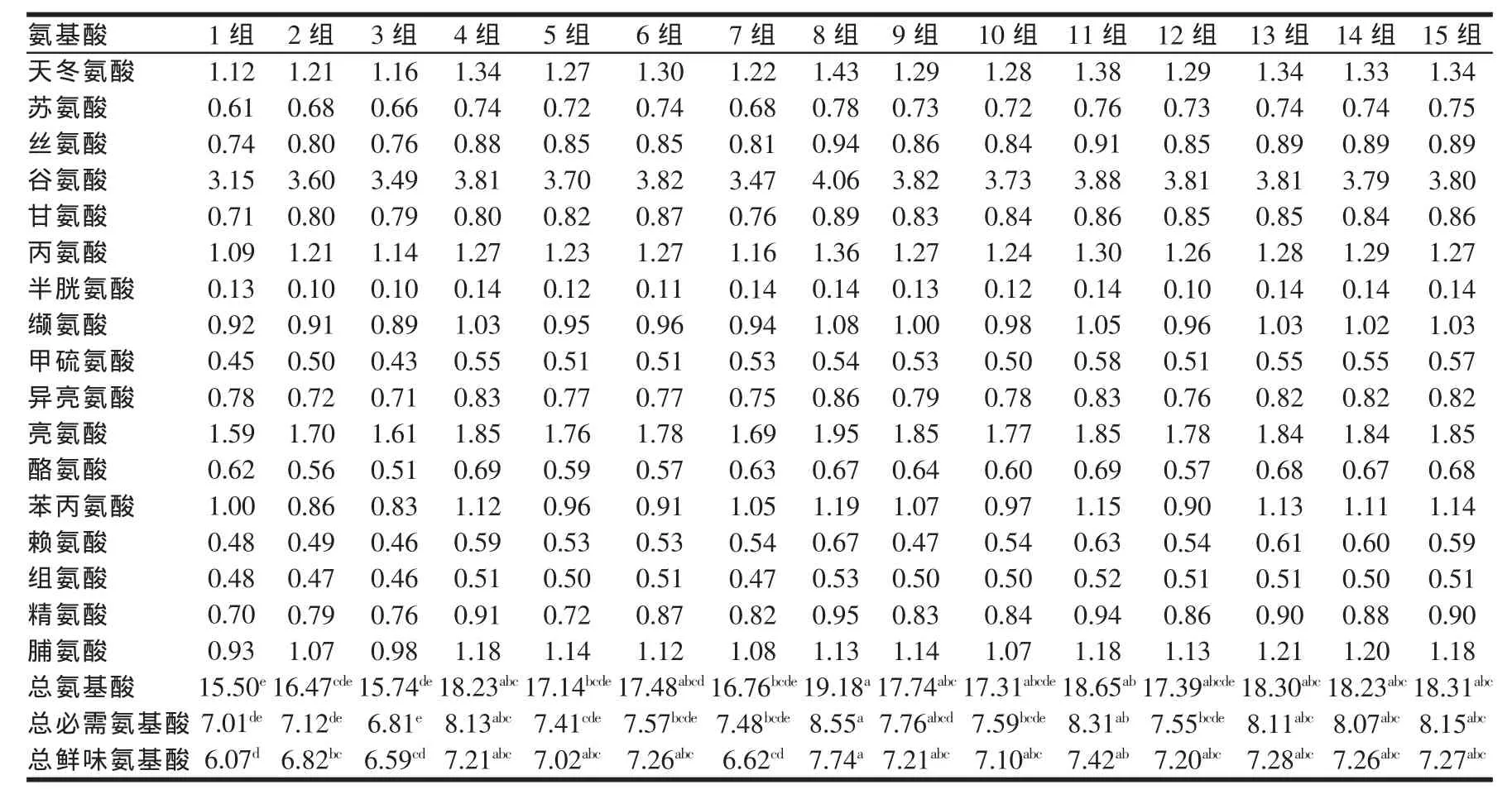
表4 发酵前后各组氨基酸含量(%)
3 讨论与结语
3.1 不同菌种组合对酒糟生物饲料酶活的影响
动物日粮中添加一定酶制剂可以补充动物内源酶的不足,刺激内源酶分泌提高动物对日粮的利用率。同时还可以改善消化道酶系组成、酶量及活性。高玉红等(2000)[22]研究了复合酶(主要含酸性蛋白酶、糖化酶、α-淀粉酶、纤维素酶及果胶酶)对断奶仔猪饲料利用的影响,结果发现复合酶可以提高断奶仔猪的生产性能,显著提高饲料中干物质、粗蛋白和粗脂肪的消化率,而且随着酶活水平的提高,血浆葡萄糖含量也呈极显著增加。本研究筛选出第15组(Y1+Y2+Y3+Y4组)效果最好,4种菌一起添加不仅能使酶的分泌更全面而且各酶活浓度都比较高,能在一定程度上补充动物所需的内源酶。
3.2 不同菌种组合对酒糟生物饲料常规营养成分的影响
采用能降解纤维素大量产生蛋白质的菌株对酒糟进行发酵这既扩大了饲料来源又提高了资源利用率,本研究所做各处理组中第15组效果最明显,干物质达到95.31%比对照组提高2.80%。粗蛋白能达到23.20%比对照组提高50.90%。与对照组相比各处理组酸性洗涤纤维、中性洗涤纤维都降低,效果最好的是第15组分别比对照组降低了50.20%、41.20%。粗灰分能达到11.15%比对照组提高90.30%。这既提高了饲料的营养价值又提高了饲料的适口性和利用率。
3.3 不同菌种组合对酒糟生物饲料脂肪酸含量的影响
丰富的不饱和脂肪酸含量是发酵饲料具有较高营养价值的物质基础[23]。本研究中各处理组都含有较丰富的脂肪酸,其中第15组二十二碳六烯酸(DHA)的含量最高,比对照组提高11.50%。多不饱和脂肪酸之和与对照组相比差异最显著的为第12、15组(P<0.05),都比对照组提高4.90%。综合来看第15组要优于其它组。
3.4 不同菌种组合对酒糟生物饲料氨基酸含量的影响
蛋白质是生命的物质基础,而动物对蛋白质的需求本质上是对氨基酸的需求,因此饲料中氨基酸的种类和含量是衡量其质量高低的一项重要指标。本实验对酒糟混合料中的17种氨基酸进行了测定,发现与对照组相比各处理组含氮物质的形式发生了变化,主要表现为氨基酸总量和必需氨基酸总量、鲜味氨基酸总量的增加这与Weinberg Z G(1993)[24]的研究结果相符合。氨基酸总量为第8组最高达19.18%其次为11、15组分别为18.65%、18.31%;必需氨基酸之和为第8组含量最高达8.55%其次为11、15组分别为8.31%、8.15%;鲜味氨基酸之和为第8组最高,其次是第11、13、15组。综合来看第8组效果最理想,其次是第11、15组。
综合考虑以上四个因素最终筛选出第15组为最佳菌种组合,也就是所选4种菌以相等比例一起添加。从而也证明这4种菌相互间有协同的作用,联合添加发酵白酒糟能达到更好的效果。
[1]孙书静.废酒糟生产精甘油[J].化工技术与开发,2006,35(4):50.
[2]丁琳,聂英龙,仇兴华,等.酒糟发酵制取甘油的研究[J].沈阳化工学院学报,2004,14(2):158.
[3]邵伟熊,泽周媛.酒糟料栽培金针菇初探[J].食用菌,2000(4):25.
[4]王世东,周学政.酒糟栽培鸡腿菇高产技术[J].中国食用菌,2004,23(6):30-31.
[5]游玲,王涛,祝晓波,等.浓香型白酒丢糟生产茶树菇的初步研究[J].酿酒科技,2009(6):12-15.
[6]蒋莹,黄美英,等.从酒糟中提取复合氨基酸及微量元素[J].食品工业科学,1991,6:14-16.
[7]顾宏帮,史建裴,曲济方,等.从酒糟中提取植酸及菲汀的研究[J].山西食品工业,1995,4:5-7.
[8]罗乐,姚福荣,刘微.固态发酵酒糟醋与传统醋的比较研究[J].中国调味品,2009,34(4):82-84.
[9]高晓娟,王君高,王欣,等.酒糟在食醋酿造中的应用研究[J].中国调味品,2010,35(7):45-47.
[10]邢颖,李菽琳,石艳,等.酒糟和果渣厌氧发酵产沼气特性研究[J].河南农业科学,2011,40(12):88-90.
[11]Bories A,Raynal J.Anaerobic treatment of high strength distillery waste water(Cane molasses stillage)by two phase anaerobic digestion[J].Biol.Waster,1985,20(4):251-267.
[12]王蛮.酒精蒸馏废糟中提取蛋白质试验的研究[J].酿酒科技,1994,2:65-69.
[13]谢林.DDGS生产的关键设备与工艺[J].酿酒科技,1992(4):72-75.
[14]陈曦,赵建国.混株发酵混合酒糟生产含酶蛋白饲料的研究[J].中国酿造,2006(5):30-33.
[15]宋安东,张建威,吴云汉,等.利用酒糟生物质发酵生产燃料乙醇的试验研究[J].农业工程学报,2003,19(4):278.
[16]高路.酒糟的综合利用[J].酿酒科技,2004,25(5):101.
[17]高路.小议啤酒副产物综合利用[J].酿酒,2001,5(28):50-51.
[18]蔡治华,徐新建,郭亮.饲喂微贮啤酒糟对黑白花奶牛产乳性能的影响[J].安徽技术师花学院学报,2003,17(1):22-23.
[19]陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1996,494-495.
[20]吴天祥.芭蕉芋、玉米生产燃料酒精及酒糟乳酸化饲料发酵工艺的研究[D].江苏:江南大学发酵工程,2004.
[21]Van Soest P J,Robertson J B,Lewis B A.Methods for dietary fiber,neutral detergent fiber,andnon-starch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[22]高玉红,等.纤维素酶断奶仔猪生产性能和消化吸收能力的影响研究[J].中国兽医学报,2000(3):8210.
[23]吴时敏.功能性油脂[M].北京:中国轻工业出版社,2001.
[24]Weinberg Z G,Ashbell G,Azrieli A,et al.Ensilage peas,ryegrass and wheat with additives of Lactic acid bacteria(LAB)and cell wall degrading enzymes[J].Grass forage Sci.,1993,48:70-78.

