海水淹溺型急性肺损伤早期肺组织核因子-κB及相关细胞因子的动态变化
芮 萌,王 津,宁浩勇,张新红,王大鹏,段蕴铀
海水淹溺型急性肺损伤(seawater drowninginduced acute lung injury,SWD-ALI)是 ALI的一个特殊类型,由于海水高渗、偏碱等特性,使SWD-ALI具有病情重、变化快、救治难度大的特点,并成为海水淹溺主要死亡原因。与其他直接损伤因素一样,淹溺导致海水吸入不仅会直接损伤肺实质细胞,而且还会通过激活急性炎症反应,引起肺局部甚至全身炎症反应综合征,后者更是进一步成为导致ALI多种病理过程的主要因素。已有资料显示,炎症反应关键性控制点可能是位于胞浆中的核因子-κB(nuclear factor-kappa B,NF-κB),其作用犹如核内炎症介质基因转录的启动开关[1],调节多种参与炎症免疫反应的细胞因子、炎症介质、黏附分子及蛋白酶类的基因转录,以控制它们的生物合成,但NF-κB活化在SWD-ALI发生、发展中的作用鲜见报道。为此,我们通过建立兔SWD-ALI模型,借助非放射性凝胶迁移实验(electrophoretic mobility shift assay,EMSA)、酶联免疫吸附测定(enzyme-linked immunosorbentassay,ELISA)等方法,观察肺组织 NF-κB活性及相关细胞因子在SWD-ALI发病过程中的动态变化,为SWD-ALI发病机制的研究提供实验基础。
1 材料与方法
1.1 实验动物和分组 选用健康新西兰兔(购自北京科宇动物养殖中心,普通级,合格证号:SCXK2京2200220005),雌雄不拘,体质量(2.20±0.25)kg。将实验动物用随机数字表法分为对照组(作为0 h基线值,即0h组)和海水灌注1 h(S1h)组、3 h(S3h)组、6 h(S6h)组、12 h(S12h)组、24 h(S24h)组(分别于海水灌注后 1、3、6、12、24 h 处死动物,检测相关指标)。
1.2 动物模型制备和处理 动物模型制备参照文献[2-3]。新西兰兔经速眠新和氯胺酮(1∶1)1 ml/kg肌内注射麻醉(后续实验中按需给予1∶1速眠新和氯胺酮维持动物麻醉状态),仰卧固定于动物手术台。颈总动脉插管,连接三通,用于监测血压、心率、呼吸,给药及获得血标本。气管切开,插入“Y”型玻璃套管。海水灌注组通过“Y”型玻璃套管,注入2 ml/kg的配方海水[2],5 min内灌完,呼吸空气,于灌注后0.5 h开始间断检测动脉血气,根据动脉血氧分压(arterial partial pressure of oxygen,PaO2)和吸入氧浓度(forced inspiratory oxygen,FiO2)结果计算氧合指数(PaO2/FiO2)=PaO2/0.21,以200≤PaO2/FiO2≤300且持续1 h以上作为模型制备成功的标准。按照分组分别于灌注后相应时间点抽血处死;对照组完成手术操作,不灌注液体,直接抽血处死。
1.3 标本采集 各组动物处死前抽血查总蛋白(total protein,TP),随后迅速开胸、夹闭气管取全肺。肺组织处理:①取右上、中肺称湿重(wet weight,W),置于80℃烘箱内干燥72 h至恒重,称肺干重(dry weight,D),计算肺湿干重比值(W/D)。②取右下肺作肺泡灌洗,用10 ml生理盐水分2次进行灌洗,灌洗液回收量在80%以上,离心,上清液检测TP。计算肺通透指数(lung permeability index,LPI)=灌洗液TP/血清TP。③在左下肺相应部位分别取2份肺组织;1份用4%多聚甲醛固定,常规石蜡包埋切片,苏木素和伊红(hematoxylin and eosin,HE)染色,另外1份-70℃保存备用。
1.4 细胞因子浓度测定 取冻存肺组织200 mg左右,在体积总量为组织重量9倍的预冷生理盐水中,研磨制备组织均浆。采用双抗夹心ELISA法测定肺组织匀浆中肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白介素(interleukin,IL)-1β、IL-10等细胞因子浓度。操作按试剂盒(Rapidbio公司,美国)说明书步骤进行。
1.5 肺组织核蛋白提取和NF-κB活性测定 采用非放射性EMSA。取冻存肺组织300 mg左右,按说明书步骤抽提核蛋白(Viagene公司,美国),测定核蛋白浓度(碧云天生物公司)。取5 μg核蛋白与400 fmol(1 fmol=10-15mol=10-3pmol)生物素双标NF-κB探针室温孵育20 min,6.5%聚丙烯酰胺凝胶电泳分离,通过电转移法将DNA-蛋白复合物转移到结合膜上,紫外灯下交联固定10 min,室温封闭30 min,与新配制的辣根过氧化物酶标记链霉亲和素(Streptavidin-HRP)反应液室温孵育20 min,洗涤平衡后,将化学发光试剂加于结合膜表面,立即以Cool Imager(Viagene公司,美国)进行化学发光数字成像。以积分灰度值表示NF-κB活性。Bio-NF-κB探针序列为5'-AGTTGAGGGGACTTTCCCAGGC-3'。Cold-NF-κB探针序列同前。阳性对照为THP-1细胞经过TNF-α刺激后得到的NF-κB核转运阳性物质。
1.6 肺组织病理观察 肺损伤病理评分(lung pathologic score,LPS)参照有关资料[3]进行,每组取6张切片,每张切片取5个视野,根据毛细血管淤血、肺泡腔纤维蛋白渗出、中性粒细胞渗出、肺泡间隔增宽等项目的得分,将每个视野各项积分相加,将等级资料转换为计量资料,分析判断肺损伤程度。
1.7 统计学处理 采用SPSS 13.0统计软件进行分析,计量数据以均数±标准差(±s)表示。对不同实验组在各个时间点各项数据的比较均采用重复测量资料的方差分析,若有差异,则采用SNK-q法进一步进行两两比较;对同一组处理后各时间点与处理前的比较采用Dunnett-t检验。NF-κB与各指标相关性分析采用直线相关完成。P<0.05为差异有统计学意义。
2 结果
2.1 PaO2/FiO2的变化 海水灌注后 0.5、1、2、3、6 h PaO2/FiO2依次为(203.8±37.8)、(248.7±67.0)、(253.2 ±73.6)、(287.8 ±14.0)、(308.2 ±61.0)mmHg,与对照组(422.8±42.6)mmHg比差异显著(P <0.01)。0.5、1、2、3 h 的 PaO2/FiO2均>200 mmHg且 <300 mmHg,表明 SWD-ALI模型制备成功。
2.2 肺组织病理改变 肺大体标本以S3h组淤血水肿最严重,呈暗红色,体积最大,与肺损伤指标的变化大体一致。HE染色显示对照组肺泡结构清晰、扩张均匀,肺泡壁薄,肺间质未见明显水肿、出血和炎性细胞浸润。S1h组以肺间质淤血最明显,S3h组肺间质淤血及炎症细胞浸润均较显著,S6h、S12h组以炎症细胞浸润最突出;肺泡间隔宽度、肺泡腔塌陷或扩张范围和程度,随时间延长而逐渐加重,S12h组肺泡隔明显增宽(不均匀),S24h组大部分区域已失去正常肺泡结构(图1)。各海水灌注组LPS与对照组比均有统计学差异(P<0.01),以S6h组LPS最高,6 h后各组无统计学差异(表1)。
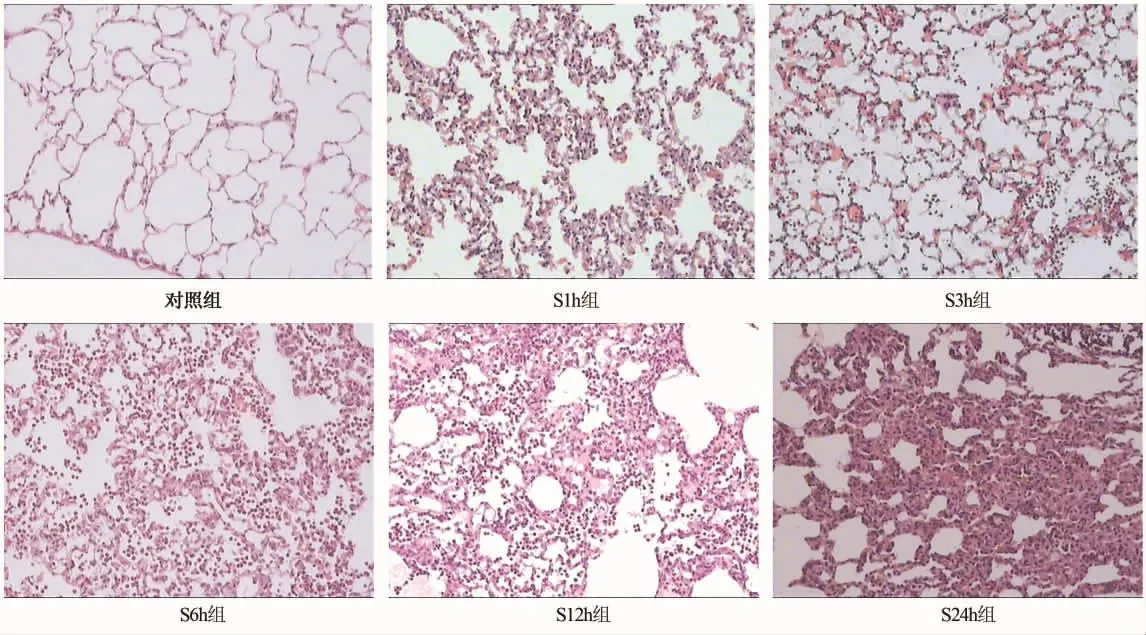
图1 海水灌注后各时间点肺组织HE染色(×100)
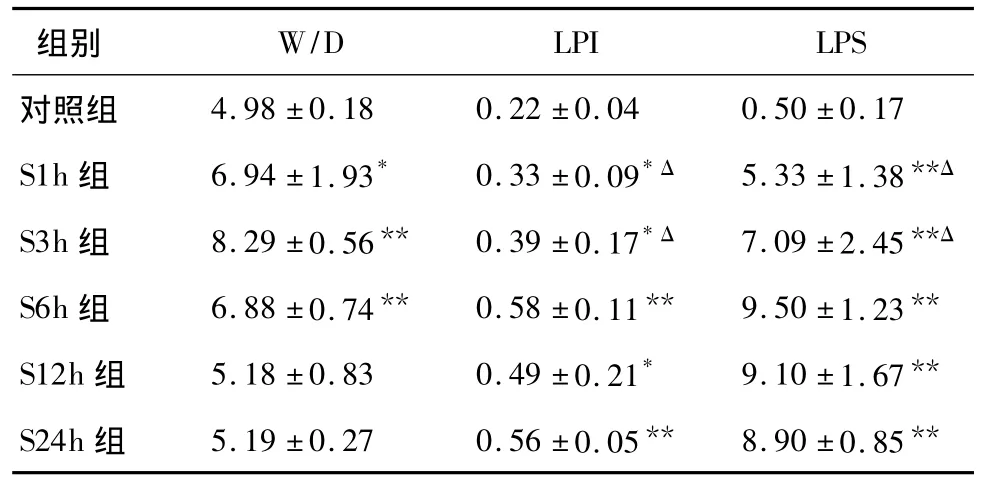
表1 各组肺病理评分、W/D和肺通透指数的动态变化
2.3 肺损伤指标的变化 由表1可见,与对照组相比,各海水灌注组肺通透指数显著增高(P<0.05),并以S6h组数值最高,但与S12h组、S24h组比较无差异。W/D于3 h达高峰,6 h有所下降,但仍明显高于对照组(P<0.01),S12h组、S24h组与对照组比较差异无统计学意义。
2.4 肺组织 TNF-α、IL-1β、IL-10变化 与对照组相比,海水组各时间点肺组织 TNF-α、IL-1β、IL-10均显著增高(P<0.05),并以S6h组数值最高(图2)。
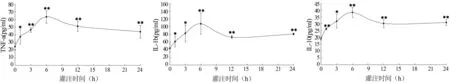
图2 兔SWD-ALI时肺组织细胞因子的动态变化
2.5 肺组织NF-κB DNA结合活性的变化 海水灌注后1 h肺组织核提取物NF-κB DNA复合物电泳图与对照组相比有所增强,3~6 h达高峰;12~24 h有所减弱,但仍明显强于对照组;同一时间点积分灰度值亦相应地高于对照组(P<0.05,图3)。

图3 各组NF-κB DNA复合物EMSA电泳条带及积分灰度值
2.6 相关性分析 0~6 h时间段内,NF-κB活性与TNF-α、IL-1β、IL-10 及 LPS 正相关,相关系数 r分别为0.971、0.981、0.987、0.967(P < 0.05)。0 ~24 h时间段内,NF-κB活性仅与肺组织IL-1β、IL-10保持相关性,r分别为0.827、0.816(P < 0.05)。TNF-α、IL-1β、IL-10 与 LPS 正相关,r分别为0.900、0.847、0.904(P <0.05)。TNF-α、IL-1β、IL-10 与 LPI的相关系数分别为0.833、0.828、0.851(P <0.05)。
3 讨论
肺是淹溺后受损的主要器官。已有学者报道吸入1~3 ml/kg的液体就足以使人肺气体交换功能产生显著障碍,肺顺应性降低10%~40%[4]。为此本实验选用2 ml/kg体质量的液体量制备兔SWDALI模型。灌入海水后,实验动物氧合指数0.5~3 h均在200~300 mmHg之间,直至6 h才超过300 mmHg;肺湿干重比值明显高于对照组;肺通透指数1 h时已显著增高,6 h后基本维持在高峰水平,提示肺泡毛细血管通透性的增加持续存在。病理学检查可见炎症细胞浸润、肺泡水肿、肺间质淤血增宽等ALI征象,均提示SWD-ALI模型制备成功。
肺内过度性、失控性炎症反应是各种致病因素导致ALI的根本原因,基因调控在炎症反应发生、发展中的地位日益受到重视,其中NF-κB被证实具有关键作用。NF-κB属于Rel家族,几乎存在于所有真核细胞,典型组成为p50/p65异源二聚体,通常与其特定抑制蛋白IκB耦联,以无活性形式存在于胞浆内。经典的 NF-κB活化途径聚焦于 IκB激酶(IκB kinase,IKK)复合体,各种刺激信号借助受体将信号传递至胞浆,通过激活IKK,磷酸化IκB,解离 NF-κB,并迅速触发泛素-蛋白酶体系降解 IκB。游离的NF-κB二聚体因暴露核定向信号而活化,移入核内与靶基因启动子或增强子上的κB位点发生特异性结合,并促使基因转录[5-8]。本实验中,海水灌注后1 h NF-κB含量和活性已显著增高,3 h活化的NF-κB就已增加了2.5倍(107.82/42.65);当肺泡毛细血管通透性进行性增加,肺损伤进一步加重时,NF-κB转录活性增加的倍数也上升到2.9(6 h,125.34/42.65),在肺损伤进行性加重至高峰过程中,NF-κB活性亦进行性升高,两者之间显著相关。提示SWD-ALI早期NF-κB激活参与了肺损伤发生、发展的进程。12~24 h NF-κB活性仍明显强于对照组,但已有所减弱,与LPS相关程度亦在下降。一方面可能与NF-κB活化的反馈调节机制有关,另一方面亦可能与NF-κB不是唯一的基因调控机制有关,体现了SWD-ALI发病机制的复杂性。
NF-κB活化的调节途径有正、负反馈两个方向,其中TNF-α、IL-1β既是NF-κB活化的激动剂,又是受其调节的转录产物[9-11];而抗炎细胞因子IL-10等则有抑制 NF-κB 活化的功能[11-12],NF-κB 状态取决于占优势的调节方式。TNF-α、IL-1β是在全身及局部炎症反应早期起重要作用的炎症细胞因子,亦是构成炎性损伤级联放大效应的重要组成部分。本实验中,海水淹溺后早期伴随 NF-κB转录活性的上升,肺组织中TNF-α、IL-1β浓度也在相应增加,并于6 h达峰值,虽然由于机体自我清除机制,随着时间推移亦在自行下降[13],但下降速度比较缓慢,24 h时仍维持在2倍于对照组的水平,与肺通透指数、肺损伤程度的动态演变密切相关,尤其IL-1β在监测的24 h内始终与NF-κB活性保持相关性,该正反馈机制促使着炎症反应的扩大和持续。转录因子和促炎症细胞因子在不同层面协同参与了SWD-ALI的发病机制。IL-10表达量虽然亦明显增高,但未能表现出抑制NF-κB转录活性的作用。提示海水淹溺激活急性炎症反应的同时,亦激活了机体的抗炎反应,只是抗炎反应不足以对抗炎症反应,正、负反馈调节的不协调性进一步导致大量促炎和抗炎介质的释放及组织的损伤,机体稳态破坏,形成了ALI。
文献报道NF-κB是产生炎症因子的总环节,因其在急性炎症反应时的中心调控作用,被称为极具潜力的新型抗炎靶点。在我们的SWD-ALI模型中,NF-κB活化持续存在,与早期炎症因子的过度释放密切相关。提示在SWD-ALI的炎症反应放大环路中,NF-κB同样起着重要作用,及时适量地抑制NF-κB活性或许可以成为SWD-ALI重要防治措施。
[1]Le Page C,Popescu O,Génin P,et al.Disruption of NF-kappa B signaling and chemokine gene activation by retroviral mediated expression of IKK gamma/NEMO mutants[J].Virology,2001,286(2):422-433.
[2]芮萌,段蕴铀,张新红,等.海水淹溺型急性肺损伤兔外周血中性粒细胞凋亡的动态变化[J].解放军医学杂志,2009,34(7):826-829.
[3]芮萌,段蕴铀,张新红,等.中性粒细胞活化在海水淹溺致肺损伤中的作用[J].中国急救医学,2010,30(7):618-621,封 3.
[4]Orlowski JP,Szpilman D.Drowning,Rescue,resuscitation,and reanimation[J].Pediatr Clin North Am,2001,48(3):627-646.
[5]Matsuda N,Hattori Y.Systemic inflammatory response syndrome(SIRS):molecular pathophysiology and gene therapy[J].J Pharmacol Sci,2006,101(3):189-198.
[6]Vykhovanets EV,Shukla S,MacLennan GT,et al.IL-1 beta-induced post-transition effect of NF-kappa B provides time-dependent wave of signals for initial phase of intrapostatic inflammation[J].Prostate,2009,69(6):633-643.
[7]Zheng C,Yin Q,Wu H.Structural studies of NF-κB signaling[J].Cell Res,2011,21(1):183-195.
[8]Wang F,Xia ZF,Chen XL,et al.Angiotensin Ⅱ type-1 receptor antagonist attenuates LPS-induced acute lung injury[J].Cytokine,2009,48(3):246-253.
[9]Wu C,Wang P,Rao J,et al.Triptolide alleviates hepatic ischemia/reperfusion injury by attenuating oxidative stress and inhibiting NF-κB activity in mice[J].J Surg Res,2011,166(2):e205-e213.
[10]Song XQ,Lv LX,Li WQ,et al.The interaction of nuclear factor-kappa B and cytokines is associated with schizophrenia[J].Biol Psychiatry,2009,65(6):481-488.
[11]Punsawad C,Krudsood S,Maneerat Y,et al.Activation of nuclear factor kappa B in peripheral blood mononuclear cells from malaria patients[J].Malar J,2012,11:191.
[12]Asadullah K,Sterry W,Volk HD.Interleukin-10 therapy--review of a new approach[J].Pharmacol Rev,2003,55(2):241-269.
[13]Malleo G,Mazzon E,Siriwardena AK,et al.Role of tumor necrosis factor-alpha in acute pancreatitis:from biological basis to clinical evidence[J].Shock,2007,28(2):130-140.

