反胶束萃取α-淀粉酶动力学分析
张建国,陈晓明,熊双丽,钱会芳
(西南科技大学生命科学与工程学院,四川绵阳 621010)
反胶束萃取α-淀粉酶动力学分析
张建国,陈晓明,熊双丽,钱会芳
(西南科技大学生命科学与工程学院,四川绵阳 621010)
利用恒界面池,在双膜理论基础上建立了CTAB-异辛烷-正丁醇反胶团体系萃取α-淀粉酶的动力学模型。考察了不同起始酶活浓度、搅拌转速、pH、液相离子强度以及表面活性剂和助表面活性剂浓度对α-淀粉酶萃取表观传质系数kL的影响并对利用改变恒界面大小在判断传质控制机理方面进行了探讨。结果表明,起始酶活浓度在1105U·L-1到4420U·L-1条件下,残酶浓度对萃取时间常用对数曲线为一直线且斜率恒定,表明该动力学方程能够较好地描述α-淀粉酶萃取过程且与初始酶活浓度在无关;搅拌转速、水相pH、水相离子强度、表面活性剂和助表面活性剂浓度对萃取过程中α-淀粉酶表观传质系数kL都有影响,从而改变传质的机制。在规定的条件下,萃取速率对恒界面相对斜率随着pH增加而减小,当pH为9.9、10.8、11.9时,萃取过程分别以界面控制、混合控制、扩算控制为主,由此可见传质速率对恒界面大小变化相对斜率可以表征界面控制的影响程度。
α-淀粉酶,反胶束萃取,动力学,表观传递系数(kL)
α-淀粉酶(EC3.2.1.1)属于淀粉内切型水解酶,广泛的应用在发酵、食品、纺织、制革、医药工业、石油开采、轻化工等行业,是世界应用量最大的工业酶制剂之一[1]。目前,工业上对α-淀粉酶的提取主要有两种方法:一种是用硫酸铵直接沉淀;另一种是絮凝-超滤-乙醇沉淀法[2]。由于α-淀粉酶在不同行业的使用对α-淀粉酶的质量要求不同以及提取物料的物理化学性质限制了提取方法的高效应用。20世纪70年代提出反胶束可提取酶蛋白后,国内外利用反胶团萃取蛋白酶均有大量报道[3]。近年来,反胶束萃取仍是研究热点[4-6],在α-淀粉酶的反胶团萃取方面主要集中在工艺条件优化方面[7-10],但利用动力学考察萃取条件对萃取过程的影响方面鲜见报道。萃取动力学研究是深入了解萃取过程的有效手段,可以深入了解萃取过程的机制。由于反胶团萃取蛋白质机理复杂且研究历史较短,目前反胶团萃取研究过程仍处于半理论半经验的阶段[10],加强对反胶团动力学过程的研究,有利于对萃取条件进行有效控制,在萃取设备的选型和设计方面有着重要的意义[11]。混合澄清槽、恒界面池是研究反胶团动力学过程常用的手段之一[12-13],在对酶进行反胶团萃取过程中,主要有混合澄清槽和恒界面池法。混合澄清槽建立动力学模型多用于研究萃取条件对萃取体积传质系数和萃取率的影响;恒界面池法建立的动力学方便研究萃取条件对传质系数和萃取速率的影响,较混合澄清槽建立的动力学更有利于对萃取机制的研究。Matthijs Dekker等[14]利用恒界面池建立动力学模型对影响α-淀粉酶反胶团萃取传质速率进行了探讨,其后利用动力学对α-淀粉酶反胶团萃取的研究鲜见报道。本文利用恒界面法,以CTAB-异辛烷-正丁醇反胶束体系萃取α-淀粉酶为研究对象,利用“双膜传质”理论为基础,建了α-淀粉酶传递的动力学模型。研究了水相pH、离子强度、无机相中α-淀粉酶浓度、搅拌强度等操作条件对α-淀粉酶物质表观传递系数的影响。为深入了解α-淀粉酶在该体系下萃取过程的机理、为萃取过程的优化和开发提供理论基础。
1 材料与方法
1.1 材料与仪器
CTAB 国药集团化学试剂有限公司;正丁醇成都市科龙化工试剂厂;异辛烷 成都市科龙化工试剂厂;氢氧化钠、碘化钾 国药集团化学试剂有限公司;碘、磷酸氢二钠、磷酸二氢钠 中国医药(集团)上海试剂公司;氯化钠 上海试四化工有限公司;以上试剂均为分析纯;可溶性淀粉 江苏徐州试剂二厂;盐酸 宜兴市化学试剂总厂中国医药(集团)上海试剂公司;α-淀粉酶 北京奥博星生物技术有限责任公司;粗α-淀粉酶商品经过透析,Sephadex G-100层析柱并经过SDS-PAGE(8%分离胶)检验确认为电泳纯。
TG328A型分析天平 上海天平仪器厂;3K15台式冷冻离心机 德国SIGMA公司;UV-2100分光光度计 尤尼可(上海)仪器有限公司;GZX-9246MBE电热恒温鼓风干燥箱 上海博迅实业有限公司医疗设备厂;AB204-N电子天平 上海第二天平仪器厂;YNK220-A永磁直流电机 尤尼可(上海)仪器有限公司;PHS-3TC(0.01级)精密数显酸度计 上海天达仪器有限公司;CU600电热恒温水浴锅 杭州齐威仪器有限公司。
1.2 恒界面实验装置
自制反胶束萃取动力学实验恒界面装置如图1所示,玻璃筒型容器(Ø108.2mm)装有宽度为20.1mm的四块挡板和直径为30.08mm的上下搅拌桨以及间距为8mm的多孔界面板以及可调剂的界面环,搅拌轴直径为7mm。搅拌桨在数字可调速电机的带动下进行搅拌,恒温控制在恒温水浴锅中进行。

图1 恒界面实验装置Fig.1 Structure of constant interface cell
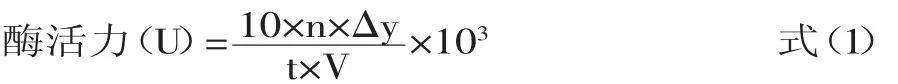
式中:n为酶液稀释倍数;t为反应时间(min);V为酶液体积(m L);10为可溶性淀粉液的体积(m L);△y为被水解的可溶性淀粉溶液的浓度。
1.3.2 恒界面池操作和萃取条件 在恒界面池中先加入一定体积的不含α-淀粉酶的水相至界面环中央,再加入一定体积的水饱和有机相,静止分层明显后根据实验要求利用带长针管的注射器向水相中注入少量α-淀粉酶溶液,启动转速已设定的搅拌器,同时计时,在规定时间内取样分析水相中α-淀粉酶活力变化,有机相中酶活变化利用差减法计算。
萃取没有特别说明条件下,有机相异辛烷-正丁醇(体积比为4∶1),CTAB为0.02g·m L-1;无机相氯化钠浓度为0.03mol·L-1,pH 11.9;搅拌速度N=250r·m in-1,萃取温度为40℃;有机相和无机相同为450m L,比恒界面S=A·V-1=0.174cm-1。
1.3 实验方法
1.3.1 淀粉酶活力测定-吸光光度法 取10m L 2%的淀粉溶液,加入2m L pH 6.0磷酸盐缓冲液,60℃预热10m in,加入取1m L待测酶液,摇匀,60℃准确反应5min,立即加入2m L 0.2%的盐酸终止反应。取出0.5m L终止反应液,加入10m L碘液,摇匀,测定其620nm时吸光值,并根据标准曲线换算为质量浓度。60℃、pH 6.0的条件下,每毫升酶液每m in水解可溶性淀粉的毫克数,为一个酶活单位(U)。
2 结果与讨论
2.1 反胶团萃取动力学过程建立
CTAB-异辛烷-正丁醇反胶束体系萃取α-淀粉酶过程假定为:α-淀粉酶在水相中扩散至界膜;在界膜靠近水相一侧与进入空反胶束形成含α-淀粉酶反胶束,含α-淀粉酶反胶束在界面中扩散至靠近有机相一侧界膜;α-淀粉酶反胶束通过扩散进入有机相。α-淀粉酶界膜传质过程和界面层化学反应类似,当扩散速率远远大于界膜传质速率时,萃取过程由界面控制;当界面传质速率远远大于扩散速率时,萃取过程由扩散速率控制;当界面传质速率与扩散传质速率相当时,萃取过程由混合控制。假定CTAB-异辛烷-正丁醇反胶束体系萃取α-淀粉酶萃取过程符合双膜理论,则α-淀粉酶萃取速率与通过界面传质速率相等;在前期萃取过程中α-淀粉酶活力浓度在一定范围内表观传质系数(kL)为恒定值,于是α-淀粉酶进入反胶束相传递通量可由下式表示:

在萃取过程中根据物料平衡可得

将(3)式代入(2)式并积分得


式中:A为恒界面池界面积(m2);c为α-淀粉酶活力单位(U·m L);H为萃取的分配系数;V相体积(m3),上角标0为初始值,下角标o、w分别为有机相和无机相。
2.2 初始水相淀粉酶浓度对萃取的影响
在规定条件下,改变初始水相中α-淀粉酶活浓度,制定ln[(1-D)/(E-D)]随时间变化曲线,结果见图2。

图2 不同α-淀粉酶活浓度下,ln[(1-D)·(E-D)-1]与时间t的关系Fig.2 Relation of ln[(1-D)·(E-D)-1]with time at differentα-amylase concentration
从图2可以看出,ln[(1-D)/(E-D)]与时间t呈直线关系,在不同α-淀粉酶初始酶活浓度下其斜率B= kLAV-1(1+H)H-1基本不变。在该实验条件下A、V、H为定值,kL为测定值,通过斜率可以得知kL不随浓度的变化而变化。可见,利用双膜理论建立的该方程描述萃取过程是可行的,通过曲线直线化求取动力参数kL是可信的,而且kL与起始水相中α-淀粉酶活力浓度无关。
2.3 不同pH、N、离子强度对kL的影响
根据双膜理论,传递过程膜的阻力与液体流动速度相关,起始搅拌转速设置由50r·min-1逐步提高搅拌转速当达到300r·m in-1时,界面振荡出现浑浊现象,故最高转速设定为250r·m in-1。通过B=kLAV-1(1+ H)H-1计算kL并绘制不同NaCl浓度、pH条件下,不同搅拌强度N对传质系数kL的影响,结果见图3、图4。
2.3.1 不同条件下N对kL的影响 从图3、图4可知,分别在低pH和高盐浓度条件下,随着N的提高,kL呈直线上升趋势。主要因为在此条件下,随着N的提高,增加了界膜两侧水相淀粉酶与有机相中含α-淀粉酶胶束的扩散,提高了“空胶团”的更新速率。当分别在高pH和低盐浓度条件下,随着N的提高,kL呈抛物线上升趋势。主要原因除了上述因素外还存在由于靠水相界面一侧产生强烈的湍动使液膜厚度降低,从而降低了液膜阻力,即对流作用改变了界面胶团的状态使“紧密”界面变成“流动”界面导致传质性质发生了改变,故表现为“双斜率特性”[15]。
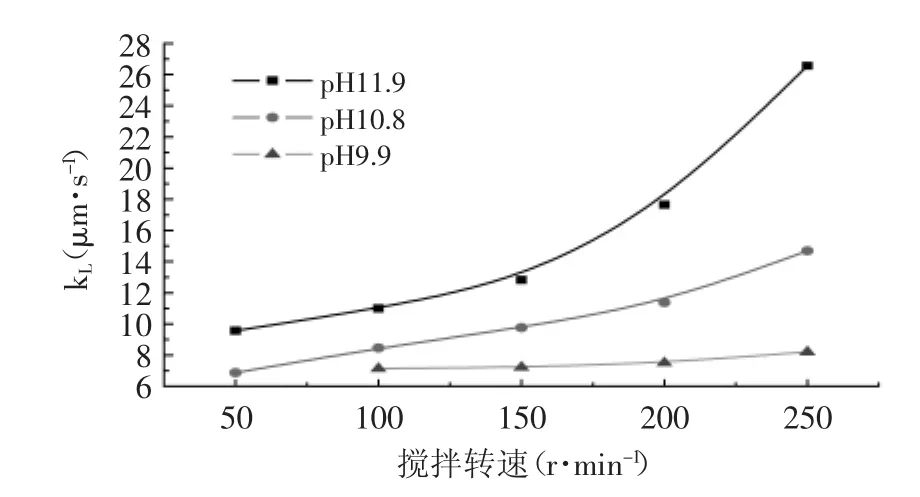
图3 不同pH条件下,搅拌转速对传递系数kL的影响Fig.3 Effectof rotate speed on transfer coefficient kL at different pH

图4 不同NaCl浓度条件下,搅拌转速对传递系数kL的影响Fig.4 Effectof NaCl concentration on transfer coefficient kL at different rotate speed
2.3.2 水相pH对kL的影响 从图3可知,随着pH的升高,kL对N就越敏感,表明pH对界面的组成和阻力有着显著的影响。当pH9.9时,N对kL乎没有影响,由此可见在该条件下主要为界面化学控制;当pH在10.8条件下,随着N的提高kL呈直线上升,表明在此条件下萃取过程呈现以界面控制为主的混合控制;当pH 11.9条件下,随着N的提高kL呈抛物线上升,表明在此条件下萃取过程呈现以扩散控制为主的混合控制。pH对扩散系数kL影响的一个主要原因是pH越高于α-淀粉酶等电点p I,其带负电荷越多,α-淀粉酶与带正电荷的反胶束静电作用就越强,所以α-淀粉酶在液膜中分子扩散系数DL相对就低,而kL与DL呈正相关,故pH相对越小传递系数kL就越小。
2.3.3 不同离子强度条件下N对kL的影响 NaCl在该体系中起到增溶作用,当NaCl浓度低于0.03mol·L-1时,两相界面出现乳化现象使界面浑浊难以操作。从图4可知,N=250r·min-1时,随着离子强度的升高kL反而降低。主要是由于随着离子强度提高,反胶束内表面双电层变薄,导致α-淀粉酶与反胶束表面的静电引力减弱和亲和力降低。从图4中还可以看出,当离子浓度大于0.05mol·L-1时,随着N的提高kL增加的幅度不大,说明此时离子强度对静电引力作用影响很大,导致反胶团萃取过程处于界面化学控制为主;离子浓度为0.03mol·L-1时,随着N的提高kL大幅度提高,萃取过程由界面化学控制转换为扩散控制为主。
2.4 表面活性剂CTAB对kL的影响
通过调节CTAB的浓度,检测、计算不同浓度条件下的kL值并作图5。由图5可知,随着CTAB浓度的增加kL随之增加。主要由于CTAB量的增大提高了反胶束的浓度,引起相界反胶束面积增大,从而强化了传质速率,界面控制逐步减弱。但当CTAB浓度高于0.03mol·L-1时,随着浓度增加kL值提高缓慢,当增加到0.05mol·L-1时萃取系统变浑浊。
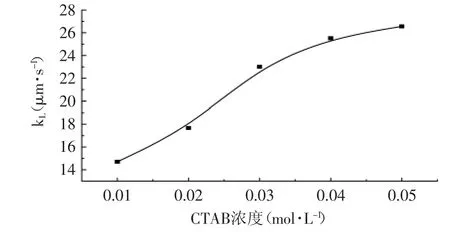
图5 表面活性剂CTAB对表观传递系数的影响Fig.5 Effectof CTAB concentration on transfer coefficient kL
2.5 助表面活性剂对kL的影响
CTAB是单链阳离子表面活性剂,其非极性尾部较少,故体系中必须加入助表面活性剂即助溶剂,才能形成稳定的反胶束溶液[4]。本文通过加入正丁醇促使CTAB在萃取体系中形成稳定的反胶束。通过改变正丁醇与异辛烷的比例,考察其对kL的影响,结果见图6。从图6可知,随着正丁醇比例提高kL升高,但是当比例超过0.25时,随着正丁醇比例的提高,kL急剧下降。这主要是因为在较低正丁醇浓度时,随其浓度的升高,界面中反胶束的数量与稳定性增大,α-淀粉酶的萃取率也相应提高;而当正丁醇浓度过高时,导致反胶束体积变小,形成“空间位阻”效应,α-淀粉酶不易进入,因此助溶剂正丁醇与有机相异辛烷应有一个合适的比例。

图6 助表面活性剂Butanol对表观传递系数的影响Fig.6 Effectof Butanol ratio on transfer coefficient kL
2.6 比界面积S对kL和萃取速率R的影响
不同pH条件下,考察不同比界面积Sn对萃取速率Rn的影响。Sn代表不同比界面积;Rn代表反应速率;S0代表比界面积为0.062cm-1;R0代表比界面积为0.062mm-1时的萃取速率。以不同pH条件下的相对比界面积为横坐标,相对萃取速率为纵坐标作图,见图7。
由图7结合2.3.2结果可知,当界面控制对表观传递系数kL影响越严重,相对萃取速率对相对界面积的斜率就越大,故可以通过斜率的大小对萃取过程的限制步骤进行评估。由此可知,当pH为9.9、10.8、 11.9,α-淀粉酶萃取过程分别以界面控制、混合控制、扩算控制为主。

图7 比界面积对萃取速率的影响Fig.7 Effectofspecific interfacialareaon extraction rate
3 结论
3.1 根据“双膜理论”利用恒界面池,建立了反胶团萃取动力学方程。利用该模型探讨了α-淀粉酶反胶束萃取过程的影响因素,为利用动力学模型分析反胶团萃取α-淀粉酶优化与控制提供了依据。
3.2 在以CTAB单链阳离子为表面活性剂的反胶束萃取中,α-淀粉酶萃取的表观传质系数kL受到pH、离子强度、搅拌转速、表面活性剂、助表面活性剂因素的影响,且能够改变反胶束萃取α-淀粉酶过程控制类型。
3.3 通过调节比界面的大小,根据萃取速率对比界面积的相对斜率大小可以用来判定α-淀粉酶反胶束萃取过程控制的类型。
[1]Maurus Robert,Begum Anjuman,Kuo Hsin-Hen,et al. Structural andmechanistic studies of chloride induced activation ofhuman pancreaticα-amylase[J].Protein Science,2005,14(3):743-755.
[2]张树政.酶制剂工业[M].北京:科学出版社,1984:473.
[3]史红勤,雷夏,沈忠耀.AOT-磷脂反胶团体系萃取蛋白质的研究[J].化工学报,1990,41(6):702-708.
[4]Gaikaiwari Raghavendra P,Wagh Shipa A,Kulkarni Bhaskar D.Efficient lipase purification using reverse micellar extraction [J].Biore-source Technology,2012,108:224-230.
[5]Liu Jun-Guo,Xing Jian-Min,Rui Shena,et al.Reverse micelles extraction of nattokinase from fermentation broth[J]. Biochemical Engineering Journal,2004,21(3):273-278.
[6]Tonova Konstantza,Lazarova Zdravka.Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion[J].Biotechnology Advances,2008,26(6):516-532.
[7]Chang Qing-Long,Chen Jia-Yong,Zhang Xiu-Fang,et al. Effect of the cosolvent type on the extraction ofα-amylase with reversed micelles:Circular dichroism study[J].Enzyme and Microbial Technology,1997,20(2):87-92.
[8]Chang QingLong,Chen Jia Yong.Liquid-liquid reversed micellar extraction for isolating enzymes:Studies on the purification ofα-amylase[J].Process Biochemistry,1996,31(4):371-375.
[9]Tonova Konstantza,Lazarova Zdravka.Influence of enzyme aqueous source on RME-based purification ofα-amylase[J]. Separation and Purification Technology,2005,47(1-2):43-51.
[10]吴雅睿,刘建,李宇亮,等.CTAB/正丁醇/异辛烷反胶团法纯化α-淀粉酶[J].应用化工,2007,36(8):737-740.
[11]孙彦,史清洪,赵黎明.反胶团萃取蛋白质的平衡模型:静电和疏水性作用的贡献[J].化工学报,2003,54(6):796-800.
[12]余静,刘代俊.反胶团萃取磷酸溶液中镁的动力学[J].高校化学工程学报,2009,23(6):939-944.
[13]高亚辉,陈复生,赵俊廷,等.反胶束萃取大豆蛋白反萃取过程的动力学研究[J].农业工程学报,2007,23(7):206-211.
[14]Dekker Matthijs,Van’t Riet Klaas,Bijsterbosch Bert H,et al.Mass transfer rate of protein extraction with reversedmicelles [J].Chem Eng Sci,1990,45(9):2949-2957.
[15]陆强,李宽宏,施亚钧.反胶束液-液萃取牛血清白蛋白的动力学研究I萃取过程 [J].华东理工大学学报,1996,20(6):723-729.
Study on extraction kinetics ofα-am ylase using reversed m icelles
ZHANG Jian-guo,CHEN Xiao-m ing,XIONG Shuang-li,QIAN Hui-fang
(School of Life Science and Engineering,Southwest University of Science and Technology,Mianyang 621010,China)
Based on two-film theory the kinetic model aboutα-am ylase extraction by CTAB-n-butanolisooctane solution as the reversed m icellar extraction system was estab lished.Varied conditions inc luding initial enzyme activity,stirring speed,pH and ionic strength in aqueous phase,concentration of surfactant and cosolvent were performed on a stirred transfer cell w ith constant interface to determ ine the overall transfer coefficients(kL).The relationship of control type and interfacial area was also stud ied.The results showed that the slope about the common logarithm of residual enzyme activity to extrac tion time was constant,which suggested that this kinetic model could ag ree w ith extrac tion p rocess and the relationship of kLw ith initial enzyme activity were uncorrelated when its activity was at 1105U·L-1to 4420U·L-1.The p rocess of transfer mechanism was affec ted by the stirring speed,especially by the cond itions such as pH and ionic streng th in aqueous phase,and concentration of surfactant and co-solvent.The relative slope of extraction rate to interfacial area was m inished contrarily w ith the increase of pH.Moreover,the mechanism of extraction types was mainly controlled by resistance of interface,cooperation and d iffusion when pH was 9.9,10.8 and 11.9 respectively which was performed at the appointed cond itions.It also ind icated that the relative slope of extraction rate to interfacialarea could be used to evaluate the deg ree of influence of interface resistance.
α-am ylase;reversed m icellar extraction;kinetic model;overall transfer coefficients(kL)
TS201.2+5
A
1002-0306(2012)22-0105-05
2012-05-21
张建国(1973-),男,硕士研究生,讲师,研究方向:发酵工程。
国家自然科学基金(11075134)。

