PrxⅥ、SOD、CAT在肝脏缺血再灌注损伤大鼠模型脑内的表达
董 辉 王素玲 李易明 王 磊 (华北石油总医院急诊科,河北 任丘 0655)
肝脏缺血再灌注损伤(HIRI)不仅是导致肝衰竭、病人愈后较差的重要原因〔1,2〕,还可使远端器官如心脏处于高度氧化应激状态,遭受过氧化损伤〔3〕。氧化应激损伤是由活性氧族(ROS)造成的。ROS化学性质非常活泼,可以破坏细胞内的重要结构蛋白和功能蛋白,甚至引起细胞和组织死亡〔4〕。过氧化物酶Ⅵ(PrxⅥ)有谷胱甘肽过氧化物酶的生物活性,主要负责还原H2O2和磷脂过氧化物等〔5~7〕。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)也是机体内清除ROS的重要酶系〔8~11〕。脑组织和心肌都是对氧含量高度敏感的器官,当肝脏发生缺血再灌注损伤后,脑组织是否也会受到氧化应激损伤?PrxⅥ、SOD和CAT等抗氧化酶的表达水平如何改变未见报道。本研究拟探讨肝脏缺血再灌注损伤后脑内的氧化应激状态以及PrxⅥ、SOD和CAT的抗氧化作用。
1 材料和方法
1.1 动物 选用健康雄性Wistar大鼠,体重(200±10)g,由河北医科大学实验动物中心提供。
1.2 主要试剂 琼脂糖、溴乙啶、RT试剂盒、Taq DNA聚合酶、TRIzol均为Invitrogen公司产品;SOD、丙二醛(MDA)测定试剂盒均为南京建成生物公司产品;兔抗PrxⅥ抗体为Abcam公司产品;抗兔IgG抗体为Zymed公司产品;发光试剂为晶美生物工程有限公司产品。
1.3 主要仪器 HITACHI-7170全自动生化分析仪(日本);HITACHI UV-330紫外-可见分光光度计(日本);MJ Research PTC-200型 PCR 热循环仪(美国);Leica-2145石蜡切片机(德国)。
1.4 动物模型的建立和取材 将大鼠随机分为对照组(Con)和缺血再灌注损伤组(HIRI),用6%水合氯醛腹腔注射麻醉大鼠(0.5 ml/kg),参照 Kohli等〔12〕的方法,分离肝血管和胆管蒂,以无创伤性血管夹夹闭通往肝左叶、肝中叶的血管和胆管蒂;30 min后去掉血管夹,恢复肝脏血液供应,制造70%肝实质的肝脏缺血再灌注损伤模型。对照组大鼠只分离血管和胆管蒂并不夹闭。6 h后收集血液,用于丙氨酸氨基转移酶(ALT)测定;处死大鼠取肝脏和脑,一部分4%多聚甲醛固定进行HE染色,观察肝组织和脑组织的形态学改变,一部分脑组织置于液氮中用于PrxⅥ、SOD和CAT mRNA、蛋白水平、抗氧化活性和MDA含量测定。
1.5 观察指标
1.5.1 肝脏和脑组织的HE染色和形态学观察 组织块常规脱水、透明,石蜡包埋后,切片厚5 μm,苏木精伊红染色,于光学显微镜下观察肝脏和脑组织的形态变化并进行图像分析。
1.5.2 血清ALT测定 未抗凝血经3 000 r/min离心10 min,分离血清,ALT水平由全自动生化分析仪测定。
1.5.3 脑匀浆的制备和MDA含量测定 从-70℃冰箱中取出脑组织,按照 10 mg/100 μl加入预冷的匀浆缓冲液(50 mmol/L磷酸钾缓冲液,pH7.4,1 mmol/L盐酸苯甲脒,1 mmol/L PMSF,0.1%Tween-20,0.5 mol/L NaCl,1 mmol/L EDTANa3,5 mmol/L β-巯 基 乙 醇),冰 浴 中 匀 浆,匀 浆 液4 000 r/min 4℃离心20 min,取上清制成10%脑组织匀浆,其MDA含量经MDA测定试剂盒测定。
1.5.4 脑组织内PrxⅥ,CAT、SOD mRNA水平测定 用TRIzol法提取脑内总 RNA。约3 μg总 RNA反转录成 cDNA。以GAPDH为内对照,进行 RT-PCR。分别以 PrxⅥ、SOD、CAT的扩增产物与GAPDH灰度值之比表示目的基因的相对表达量。引物序列见表1。
1.5.5 脑组织内CAT和SOD的活性测定 CAT、SOD的活性采用相应试剂盒测定。CAT和SOD的活性均以每毫克样本蛋白所含的酶活性单位数(U/mg pro)表示,蛋白定量采用改良的Lowry法。
1.5.6 脑组织内PrxⅥ蛋白水平测定 采用Western印迹法测定大鼠脑内PrxⅥ蛋白水平。将大鼠脑组织制成匀浆,离心后取上清。用改良Lowry法进行蛋白总量测定。电泳的蛋白上样量为68 μg。经过转膜和封闭处理后,在 PVDF膜上加入兔抗PrxⅥ抗体,室温静置过夜。再加入辣根过氧化物酶标记抗兔IgG抗体。按发光试剂操作说明进行显影,定影,晾干。用凝胶成像系统扫描胶片并分析图像,以条带的积分光密度值表示其蛋白含量。
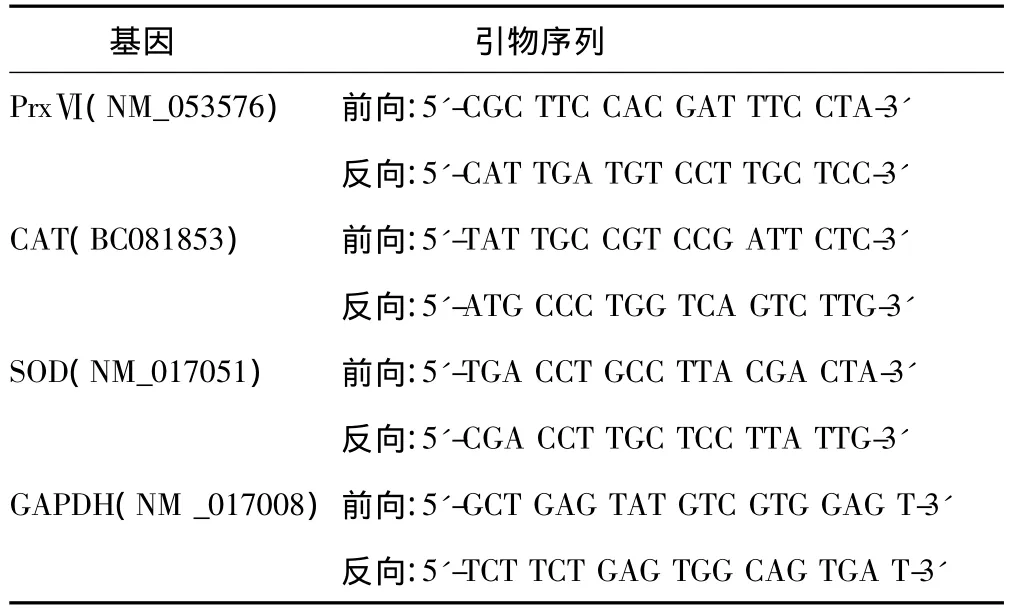
表1 RT-PCR引物序列
2 结果
2.1 大鼠肝组织和脑组织的形态学改变 光学显微镜下可见对照组大鼠肝细胞排列成条索状,围绕中央静脉呈放射状排列,肝索间肝血窦大小均匀,无明显扩张充血。而HIRI组大鼠的肝组织淤血严重,肝血窦明显扩张充血,肝细胞受压萎缩,肝细胞质染色变浅且有空泡出现,部分肝细胞水肿明显,体积增大,染色变浅。脑组织在光学显微镜下两组间未见明显形态结构变化。见图1。

图1 两组肝脏HE染色结果(×400)
2.2 血清ALT水平 Con组大鼠血清中ALT为(20.1±3.42)U/L,明显低于 HIRI组〔(86.66±9.08)U/L〕(P <0.01)。
2.3 脑匀浆内MDA的含量 Con组大鼠脑内MDA的含量为(7.07 ±1.21)mmol/g pro,明显低于 HIRI组 〔(12.37±2.11)mmol/g pro〕。(P <0.01)。
2.4 脑内PrxⅥ,SOD,CAT mRNA水平 对照组大鼠脑组织内 PrxⅥ、SOD、CAT mRNA表达量分别为 0.568±0.056,0.628±0.068,0.775±0.074;明显低于 HIRI组(0.965±0.077,1.23±0.284,1.101±0.108)(P <0.01)。见图2。
2.5 大鼠脑组织内SOD和CAT活性 Con组大鼠脑组织内SOD和 CAT活性分别为(228.07±22.4)、(28.5±1.61)U/mg pro,明显低于 HIRI组〔(323.22±21.4)、(49.16±5.13)U/mg pro〕(P <0.01)。
2.6 大鼠脑组织内PrxⅥ的蛋白水平 HIRI组大鼠脑组织内PrxⅥ的蛋白表达水平(1.37±0.16)明显高于对照组(0.79±0.12)(P<0.01)。见图3。

图2 两组PrxⅥ、SOD、CAT mRNA表达变化

图3 两组PrxⅥ的蛋白表达水平
3 讨论
肝脏的HIRI不仅会导致肝脏自身的功能严重受损,还可影响到远端器官的各种功能,如使心肌细胞处于高度氧化应激状态〔3〕。脑组织和心肌细胞一样都对氧含量极为敏感。本实验结果显示HIRI组大鼠血清内ALT的水平是对照组的4倍多。肝组织形态学的改变和血清ALT水平的显著升高均证实HIRI模型成功。但与对照组相比,HIRI组大鼠的脑组织形态结构却未见异常。
MDA是脂类过氧化最重要的终末代谢产物之一,其含量反映了机体脂质过氧化的速度和强度,常被作为反映组织过氧化损伤程度的客观指标,并可间接反映细胞的损伤程度〔13〕。实验结果显示HIRI组大鼠脑内的MDA含量明显高于对照组。说明虽然此时脑组织形态学尚未发生改变,但灌注损伤组大鼠脑内的ROS已经增多,并导致脂类过氧化产物的大量堆积,提示脑组织可能已遭受氧化应激损伤。
PrxⅥ、SOD和CAT是清除ROS的主要酶系。肝脏缺血再灌注损伤组大鼠脑组织内PrxⅥ的mRNA水平和蛋白水平均明显升高。SOD和CAT的抗氧化活性和mRNA水平也均明显高于对照组。表明肝脏HIRI发生后可能通过某条途径导致脑组织内ROS增多。过多的ROS袭击脑组织,导致MDA等脂类过氧化产物的大量堆积。此时,脑组织通过上调PrxⅥ、SOD和CAT的表达量和抗氧化活性清除过多的ROS,避免脑组织进一步遭受氧化应激损伤。
总之,HIRI可导致脑组织处于高度氧化应激状态,遭受过氧化损伤。通过上调PrxⅥ、SOD和CAT等抗氧化酶系表达水平来清除ROS,可能成为防治或减轻由HIRI诱发的大脑损伤的一条新途径。
1 Sharma P,Sharma BC.Lactulose for minimal hepatic encephalopathy in patients with extrahepatic portal vein obstruction〔J〕.Saudi J Gastroenterol,2012;18(3):168-72.
2 Lin CM,Lee JF,Chiang LL,et al.The protective effect of curcumin on ischemia-reperfusion-induced liver injury〔J〕.Transplant Proc,2012;44:974-7.
3 曹建明,张佳雷,牛爱清,等.大鼠急性肝缺血-再灌注时心肌细胞氧化损伤及瑞芬太尼的干预作用〔J〕.临床麻醉学杂志,2011;27:66-8.
4 Rabilloud T,Heller M,Gasnier F,et al.Proteomics analysis of cellular response to oxidative stress〔J〕.J Biol Chem,2002;277:19396-401.
5 Ambruso DR,Ellison MA,Thurman GW,et al.Peroxiredoxin 6 translocates to the plasma membrane during neutrophil activation and is required for optimal NADPH oxidase activity〔J〕.Biochim Biophys Acta,2012;1823(2):306-15.
6 Chen JW,Dodia C,Feinstein SI,et al.1-Cys Peroxiredoxin,a bifunctional enzyme with glutathione peroxidase and phospholipase A2 activities〔J〕.J Biol Chem,2000;275:28421-7.
7 Wang XS,Phelan SA,Forsman-Semb K,et al.Mice with targeted mutation of peroxiredoxin 6 develop normally but are susceptible to oxidative stress〔J〕.J Biol Chem,2003;278:25179-90.
8 Afonso V,Champy R,Mitrovic D,et al.Reactive oxygen species and superoxide dismutases:role in joint diseases〔J〕.Joint Bone Spine,2007;74:324-9.
9 Dhar SK,St Clair DK.Manganese superoxide dismutase regulation and cancer〔J〕.Free Radic Biol Med,2012;52:2209-22.
10 Nelson SK,Bose SK,Grunwald GK,et al.The induction of human superoxide dismutase and catalase in vivo:a fundamentally new approach to antioxidant therapy〔J〕.Free Radic Biol Med,2006;40:341-7.
11 Klingelhoeffer C,Kämmerer U,Koospal M,et al.Natural resistance to ascorbic acid induced oxidative stress is mainly mediated by catalase activity in human cancer cells and catalase-silencing sensitizes to oxidative stress〔J〕.BMC Complement Altern Med,2012;12:61-83.
12 Kohli V,Selzner M,Madden JF,et al.Endothelial cell and hepatocyte deaths occur by apoptosis after ischemia-reperfusion injury in the rat liver〔J〕.Transplantation,1999;67:1099-105.
13 Kwiecien S,Konturek PC,Sliwowski Z,et al.Interaction between selective cyclooxygenase inhibitors and capsaicin-sensitive afferent sensory nerves in pathogenesis of stress-induced gastric lesions.Role of oxidative stress〔J〕.Physiol Pharmacol,2012;63(2):143-51.

