共轭效应对有机化合物性质的影响
白宝平
(太原大学外语师范学院,山西 太原 0 3 0 0 1 2)
有机化合物的反应归根到底无非是旧键的断裂和新键的生成问题,这是直接和间接与共价键的极性(即共价键上电子云的分布状态)有关的,而共价键的极性不仅与成键原子的电负性、共价键的性质有关,而且与相邻键的性质、不直接相连的原子之间的相互影响也有关系。这种通过键的极性传递所表现的分子中原子之间的相互影响是共用电子对沿共价键移动的结果,一般称之为电子效应。可归纳为诱导效应和共轭效应。以下仅对共轭效应的影响做出讨论。
在谈共轭效应之前,先来看两个例子。首先在1,3-丁二烯中,C H2=C H─C H=C H2的键长不是简单的单键和双键的键长,存在着平均化的趋势。如:
一般的C─C单键键长0.1 5 4 n m;
C=C双键键长0.1 3 4 n m;
1,3-丁二烯C─C单键键长0.1 4 7 n m;
C=C双键键长0.1 3 7 n m。
而且体系能量降低,化合物趋于稳定。从它的同系物的不同异构体的氢化热也可推断出,单双键交替的体系具有特殊的稳定性。
C H2=C H─C H2─C H=C H2△H=-2 5 4.3 9 K j/m o l
C H3─C H=C H─C H=C H2△H=-2 2 6.3 5 K j/m o l
再拿氯乙烯与氯乙烷比较,从诱导效应考虑氯乙烯的偶极矩,由于π键的电子云流动性较大,偶极矩应该加大,而实际不然,氯乙烯的偶极矩比氯乙烷的反倒减小了。同时,氯乙烯也同样存在单双键平均化的趋势。
C H3C H2C l μ=2.0 5 DC H2=C H C l μ=1.4 4 D
这些现象说明,在单双键交替排列的体系中,或具有未共用电子对的原子与双键直接相连的体系中,电子云围绕整个分子形成了整体的分子轨道。每个成键电子都受到成键原子和分子中其他原子的原子核的作用,因而分子能量降低,体系趋于稳定。这种键称为离域键,包含着这样一些离域键的体系通称为共轭体系。在共轭体系中,原子之间相互影响的电子效应叫“共轭效应”(C o n j u g a t e d E f f e c t s)。一般以C为代表。如前所述,它是只存在于共轭体系的特殊影响,而不像诱导效应那样可存在于一切键上。共轭效应也分为供电共轭效应(即+C效应)和吸电共轭效应(即-C效应)。
+C效应 C H2=C H─C l
-C效应 C H2=C H─C H=O
共轭效应通过共轭π键来传递。当共轭体系一端受电场的影响时,就能沿着共轭π键传递得很远,同时在共轭π键上的原子将依次出现电子云分布的交替现象。共轭体系的类型一般常见的有下面几种:

其中σ-π与σ-p共轭效应较π-π、p-π共轭效应弱得多,一般称之为超共轭效应。
一、对反应方向的影响
在很多有机反应中,先要生成中间态,进而再生成产物,所以中间态的稳定性就决定了产物的种类和产率,也就是决定了反应的方向。中间态多是一些正离子、负离子和自由基,影响它们稳定性的因素有很多,其中很重要的一条就是共轭效应。在中间体的共轭体系中,由于电子的离域,正电荷和负电荷能够得到很好的分散,使正、负离子得到稳定;而自由基中,由于共轭作用,可以分散独电子性,使其稳定。例如,1,3-丁二烯与氯化氢加成反应的反应历程:

在反应中,H+先加到1,3-丁二烯上,但加完的结果却有了不同。可以看出,①步生成的是类似于烯丙基正离子的共轭体系有两种共振式,而②步中的正离子却只有微弱的σ-p共轭效应,电子离域程度不如①大,正电荷的分散不如①充分,所以②的中间体非常不易形成,反应的方向以①为主。至于①中的两种产物哪个是主要产物,需要讨论化学动力学,在此不做分析。
再如,1,1-二甲基丙二烯与C l2的光照取代反应:
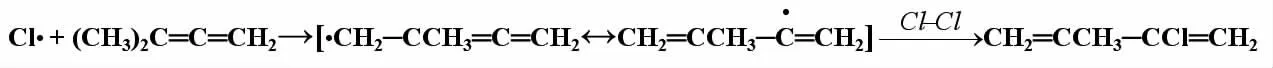
在中间态的两个共振体中,后者属共轭结构,较稳定,所以主要产物为2-甲基-3-氯-1,3-丁二烯。
二、对有机化合物活性的影响
前面已提到,共轭效应可分为供电共轭效应和吸电共轭效应。由于二者不同的作用,使化合物的结构发生了变化,从而使化合物发生某些反应的难易程度也有了变化。这一点在亲电、亲核的加成、取代反应中表现的尤为显著。例如,苯的亲电取代反应。在苯分子中,由于共轭体系可看作无限延伸,所以电子云分布已完全平均化,电子云密度较大。但当苯被某些基团一取代后,苯环和基团由于电子效应(包括诱导效应和共轭效应)会使苯环上的电子云密度发生改变。供电基团使苯环活性增大,反应速度加快;吸电基团则使苯环活性降低,反应速度减慢。下面给出了一些一取代苯硝化反应的相对速度:

通过上表可看出,共轭效应的影响是相当显著的。再如 ,C6H5C H=C H2、p-C H3C6H4C H=C H2、p-O2N C6H4C H=C H2与H B r的加成的反应速率比较。它们的中间体碳正离子分别 是 :C6H5C H+C H3、p-C H3C6H4C H+C H3、-O2N C6H4C H+C H3,后两者相当于在前者的苯环上加了一个取代基,但中间的甲基有σ-π的供电共轭效应,可使碳正离子的稳定性加强,而后者的π-π共轭效应却是吸电的,使碳正离子更加不稳定。稳定性越强,转化速度就越快,所以反应速度为:
p-C H3C6H4C H=C H2>C6H5C H=C H2>p-O2N C6H4C H=C H2。
三、对有机化合物酸碱性的影响
有机化合物酸性的大小取决于脱H+的难易,越易脱去H+,酸性就越强。而脱H+就必须降低C─H或O─H键上的电子云密度。有机物中若含有羧基,肯定能显酸性,但羧基以外的结构却会对酸性的大小产生影响。例如,实验证明C6H5C O O H、m-C H3O C6H4C O O H和p-C H3O C6H4C O O H的p K a值分别为4.2 0、4.0 9和4.4 7。这是因为在苯环上的甲氧基因氧的电负性大,表现为-I的诱导效应,而氧原子上的未共用电子对可以与苯环形成p-π共轭,表现为+C效应。对于间甲氧基苯甲酸,由于只受甲氧基的-I诱导效应,酸性增强。而对甲氧基苯甲酸则受到甲氧基的-I诱导效应和+C共轭效应的综合影响,其中+C效应的影响大于-I效应,所以表现为酸性减弱。再如,H C O O H和C6H5C O O H的p K a分别是3.7 7和4.2 0,可以看到苯环取代甲酸中的氢后酸性降低,因为苯环可以和羧基中的C=O双键共轭,产生+C效应,使O─H键上的电子云密度增大,H+不易脱去,酸性增强。
若有机物容易得到H+,碱性就强,而得H+的条件就是电子云的密度大。例如,苯胺与吡啶的p K b分别为9.3 8和8.8 0。在苯胺中,氨基有-I效应和+C效应,而后者大于前者,起给电子作用,降低了N原子上的电子云密度,碱性较弱;而在吡啶中,N有-I效应和-C效应,二者皆起吸电子作用,增大了N原子上的电子云密度,所以碱性较强。
四、对红外光谱和紫外光谱的影响
红外光谱在有机化合物的结构鉴定与研究工作中是一种重要手段。由于一些特殊键或官能团在红外光谱中有特征频率吸收峰,可以确定一个化合物中它们的存在与否。但是,有时这些特征频率吸收峰却不符合数据中的值,而是发生了偏移,这正是由于电子效应等作用引起的。例如,C H3C H2C H=C H2分子中,C=C的伸缩振动吸收峰在1 6 4 7 c m-1,C H3C O C H3分子中,C=O伸缩振动吸收峰在1 7 2 0 c m-1,而在C H3C O C H=C H2分子中,C=C吸收在1 6 2 3 c m-1,C=O吸收在1 6 8 5 c m-1,均比单独存在时低。这是因为共轭效应使共轭体系中电子云密度平均化,结果使原来双键处的电子云密度降低,力常数减少,所以振动频率降低。
紫外光谱也是现代有机物鉴定的一种重要手段,是由于分子中价电子的跃迁而产生的。常见的跃迁有σ→σ*、π→π*、n→π*、n→σ*四种。这里仅讨论π→π*跃迁。如果分子中存在两个或两个以上的双键(包括叁键)形成的共轭体系,π电子处于离域的分子轨道上,与定域轨道相比,占有电子的成键轨道的最高能级与未占有电子的反键轨道的最低能级的能差减小,使π→π*跃迁所需的能量减少,因此吸收向长波方向位移。随着共轭体系的逐渐增长,跃迁能阶的能差逐渐减小,吸收越向长波方向位移。下面是一些多烯化合物的吸收带:
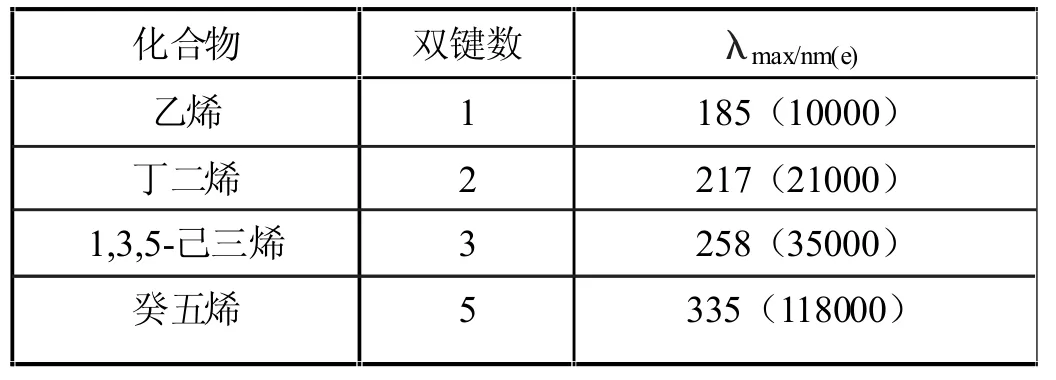
共轭效应对有机化合物的影响远不止以上四点,在此就不一一阐述了。
[1]邢其毅,徐瑞秋,裴坚,裴伟伟等.基础有机化学(第三版)[M].北京:高等教育出版社,2005.
[2]曾昭琼等.有机化学(第四版)[M].北京:高等教育出版社,2004.
[3]汪小兰等.有机化学(第四版)[M].北京:高等教育出版社,2005.
[4]高职高专化学教材编写组.有机化学(第三版)[M].北京:高等教育出版社,2010.
[5]恽魁宏,高鸿宾,任贵忠等.高等有机化学[M].北京:高等教育出版社,1995.
[6]冯骏材,丁景范,吴琳等.有机化学习题精解(第二版)[M].北京:科学出版社,2009.

