小干扰RNA对椎间盘炎症大鼠神经生长因子的影响研究
王 刚
椎间盘源性腰痛(discogenic low back pain,DLBP)为现代骨科医学的研究难点和热点,其病因复杂,发病机制尚未明确,临床上缺乏特异的治疗方法[1]。流行病学调查结果显示,随着人们现代社会生活节奏的加快和工作强度的提升,DLBP发病率呈逐年上升趋势[2-3]。电生理学研究表明,机体在正常生理状态下,神经纤维仅存在于椎间盘纤维环外层,而DLBP患者的纤维环内层乃至髓核内部均可见神经纤维分布,提示神经纤维长入可能为DLBP的重要发病机制[4-5],为其临床治疗方向由宏观行为学向分子生物学转变提供了新的理论支撑。神经生长因子(nerve growth factor,NGF)过表达和炎性因子过分泌是DLBP发病机制中的研究热点[6-7]。本研究以椎间盘炎症大鼠为动物模型,旨在探讨小干扰RNA(siRNA)对NGF的影响,现报道如下。
1 材料与方法
1.1 实验动物 SPF级Sprague-Dawley(SD)大鼠60只,雌雄各半;体质量180~240 g,平均(223.0±12.4)g;月龄2.5~3.5个月,平均(2.9±0.7)个月;购于中山大学医学院动物中心,批号:SYXK(粤)2007-0081。
1.2 主要仪器与试剂 主要仪器:PCR仪(C1000 Thermal cycler,BIO-RAD),荧光定量仪(IQ5,BIO-RAD),制冰机(AF100,Scotsman),低温超速离心机(Scanspeed 1730,Labogene),微型振荡器(QL-901,海门市麒麟医用仪器厂),流式细胞仪(EPICS® ALTRATM,Beckman)等。主要试剂:LipofectamineTM2000(Inbitrogen),Trizol总RNA提取试剂盒(Inbitrogen),NGF酶联免疫吸附试验(ELISA)测定试剂盒(Chemicon),Oligo dT Primer、Random Primer、5×PrimeScriptTMBuffer等PCR试剂均由TAKARA公司提供;其他试剂如乙醇、氯仿等为国产分析纯;IL-6、IL-1β试剂盒购于Peprotechec公司;DMEM/F12培养基和胎牛血清购于Gibco公司。
1.3 方法
1.3.1 细胞体外培养 细胞体外培养方法参照参考文献[8]。(1)手术分离60只大鼠椎间盘髓核及纤维环细胞:取出椎间盘组织后立即用冰磷酸盐缓冲液(PBS)漂洗3次,分离髓核组织并在DMEM/F12培养基中剪碎,离心半径15 cm,4 000 r/min,4 ℃离心5 min后重悬,37 ℃、5%二氧化碳(CO2)培养 8 h;离心半径15 cm,4 000 r/min,4 ℃离心5 min去上清液,PBS漂洗后,依次用0.25%胰蛋白酶、2%Ⅱ型胶原酶消化,离心半径15 cm,4 000 r/min,4 ℃离心5 min去上清液;再用DMEM/F12重悬,细胞计数板计数,确定细胞数可达104/L以上,并调整细胞计数为1×104/L,转移到37 ℃、5%CO2培养箱中培养。(2)细胞培养 7 d后,以无血清培养基培养24 h。将大鼠分为对照组(n=12)和实验组(n=48),对照组在含0.3%胎牛血清的DMEM/F12培养基中继续培养,实验组中分别加入10 nmol/L、20 nmol/L、50 nmol/L、100 nmol/L的IL-6、IL-1β培养48 h,每个亚组12只。
1.3.2 NGF-siRNA的导入和鉴定 选择对数生长期细胞并调整细胞数为2.5×106/ml;根据说明书,将焦碳酸二乙酯(DEPC) H2O和LipofectamineTM2000按比例稀释后与NGF-siRNA混匀,孵育10 min,等比例(2.5×105/孔)加入6孔板中,轻摇混匀;37 ℃、5%CO2培养箱孵育,及时换液。导入NGF-siRNA前后以流式细胞仪测定细胞转化率,计算NGF-siRNA细胞转化率。
1.3.3 NGF mRNA相对表达量的测定 NGF mRNA的实时Q-PCR引物序列:上游引物为5′-ACTTCAGCATTCCCTTGACACA-3′,下游引物为5′-ACGGGCAGCTATTGGTTCAG-3′,Probe为5′-FAM-CCCTCCGCAGAGCCCGCA-TAMRA-3′;以GAPDH为内参基因,引物序列:上游引物为5′-AGGGCTGCCTTCTCTTGTGA-3′,下游引物为5′-AACTTGCCGTGGGTAGAGTCA-3′,Probe为5′-FAM-CCATCAACGACCCCTTCATTGACCTC-TAMRA-3′。逆转录和PCR扩增均由PCR仪自动完成,采用常规体系进行配比,反应条件:逆转录:7 ℃ 15 min,85 ℃ 5 s;扩增:93 ℃ 2 min;93 ℃ 15 s,55 ℃ 25 s,72 ℃ 25 s,共40个循环;72 ℃ 10 min。
Ct值(拷贝数/μl cDNA)为荧光信号达到设定域值所经历的循环数,每个模板的Ct值与该模板起始拷贝数的对数存在线性关系,即起始拷贝数越多,Ct值越小。考虑到各样本总RNA浓度的差异,NGF mRNA相对表达量=Ct目的基因/Ct内参基因。
1.3.4 NGF细胞液浓度的测定 收集细胞培养液100 μl,严格按照ELISA试剂盒说明书操作测定细胞液NGF浓度。
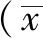
2 结果
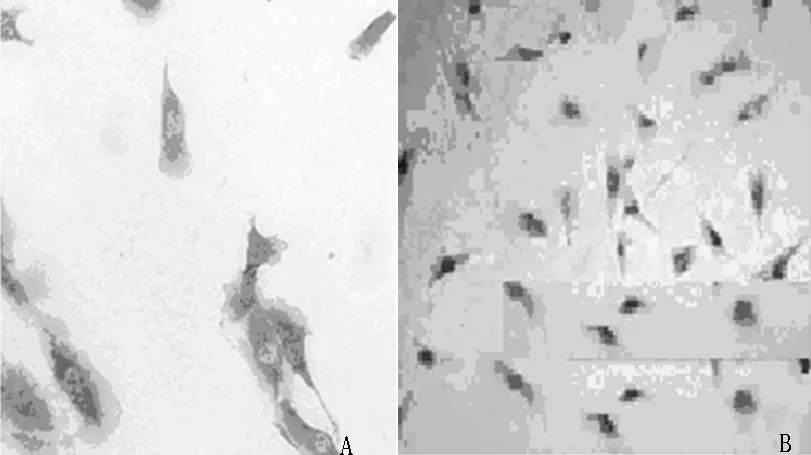
2.1 细胞鉴定 (1)甲苯胺蓝染色结果显示,髓核细胞染色呈强阳性(见图1A);纤维环细胞染色胞核为紫色,胞质为深蓝色,细胞多呈梭形,胞质内可见较多空泡(见图1B)。(2)番红O染色结果显示,髓核细胞染色呈阳性,胞质为粉红色,核周可见棕红色颗粒状物质(见图2A);纤维环细胞着色较浅(见图2B)。细胞体外培养成功,顺利取得椎间盘髓核细胞及纤维环细胞。
注:A为髓核细胞,B为纤维环细胞
图1 大鼠椎间盘髓核细胞及纤维环细胞染色结果(甲苯胺蓝染色,×200)
Figure1 Dyeing appraisal results of intervertebral disc nucleus pulposus cells and annulus fibrosus cells of rats
注:A为髓核细胞,B为纤维环细胞
图2 大鼠椎间盘髓核细胞及纤维环细胞染色结果(番红O染色,×200)
Figure2 Dyeing appraisal results of intervertebral disc nucleus pulposus cells and annulus fibrosus cells of rats
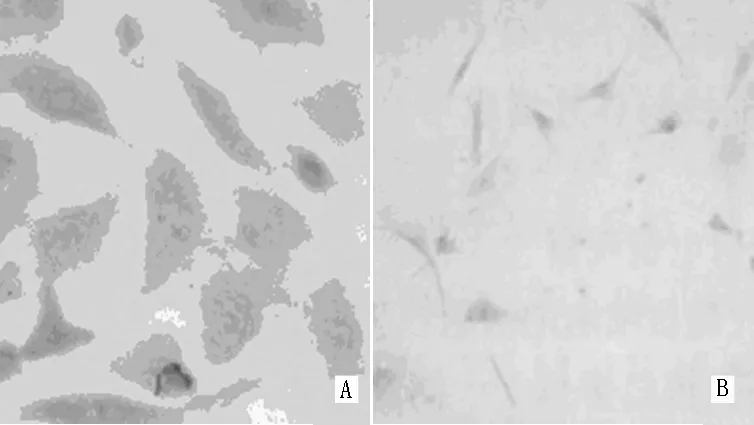
2.2 细胞转化率 流式细胞仪检测结果显示,NGF-siRNA细胞转化率为99.8%(见图3)。
2.3 NGF mRNA相对表达量 GAPDH和NFG mRNA标准扩增曲线平行性良好,曲面光滑,扩增条件准确、特异度高(见图4A、4B);GAPDH和NFG mRNA标准直线回归图显示两者回归性良好,回归系数R2均>0.99,具有较高重现性(见图4C、4D)。导入NGF-siRNA前,10 nmol/L、20 nmol/L、50 nmol/L、100 nmol/L组NGF mRNA相对表达量均较对照组上调,分别上调3.4、3.7、4.7、8.0倍(P<0.05);导入NGF-siRNA后,各组NGF mRNA相对表达量均较导入前下调,分别下调39.5%、45.5%、45.3%、39.9%、47.8%(P<0.05,见图4E、4F,表1)。
2.4 细胞液NGF浓度 导入NGF-siRNA前,10 nmol/L、20 nmol/L、50 nmol/L、100 nmol/L组细胞液NGF浓度均较对照组升高,分别升高2.9、3.3、4.5、7.4倍(P<0.05);导入NGF-siRNA后,各组细胞液NGF浓度均较导入前降低,分别降低47.2%、33.8%、35.4%、43.0%、54.9%(P<0.05,见表2)。
注:A为导入NGF-siRNA前,B为导入NGF-siRNA后
图3 导入NGF-siRNA前后流式细胞仪检测结果
Figure3 Flow cytometry results of cultured cells before and after NGF-siRNA interference
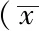
Table1 Comparison of NGF mRNA expression before and after NGF-siRNA interference

时间对照组10nmol/L组20nmol/L组50nmol/L组100nmol/L组F值P值导入前0114±00210388±0032∗0422±0037∗0536±0041∗0912±0064∗77140000导入后0069±00140224±0017∗0231±0024∗0322±0031∗0476±0039∗41210007差值0045±00130164±0016 0191±0021 0214±0027 0436±0041 t值26442214238423192654P值00120023001700180011
注:与对照组比较,*P<0.05
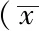
Table2 Comparison of NGF levels before and after NGF-siRNA interference

时间对照组10nmol/L组20nmol/L组50nmol/L组100nmol/L组F值P值导入前214±236621±113∗706±147∗963±214∗1580±334∗11240000导入后113±203411±213∗456±227∗549±247∗ 713±316∗ 67740000差值101±194210±162 251±164 414±173 867±334 t值24532382231525142653P值00140017001900130011
注:与对照组比较,*P<0.05

注:A和B分别为GAPDH和NFG mRNA标准扩增曲线;C和D分别为GAPDH和NFG mRNA标准直线回归图;E和F分别为GAPDH和NFG mRNA样本扩增曲线
图4 GAPDH和NFG mRNA的Q-PCR结果
Figure4 Q-PCR assay results of GAPDH and NFG mRNA
3 讨论
DLBP又称椎间盘内紊乱,为渐进性退变,病变部位不仅局限于发病椎体自身,且随着病情进展,邻近节段均可出现受累,最终可累及整个椎骨体系[9-10]。从形态病理学而言,DLBP患者多存在椎间盘纤维环和髓核裂隙、破损及骨密度降低,导致患者脊柱生理曲度异常,运动节段机械力学失稳和神经机械性损伤;从神经病理学而言,DLBP患者神经纤维分布密度增加,疼痛感受器阈值较低,存在广泛的痛敏反应;从生物病理学而言,DLBP患者的机械损伤和痛敏反应以炎性反应为媒介,相辅相成,互为因果。
既往研究表明,椎间盘损伤过程中涉及肿瘤坏死因子α(TNF-α)、IL-1β、IL-6等大量炎性递质的介导和参与,且其椎间浓度变化在发病急性期表现最为突出[11-12],提示炎性递质为DLBP病情加重的重要诱因,但其具体机制尚未完全明确。本研究以炎性椎间盘细胞为靶细胞,进行IL-1β及IL-6干预实验;结果显示,10 nmol/L、20 nmol/L、50 nmol/L、100 nmol/L组NGF mRNA相对表达量均较对照组上调,细胞液NGF浓度均较对照组升高,且NGF mRNA相对表达量上调幅度及细胞液NGF浓度升高幅度与IL-1β及IL-6呈剂量依赖性,即随着IL-1β及IL-6浓度增加,NGF mRNA相对表达量上调幅度及细胞液NGF浓度升高幅度增大,提示炎性因子IL-1β及IL-6的分泌为诱导大鼠椎间盘NGF表达的重要诱因。
NGF为自体神经元营养供给的基础成分之一,可参与神经元的生长、发育、修复、再生等多项基本生理功能,在大鼠胚胎椎间盘中分部广泛,用以维持脊髓神经细胞分化和增殖[13];而在健康成鼠中,NGF多见于椎间盘纤维环外缘,髓核浓度甚微。NGF异常高表达可能与受损神经细胞的自我修复过程的启动密切相关,为近年骨与神经外科损伤的研究热点[14]。Fire等[15]研究认为,NGF异常高表达为DLBP神经长入的主要微观病理机制,且DLBP炎性疼痛的信号传导以NGF依赖性神经元为主要媒介,提示NGF不仅诱导了DLBP的神经长入,还参与了其炎性疼痛的致敏效应。推测炎性递质IL-1β及IL-6诱导的NGF异常高表达为椎间盘损伤的重要机制之一。因此,本研究以siRNA干扰技术对IL-1β及IL-6诱导的NGF异常高表达进行抑制,结果显示,导入NGF-siRNA后,各组NGF mRNA相对表达量及细胞液NGF浓度均较导入前下调及降低,提示NGF-siRNA能够抑制炎性因子IL-6及IL-1β对椎间盘细胞NGF的诱导效应,为DLBP的治疗提供了新靶点。
总之,本研究在体外细胞水平证实了炎性因子IL-6及IL-1β诱导DLBP的可能机制,为NGF-siRNA治疗DLBP的可行性提供了重要的实验数据。但本研究以大鼠椎间盘体外培养细胞为载体,也存在一定的局限性:(1)大鼠模型制备采用的是弗氏佐剂,其基本原理为直接刺激结核杆菌致关节炎抗原,即65 kD的热休克蛋白(HSP),进而激发炎性反应,其致炎时限一般为10~20 d,20 d可达高峰,而真正的DLBP发病机制复杂,多数患者属长期、慢性病变,因此,弗氏佐剂制备的椎间盘炎性模型仅能够模拟DLBP的部分炎性反应,在模型制备上,尚需完善和改进;(2)本研究为体外动物实验,虽证实NGF-siRNA干扰治疗DLBP有一定作用,但尚需进行更多的体内试验进一步验证疗效,这也是下一步研究的重点。
1 汤冀强,黄庆森.椎间盘源性腰痛的诊疗进展[J].中国矫形外科杂志,2009,17(17):1307-1310.
2 王辉辉.椎间盘源性腰痛的诊断进展[J].实用医院临床杂志,2012,9(6):205-208.
3 Hurri H,Karppinen J.Discogenic pain[J].Pain,2004,112(3): 225-228.
4 Aoki Y,Takahashi Y,Ohtori S,et al.Distribution and immunocytochemical characterization of dorsal root ganglion neurons innervating the lumbar intervertebral disc in rats:a review[J].Life Sci,2004,74(2):2627-2642.
5 关圆,倪家骧.椎间盘源性腰痛的细胞病理学研究进展[J].中国康复医学杂志,2012,27(7):683-686.
6 Ozawa T,Ohtori S,Inoue G,et al.The degenerated lumbar intervertebral disc is innervated primarily by peptide-containing sensory nerve fibers in humans[J].Spine(Phila Pa 1976),2006,31(21):2418-2422.
7 Kakutani K,Nishida K,Uno K,et al.Prolonged down regulation of specific gene expression in nucleus pulposus cell mediated by RNA interference in vitro[J].J Orthop Res,2006,24(6):1271-1278.
8 王刚,韩敦富,施彦璋,等.IL-1β和IL-6对对椎间盘髓核细胞NGF表达的影响[J].中国病理生理杂志,2010,26(7):1265-1269.
9 Freemont AJ,Peacock TE,Goupille P,et al.Nerve ingrowth into diseased intervertebral disc in chronic back pain[J].Lancet,1997,350(9072):178-181.
10 Coppes MH,Marani E,Thomeer RT,et al.Innervation of "painful" lumbar discs[J].Spine(Phila Pa 1976),1997,22(20): 2342-2349;discussion 2349-2350.
11 王刚,刘尚礼,程志安,等.椎间盘切除术对腰椎间盘突出症腰痛的影响[J].中国矫形外科杂志,2009,17(6):23-26.
12 Roberts S,Eisenstain SM,Menage Y,et al.Mechanoreceptors in intervertebral discs.Morphology,distribution and neuropeptides[J].Spine(Phila Pa 1976),1995,20(24):2645-2651.
13 Abe Y,Akeda K,Masuda K,et al.Proinflammatory cytokines stimulate the expression of nerve growth factor by human intervertebral disc cells[J].Spine(Phila Pa 1976),2007,32(6):635-642.
14 Han D,Ding Y,Liu SL,et al.Double role of Fas ligand in the apoptosis of intervertebral disc cells in vitro[J].Acta Biochim Biophys Sin(Shanghai),2009,41(11): 938-947.
15 Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806-811.

