盐渍萝卜色差值测定及其提取物抑菌活性研究
王雅娟,李 健,2,周常义,2,苏国成,2,3*
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.厦门市食品科技研发检测中心,福建 厦门 361021;3.福建省食品微生物与酶工程重点实验室,福建 厦门 361021)
白萝卜(Raphanus sativusL.)为十字花科属根用蔬菜,具有刺激性辛辣味,可以鲜食,也可以加工成各种干制品、腌制品、盐渍品。在日本,盐渍白萝卜因其香鲜可口、色泽诱人已成为人们餐桌上必备的传统佳肴,约占日本加工蔬菜市场的60%[1-2]。
“老菜脯”是福建省闽南地区的一种传统盐渍食品,因其贮藏时间长又称为“老萝卜干”,由白萝卜加盐经多次反复搓、晒、压工序,除去大部分水分,收于坛内贮藏制得。老萝卜干外观黑亮,香味独特,贮藏时间可达十几年。陈年老萝卜干具有清凉降火、增进食欲、健脾化滞、润肠通便等作用,有“赛人参”、“胃肠药”之说。日本在20世纪70、80年代就开始了对盐渍萝卜的研究,主要集中于盐渍过程中黄色素的形成机制及其中间产物如3-(羟基)甲烯基-2-硫代吡咯烷、2-硫代-3-吡咯烷醛、1-(2-硫羰吡咯烷-3-基)-1,2,3,4-四氢-β-咔啉-3-羧酸和终产物如2-[3-(2-硫代吡咯烷-3-内鎓烯)甲基]-色氨酸(TPMT)的结构及其抗氧化、抗诱变等生理功能方面[3-9]。对于盐渍萝卜的抑菌活性,研究较多的是短期(不足一年)腌制产品中辣味物质降解产物的抗菌活性[7,9],然而关于腌制时间超过一年的盐渍萝卜提取物的抗菌活性却未见报道。本研究以色差值为腌制时间依据,研究了不同腌制年数盐渍萝卜提取物的抗菌活性,为“老菜脯”这种福建闽南传统盐渍食品的开发利用打下基础。
1 材料与方法
1.1 材料与试剂
盐渍萝卜:福建省漳州市漳浦县;新鲜白萝卜:厦门市集美菜市场;枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、酿酒酵母菌(Saccharomyces cerevisiae):集美大学微生物实验室;LB琼脂培养基、LB肉汤培养基、孟加拉红培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、酵母膏胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD):广东环凯微生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO):生工生物工程(上海)有限公司;两性霉素B(纯度>750 mcg/mg):南京汇百侍生物科技有限公司;硫酸链霉素(92%):深圳华药南方制药有限公司;甲醇、乙醇、丙酮、乙酸乙酯、石油醚:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
WSC-S测色色差计:上海精密科学仪器有限公司;WK-1600A型高速药物粉碎机:青州市精诚机械有限公司;RE-52A型旋转蒸发仪:上海亚荣生化仪器厂;HH-4型数显恒温水浴锅:国华电器有限公司;HWY-2112型双层恒温培养摇床:厦门德维科技有限公司;DHG-9146A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司。
1.3 方法
1.3.1 盐渍萝卜颜色值的测定
将新鲜白萝卜及不同腌制时间的盐渍萝卜切片(3~5 mm),取不同部位萝卜6片,用直径3 cm的模具切成圆形备用,仪器开机预热30 min后,用黑阱和白板(L*=91.86,a*=-0.88,b*=1.42)校正后进行测定,以新鲜白萝卜的各颜色值作为对照,记录各个年数盐渍萝卜的L*、a*、b*值(白萝卜的记为L0*、a0*、b0*),6次测量求平均值。色差值(△E*ab)按如下公式计算[10]。

式中:L*表示明度,数值从0到100,表示颜色由黑到白;a*值和b*值表示颜色的彩度,+a*表示红色,-a*表示绿色;+b*表示黄色,-b*表示蓝色,值的大小表示色调的强弱程度[11]。
1.3.2 盐渍萝卜抑菌活性的测定
(1)有机溶剂选取
将新鲜白萝卜以及不同腌制年数盐渍萝卜切碎,于50 ℃条件下烘干,粉碎,过20目筛,得萝卜粉末。称取10年盐渍萝卜以及白萝卜粉各5份,每份5 g,置于300 mL三角瓶中,分别加入100 mL水、甲醇、乙醇、丙酮、乙酸乙酯、石油醚,封口后置于40 ℃恒温水浴锅中,浸提过夜,抽滤,除去残渣,收集滤液,旋转蒸发除去溶剂。将得到的浸膏用少量相应溶剂溶解后转移至5 mL具塞刻度试管中,加溶剂至2.5 mL,配成等浓度溶液备用(相当于萝卜干粉2 g/mL)。以大肠杆菌、枯草芽孢杆菌、酿酒酵母作为指示菌,采用滤纸片法和牛津杯法进行抑菌试验,以1 mg/mL硫酸链霉素(溶于生理盐水)和0.5 mg/mL两性霉素B(溶于DMSO)作为阳性对照,并做各溶剂的空白对照。细菌于37 ℃培养18~24 h(酵母菌于30 ℃条件下培养24~48 h)后观察抑菌圈,并继续培养至7 d,期间间歇观察抑菌圈的大小。选取对3种菌的抑菌圈直径均较大且清晰的粗提物提取溶剂作为后续试验中抗菌活性物质的提取溶剂。
(2)抑菌活性物质提取
称取已烘干粉碎的1年、3年、5年、10年、15年、20年盐渍萝卜粉各2份,每份20 g,将其分为2组,每组均含各年数盐渍萝卜1份。按料液比1∶10向其中一组中加入丙酮,另一组加入乙酸乙酯,40 ℃恒温水浴浸提过夜,抽滤,收集滤液,残渣按料液比1∶5加入丙酮或乙酸乙酯浸提12 h,合并滤液,40 ℃真空减压浓缩。浓缩液用相应提取溶剂定容至10 mL(相当于萝卜干粉2 g/mL),转移至具塞刻度试管中,
4 ℃贮存备用。
(3)体外抑菌试验
(a)菌悬液的制备:用接种环分别挑取1环大肠杆菌、枯草芽孢杆菌、酿酒酵母菌(3种菌分别代表了3大类微生物即革兰氏阴性菌、革兰氏阳性菌、真菌,它们也是食品中较常见的腐败菌)斜面培养物接种至LB肉汤培养基(酿酒酵母接种至YPD液体培养基)中,于37 ℃、180 r/min摇床中培养12 h(酵母菌于30 ℃静置培养12 h)。经平板计数后,此条件下得到的培养物其细菌菌落总数约为107~108CFU/mL,酵母菌菌落总数约为105~106CFU/mL。
(b)不同腌制时间盐渍萝卜体外抑菌试验:向已灭菌冷却至45 ℃左右的300 mL LB琼脂培养基(酿酒酵母用PDA培养基)中加入制备好的菌悬液5 mL,振荡混匀,之后再加入200 mL同样培养基,再次振荡使菌液充分分散至培养基中,迅速将培养基倒入已紫外杀菌的平板中,用灭菌涂布棒轻轻将气泡赶至平板边缘。待培养基完全凝固后,放置牛津杯,向牛津杯中分别加入200 μL各年数盐渍萝卜的乙酸乙酯、丙酮提取物,盖好皿盖,于超净台中在风机打开状态下静置2 h,使活性物质扩散并挥发大部分有机溶剂。随后将平板置于37 ℃(酿酒酵母于30 ℃)条件下培养18~24 h(酿酒酵母24~48 h)。以1 mg/mL硫酸链霉素(酿酒酵母用0.5 mg/mL两性霉素B)作为阳性对照,并做乙酸乙酯、丙酮的空白溶剂对照。用游标卡尺测量抑菌圈直径,3次测量取平均值。每种菌每种提取物均做3个平行,抑菌圈直径取3个平行的平均值。
1.4 数据处理
萝卜的各颜色值(L*,a*,b*)以及抑菌圈直径结果表示为平均数±标准偏差。数据统计分析采用SPSS statistics 17.0软件程序进行,采用单因素方差分析和Duncan检验进行统计学检验(置信水平P=0.05)。
2 结果与分析
2.1 不同腌制时间盐渍萝卜颜色值的测定结果
不同腌制时间盐渍萝卜颜色值的测定结果如表1所示。盐渍萝卜总色差值、亮度值、红绿值、黄蓝值随腌制时间的变化分别见图1~图4。
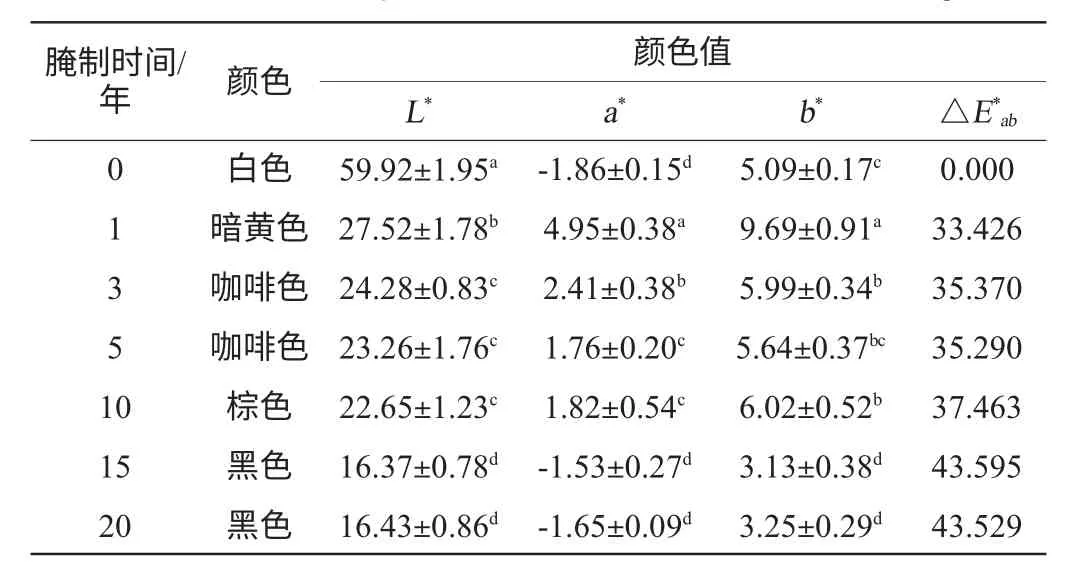
表1 不同腌制时间盐渍萝卜颜色值测定结果Table 1 Color values of preserved radishes with different storage time

图1 盐渍萝卜总色差值Fig.1 △E*abvalue of preserved radish
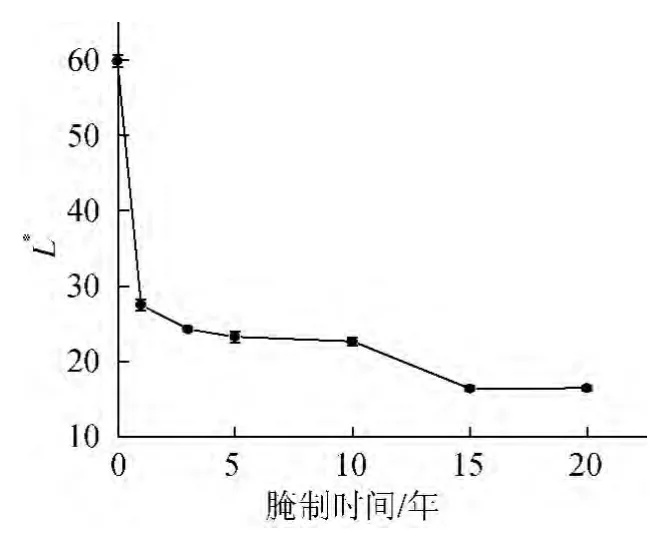
图2 盐渍萝卜亮度值Fig.2 L* value of preserved radish

图3 盐渍萝卜红绿值Fig.3 a* value of salted radish

图4 盐渍萝卜黄蓝值Fig.4 b* value of salted radish
从表1可看出,不同腌制时间盐渍萝卜各颜色值之间存在显著差异,总色差值△E*ab随腌制时间延长整体呈上升趋势,这表明盐渍萝卜的颜色随腌制时间延长逐渐加深。从图1可看出,盐渍萝卜在腌制最初的1年中,色差值变化最大,这是因为在腌制初期,萝卜中的芥子油苷在芥子酶作用下降解生成辣味物质4-甲硫基-3-丁烯基异硫氰酸酯,在有L-色氨酸(L-Trp)、VC、邻苯二酚等的存在条件下发生一系列复杂反应生成黄色物质,使白萝卜发生由浅黄色到暗黄色的明显变化[9,12],而在随后的几个时间段,色差值变化相对较小,这可能是因为黄变发生以后,盐渍萝卜颜色的进一步加深需要一定的底物积累且反应发生缓慢,因此,在较长的时间段(3~5年)内,颜色变化没有最初的1年内明显,盐渍萝卜腌制过程中颜色变化的深层次原因还有待于进一步研究。另外,从图2~图4可看出,白萝卜的明度值(L*值)最大,彩度(a*值和b*值)偏向于黄绿色,随着腌制时间的延长,L*值逐渐减小,a*值和b*值整体上呈现先上升后下降的趋势,因而出现了表1所示的盐渍萝卜由暗黄到黑的颜色变化。
2.2 盐渍萝卜提取物抑菌结果
2.2.1 不同溶剂提取物抑菌结果
经体外抑菌试验,牛津杯法和滤纸片法得到的试验结果如表2所示,从表2可以看出,白萝卜的水、甲醇、乙醇提取物对2种细菌有抑菌效果而对酿酒酵母没有,石油醚提取物对3种菌均无抑菌效果,这与ABDOU I A等[13]的研究结果一致,但BEEVI S S等[14]对白萝卜提取物的抑菌实验结果表明,白萝卜的丙酮提取物对枯草芽孢杆菌有抑菌作用,另外,在HU S H等[15]对十字花科蔬菜提取物的抗菌研究中,白萝卜的水提物与甲醇-水提物不仅对细菌有一定抑菌效果,对假丝酵母也表现较好地抑菌活性,这与本试验结果有所不同,原因可能是本实验中白萝卜的干燥是采用鼓风干燥而非冷冻干燥方式,会造成白萝卜中抑菌活性物质的损失,COOGAN R C等[16]的研究表明,在50 ℃条件下,热风干燥白萝卜片,当其水分含量<10%时,损失的4-甲硫基-3-丁烯基异硫氰酸酯(4-methylthio-3-butenyl isothiocyanate,MTBITC)约是冷冻干燥的5倍。而MTBITC不仅是白萝卜主要的风味物质成分,也是其抑菌活性物质的主要来源[17]。本实验中,对于盐渍萝卜,丙酮提取物、乙酸乙酯提取物在所使用的两种抑菌实验方法中均对3种指示菌具有较好的抑菌作用;甲醇、乙醇提取物在牛津杯法试验中,对2种细菌有一定的抑菌效果,但在滤纸片法试验中没有抑菌效果;而石油醚提取物在两种方法中均无抑菌效果。不同溶剂提取物在抑菌效果上的差异可能是由各溶剂对不同抑菌活性成分的溶解度不同所致[17-21];此外,盐渍萝卜的甲醇、乙醇提取物的抑菌活性在抑菌方法上的差异性可能是因为活性物质在两种溶剂中溶解度较小,滤纸片上活性物质的吸附量不足但本身又存在部分保留而减少了其在琼脂平板表面的扩散[22],因而不能产生清晰可见的抑菌圈。另外,ELOFF J N等[23]对抑菌活性物质提取分离所选用溶剂的研究结果也表明,丙酮和乙酸乙酯无论是在提取率、活性物质的提取种类还是在生物毒性、去除的难易程度上都优于二氯甲烷、乙醇、甲醇等溶剂。因此,本实验选取丙酮和乙酸乙酯作为抑菌活性物质的提取溶剂。

表2 不同溶剂提取物的滤纸片法和牛津杯法抑菌结果Table 2 Antimicrobial activity of different solvent extracts against Bacillus subtilis, Escherichia coli and Saccharomyces cerevisiae by paper filtering and cylinder-plate method

表3 不同腌制年数盐渍萝卜乙酸乙酯、丙酮提取物抑菌结果Table 3 Antimicrobial activity of ethyl acetate and acetone extracts of preserved radishes with different storage time
2.2.2 不同年数盐渍萝卜的丙酮、乙酸乙酯提取物抑菌结果
不同年数盐渍萝卜的丙酮、乙酸乙酯提取物的抑菌结果如表3所示,由表3可知,盐渍萝卜的丙酮和乙酸乙酯提取物对3种指示菌均有较好的抑菌效果,丙酮提取物的抑菌效果整体好于乙酸乙酯提取物,两种提取物对细菌和真菌的抑菌效果存在一定差异性,这种菌种间抑菌效果差异的原因可能是不同微生物细胞类型不同以及其对抑菌活性物质的敏感度差异造成的[24]。除腌制时间为3年的盐渍萝卜提取物之外,其余年数盐渍萝卜的乙酸乙酯提取物对枯草芽孢杆菌的抑菌效果好于大肠杆菌,这是因为相比于革兰氏阳性菌,革兰氏阴性菌外膜的渗透阻碍性限制了抑菌剂与靶目标的接触[25];除腌制时间为1年的盐渍萝卜外,其他年数盐渍萝卜的丙酮提取物对两种细菌的抑菌效果没有显著差异。
另外,腌制时间为1年、3年、5年的盐渍萝卜的乙酸乙酯提取物抑制枯草芽孢杆菌和大肠杆菌效果明显好于腌制时间为10年、15年、20年的,这可能与乙酸乙酯提取物中的某些抑菌活性物质的化学稳定性有关[26-27];与乙酸乙酯提取物有所不同的是,腌制时间为1年、5年、20年盐渍萝卜的丙酮提取物抑菌效果较好,而腌制时间为3年、10年、15年的相对次之,这可能是由不同年数盐渍萝卜中特定抗菌活性物质的种类以及数量的差异造成的,造成这种差异的原因还有待于进一步研究。腌制时间20年的盐渍萝卜丙酮提取物对两种细菌的抑菌圈直径分别可达18.40 mm和18.10 mm,与阳性对照的18.86 mm和18.82 mm接近,具有很好的抗菌潜力。对酿酒酵母的抑菌结果中,腌制时间为3年和10年的两种盐渍萝卜提取物的抑菌效果好于腌制时间为1年和5年的,而腌制时间为15年和20年的两种盐渍萝卜提取物均无明显抑菌效果,且除腌制时间为1年的提取物外,丙酮提取物的抑菌效果均好于12.70 mm的阳性对照,这表明盐渍萝卜的丙酮提取物具有较好的抑真菌能力。
3 结论
实验以不同腌制年数盐渍萝卜为研究对象,以其颜色变化作为腌制时间依据,考察了不同腌制时间盐渍萝卜取物对两种细菌、一种酵母菌的抑菌效果。实验结果表明,不同腌制时间的盐渍萝卜在颜色值上存在显著差异,总色差值总体呈上升趋势,这表明随腌制时间延长,盐渍萝卜的颜色在逐渐加深。通过抑菌试验发现,相较于白萝卜而言,多数盐渍萝卜的丙酮和乙酸乙酯提取物对3种指示菌具有良好的抑菌效果;不同提取物对不同菌种的抑菌效果存在差异;丙酮提取物的抑菌效果整体上好于乙酸乙酯,且多数提取物对酵母菌的抑菌效果好于阳性对照,但只有腌制时间为20年的盐渍萝卜,其对细菌的抑菌效果与阳性对照相近。腌制时间在10年以内的盐渍萝卜乙酸乙酯提取物对细菌的抑菌效果好于10年以上的。造成不同年数盐渍萝卜提取物抑菌效果差异的原因以及起主要作用的抑菌活性成分还有待于进一步研究。
[1]COOGAN R C,WILLS R B H.Flavour changes in Asian white radish(Raphanus sativus) produced by different methods of drying and salting[J].Int J Food Prop,2008,11(2):253-257.
[2]GUTIÉRREZ R M P,PEREZ R L.Raphanus sativus(Radish):their chemistry and biology[J].Sci World J,2004,4:811-837.
[3]MATSUOKA H,HONZAWA S,TAKAHASHI A,et al.Photoisomerization of 2-[3-(2-thioxopyrrolidin-3-ylidene) methyl]-tryptophan,a yellow pigment in salted radish roots[J].Biosci Biotech Bioch,2008,72(9):2262-2268.
[4]MATSUOKA H,TAKAHASHI A,OZAWA Y,et al.2-[3-(2-Thioxopyrrolidin-3-ylidene) methyl]-tryptophan,a novel yellow pigment in salted radish roots[J].Biosci Biotech Bioch,2002,66(7):1450-1454.
[5]OZAWA Y,UDA Y,KAWAKISHI S.Generation of a β-carboline derivative,the yellowish precursor of processed radish roots,from 4-methylthio-3-butenylisothiocyanateandL-tryptophan[J].Agr Biol Chem,1990,54(7):1849-1851.
[6]OZAWA Y,KAWAKISHI S,UDA Y,et al.Isolation and identification of a novel β-carboline derivative in salted radish roots,Raphanus sativusL.[J].Agr Biol Chem,1990,54(5):1241-1245.
[7]TAKAHASHI A,MATSUOKA H,WATANABE E,et al.Quantitative analysis of yellow pigment in Takuan-zuke and their ABTS radical cation scavenging activity[J].Food Sci Technol Res,2009,15(3):337-342.
[8]MATSUOKA H,TAKAHASHI A,YANAGI K,et al.Antimicrobial Action of 2-Thioxo-3-pyrrolidinecarbaldehyde,a major thiolactam compound generated from the pungent principle of radish in an aqueous medium[J].Food Sci Technol Int,1997,3(4):353-356.
[9]UDA Y,OZAWA Y,YONEYAMA K.Occurrence of biologically active 2-thioxopyrrolidines and 3,5-disubstituted 2-thiohydantoins from the pungent principle of radish (Raphanus sativusL.)[J].Stud Nat Prod Chem,2002,26:1073-1111.
[10]马 煜,林弋戈,陈 苹,等.GB/T 7921—2008 均匀色空间和色差公式[S].北京:中国标准出版社,2008.
[11]杨 琦,谢志镭,严维凌,等.LAB 在血红蛋白色素呈色效果评价中的应用[J].中国食品学报,2012,12(11):184-188.
[12]李 洁.4-MTBI 与腌制萝卜黄变的关系与机制[D].武汉:华中农业大学博士论文,2008.
[13]ABDOU I A,ABOU-ZEID A A,EL-SHERBEENY M R,et al.Antimicrobial activities ofAllium sativum,Allium cepa,Raphanus sativus,Capsicum frutescens,Eruca sativa,Allium kurraton bacteria[J].Qual Plant Mater Veg,1972,22(1):29-35.
[14]BEEVI S S,MANGAMOORI L N,DHAND V,et al.Isothiocyanate profile and selective antibacterial activity of root,stem,and leaf extracts derived fromRaphanus sativusL.[J].Foodborne Pathog Dis,2009,6(1):129-136.
[15]HU S H,WANG J C,KUNG H F,et al.Antimicrobial effect of extracts of cruciferous vegetables[J].Kaohsiung J Med Sci,2004,20(12):591-599.
[16]COOG AN R C,WILLS R B H.Effect of drying and salting on the flavour compound of Asian white radish[J].Food Chem,2002,77(3):305-307.
[17]NAKAMURA Y,IWAHASHI T,TANAKA A,et al.4-(Methylthio)-3-butenyl isothiocyanate,a principal antimutagen in Daikon(Raphanus sativus;Japanese White Radish)[J].J Agr Food Chem,2001,49(12):5755-5760.
[18]OBEIDAT M,SHATNAWI M,ALALAWI M,et al.Antimicrobial activity of crude extracts of some plant leaves[J].Res J Microbiol,2012,7(1):59-67.
[19]HAQUE A,SIDDIQI M M A,RAHMAN A,et al.Antimicrobial and cytotoxic activities of the crude extracts ofCallistemon linearis[J].Int J Biosci,2013,3(3):129-133.
[20]USHA M,RAGINI S,NAQVI S M A.Antibacterial activity of acetone and ethanol extracts of Cinnamon(Cinnamomum zeylanicum) and Ajowan(Trachyspermum ammi)on four food spoilage bacteria[J].Int Res J BiolSci,2012,1(4):7-11.
[21]COWAN M M.Plant products as antimicrobial agents[J].Clin Microbiol Rev,1999,12(4):564-582.
[22]MOHAMMADZADEH T,SADJJADI S M,HABIBI P,et al.Comparison of agar dilution,broth dilution,cylinder plate and disk diffusion methods for evaluation of anti-leishmanial drugs on leishmania promastigotes[J].Iran J Parasitol,2012,7(3):43-47.
[23]ELOFF J N.Which extractant should be used for the screening and isolation of antimicrobial components from plants?[J].J Ethnopharmacol,1998,60(1):1-8.
[24]OSKAY M,SARI D.Antimicrobial screening of some Turkish medicinal plants[J].Pharm Biol,2007,45(3):176-181.
[25]VAARA M.Agents that increase the permeability of the outer membrane[J].Microbiol Rev,1992,56(3):395-411.
[26]GRAYSON M L,ELIOPOULOS G M,FERRARO M J,et al.Effect of varying pH on the susceptibility of Campylobacter pylori to antimicrobial agents[J].Eur J Clin Microbiol,1989,8(10):888-889.
[27]ERAH P O,GODDARD A F,BARRETT D A,et al.The stability of amoxycillin,clarithromycin and metronidazole in gastric juice:relevance to the treatment of Helicobacter pylori infection[J].J Antimicrob Chemoth,1997,39(1):5-12.
[28]HSIEH P C,MAU J L,HUANG S H.Antimicrobial effect of various combinations of plant extracts[J].Food Microbiol,2001,18(1):35-43.

