红枣叶片叶绿素提取方法的比较
冯一峰,王 艳,唐 都,李湘钰,吴翠云,2*
(1.塔里木大学 植物科学学院,新疆 阿拉尔 843300;2.新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
植物中叶绿素(chlorophyll)含量是调查植物生理生化及生态指标的一个重要测量参数,其不仅能表达植物生长发育情况,也能作为检测周围环境因子的关键指标[1]。叶片是植物光合作用的主要器官,叶片的大小与植物光合产物的积累直接相关[2],植物体中叶绿素含量多少能体现出其光合能力的强弱,因此叶绿素含量的测定方法也变得尤为重要。
目前叶绿素含量的测定方法主要有2种,一种是分光光度法,另一种是SPAD叶绿素仪法[3],前者是对叶片叶绿素的精确测量,适用于实验室测量,后者比较粗放,适于田间测量。分光光度法测量已在桑叶、茶叶、樱桃、红香椿[4]、杉木[5-8]等较多的植物上有运用,不同植物叶片的叶绿素含量有所差异,相同植物不同提取方法对叶绿素含量测量也有很大影响[9]。张宇斌等[10]认为乙醇∶丙酮(1∶1)的混合液提取叶绿素含量最高,张素霞等[11-12]研究认为乙醇-丙酮2∶1混合浸提10 min效果最好,李得孝等[13]研究认为室温下丙酮-乙醇水混合浸提效果最好,王冬等[14]以乙醇与丙酮物质的量之比1∶1的混合溶液为浸提剂对仙人掌进行叶绿素提取得出:温度50 ℃,固液比为1∶40条件下提取5 h,叶绿素的提取效率最高。本研究在前人研究基础上进一步探讨骏枣叶片叶绿素含量测定的优选方法:将不同植物叶绿素的提取效果较好的方法进行综合与比较(3种提取液:体积分数95%乙醇、体积分数80%丙酮、体积分数95%乙醇-体积分数80%丙酮1∶1混合、4种提取方法:室温静置浸提法、室温研磨浸提法、研磨+室温静置浸提法、温热静置浸提法),以期选出适合红枣叶片叶绿素的较好提取液及提取方法,为今后枣叶片中叶绿素的提取测定方法提供参考依据。
1 材料与方法
1.1 材料与试剂
骏枣叶片:新疆阿克苏地区;体积分数95%乙醇:天津永晟精细化工有限公司;丙酮:西安化学试剂厂;试剂均为分析纯。
1.2 仪器与设备
UV1800紫外可见分光光度计:上海菁华科技仪器有限公司;H2100R高速冷冻离心机:湖南湘仪实验室仪器开发有限公司。
1.3 试验方法
九月下旬取样,取骏枣相同二次枝上同一节枣吊中部叶片装入采集箱立即带回实验室擦净、去除叶脉剪碎(不超过2 mm)混匀,一部分现用,另一部分放入-20 ℃冰箱待用,每个指标做3次重复。
1.3.1 室温静置浸提法
取3支25 mL试管分别放入0.2 g剪碎的骏枣叶片,再向3支试管中分别加入体积分数95%乙醇、体积分数80%丙酮、乙醇-丙酮1∶1混合液各10 mL,黑暗处室温(25 ℃)浸提24 h,其间不停摇匀,24 h后叶片变白,于663 nm和646 nm波长下比色。
1.3.2 室温研磨浸提法——室温下研磨后立即离心比色
分别称取0.2 g剪碎的叶片于3个研钵,加入2.5 mL研磨液(3个研钵研液分别为体积分数95%乙醇、体积分数80%丙酮、乙醇-丙酮混合液)于室温条件下研磨5 min至叶片颜色变白后倒入离心管,洗涤研钵3次,每次2.5 mL,共10 mL研液,重复3次后立即离心比色,离心前搅拌均匀。
1.3.3 研磨+室温静置浸提法
如1.3.2方法黑暗处室温放置2 h,其间不停搅拌,叶片变白后离心比色。
1.3.4 温热静置浸提法
取3支25 mL试管分别放入0.2 g剪碎的骏枣叶片,再分别加入体积分数95%乙醇、体积分数80%丙酮、乙醇-丙酮1∶1混合液各10 mL,在50 ℃条件下浸提5 h,其间不停摇匀,避光,叶片变白后离心比色。
1.3.5 实验测定方法
采用UV1800型紫外/可见光分光光度计进行比色,本试验中3种浸提液的吸收光谱基本相似[4],计算公式可以采用的Arnon法修正公式进行计算,数据用Excel和DPS软件进行处理分析。叶绿素计算公式如下:
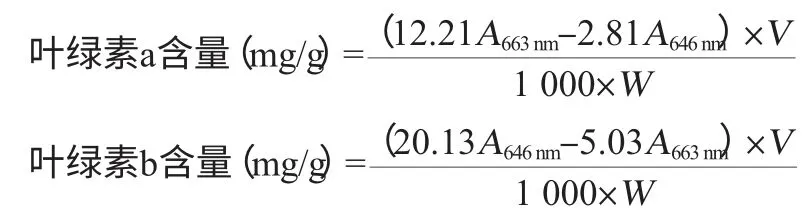
叶绿素总含量(mg/g)=叶绿素a含量+叶绿素b含量
式中:A为分光光度计所测吸光度值;V为样品提取液总体积,mL;W为骏枣叶片鲜质量,g。
2 结果与分析
2.1 同一种提取液不同提取方法的比较结果
2.1.1 乙醇为提取液4种提取方法对骏枣叶绿素提取量的影响
以乙醇为提取液的4种提取方法测得的骏枣叶片中叶绿素a、叶绿素b和叶绿素总含量差异见图1。由图1可以看出,室温静置24 h提取的各种叶绿素含量与研磨+室温静置浸提法无显著差异,但显著高于室温研磨提取法和温热静置提取法,其中,叶绿素a提取量分别提高61.18%和90.28%,叶绿素b提取量分别提高76.19%和68.18%,总叶绿素提取量分别提高64.15%和85.11%;研磨+室温静置提取法的叶绿素a和总叶绿素均显著高于室温研磨提取和温热静置提取,其中,叶绿素a提取量分别高出80%和113%,总叶绿素提取量分别高出72.64%和94.68%,而叶绿素b提取量无显著差异;室温研磨提取和温热静置提取在各叶绿素之间均无显著差异;同样是研磨法中的研磨+静置室温提取和室温研磨提取之间差异性显著,原因是后者的提取时间不够充分导致提取叶绿素的量不足。
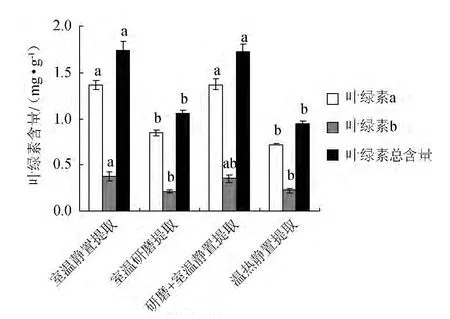
图1 体积分数95%乙醇提取液不同提取方法对叶绿素含量提取效果的影响Fig.1 Effect of different extraction methods by 95% ethanol extract on chlorophyll extraction content
2.1.2 丙酮为提取液4种提取方法对骏枣叶绿素提取量的影响
由图2可以看出,以体积分数80%丙酮为提取液进行提取:提取叶绿素a时,4种提取方法之间均存在显著差异,表现为室温静置提取>研磨+室温静置提取>温热静置提取>研磨室温提取;对叶绿素b的提取中,室温静置提取法显著高于其他3种提取方法,研磨+室温静置提取显著高于室温研磨提取和温热静置提取,室温研磨提取与温热静置提取之间无显著差异;提取总叶绿素时,4种提取方法之间也均存在显著差异,总叶绿素以室温静置的提取效果较好,达到1.58 mg/g,显著高于其他3种提取方法,室温研磨提取的提取效果较差,只有0.36 mg/g,显著低于其余3种提取方法,较少的提取量是由于研磨过程中提取的时间太短,叶绿素还未充分提出且叶绿素在研磨过程中分解较快导致的,与徐芬芬等[15]对小白菜叶绿素含量的测定研究结果一致。
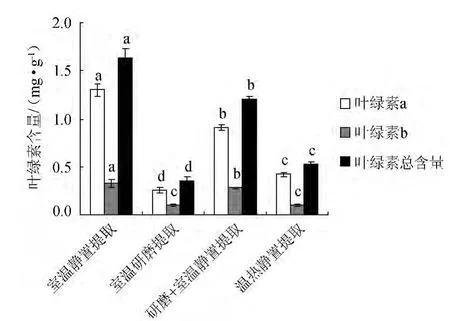
图2 体积分数80%丙酮提取液不同提取方法对叶绿素含量提取效果的影响Fig.2 Effect of different extraction methods by 80% acetone extract on chlorophyll extraction content
2.1.3 乙醇-丙酮1∶1混合提取液4种提取方法对骏枣叶绿素提取量的影响
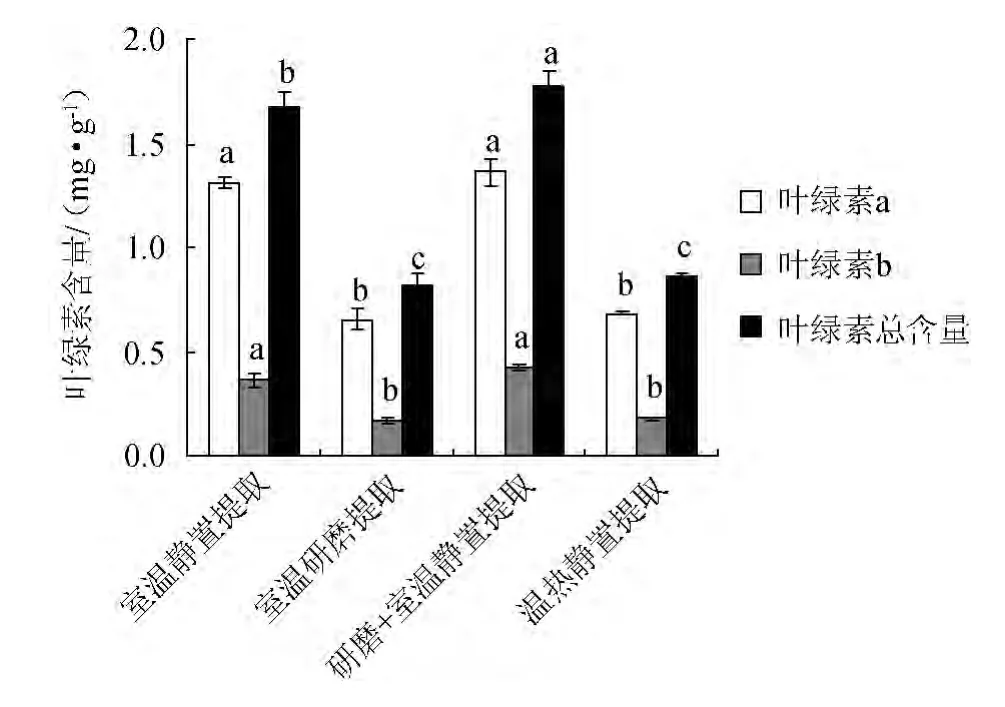
图3 混合提取液不同提取方法对叶绿素含量提取效果的影响Fig.3 Effect of different extraction methods by mixed extract on chlorophyll extraction content
由图3可以看出,混合提取液对叶绿素a的提取量变化趋势与2.1.1中的单一乙醇提取液提取量变化趋势相同,室温静置提取与研磨+室温静置提取效果之间差异不显著,室温研磨提取与温热静置提取效果之间差异不显著,前两种提取方法提取效果显著高于后两者提取方法;混合提取液对叶绿素b的提取效果与其对叶绿素a的提取效果变化趋势相同;混合提取液中研磨+室温静置提取总叶绿素的提取效果显著高于其他3种提取方法的提取效果,达到了1.78 mg/g,室温静置提取效果其次,室温研磨提取和冷冻材料温热静置提取效果处于同一水平,分别为0.82 mg/g和0.86 mg/g,提取总叶绿素的效果较差。
2.2 4种提取方法分别与不同提取液的交互作用提取效果比较
同种处理方法下不同浸提液的提取效果比较,对4种提取方法提取的叶绿素做显著性差异分析,结果见表1。由表1可以看出,室温静置法对叶绿素a和叶绿素b的提取量总体高于其他各提取方法的提取量,且与室温研磨提取和温热静置提取存在显著性差异;众多提取方法中,95%vol乙醇室温静置提取(1.74 mg/g)、95%vol乙醇研磨+室温静置提取(1.83 mg/g)和乙醇-丙酮1∶1混合液研磨+室温静置提取(1.78 mg/g)提取效果较好,显著高于其他各处理;80%vol丙酮室温研磨提取效果较其他各处理差,可能由于时间太短,叶绿素提取不够充分,也可能是丙酮极易挥发,提取液量迅速减少而影响提取效果。
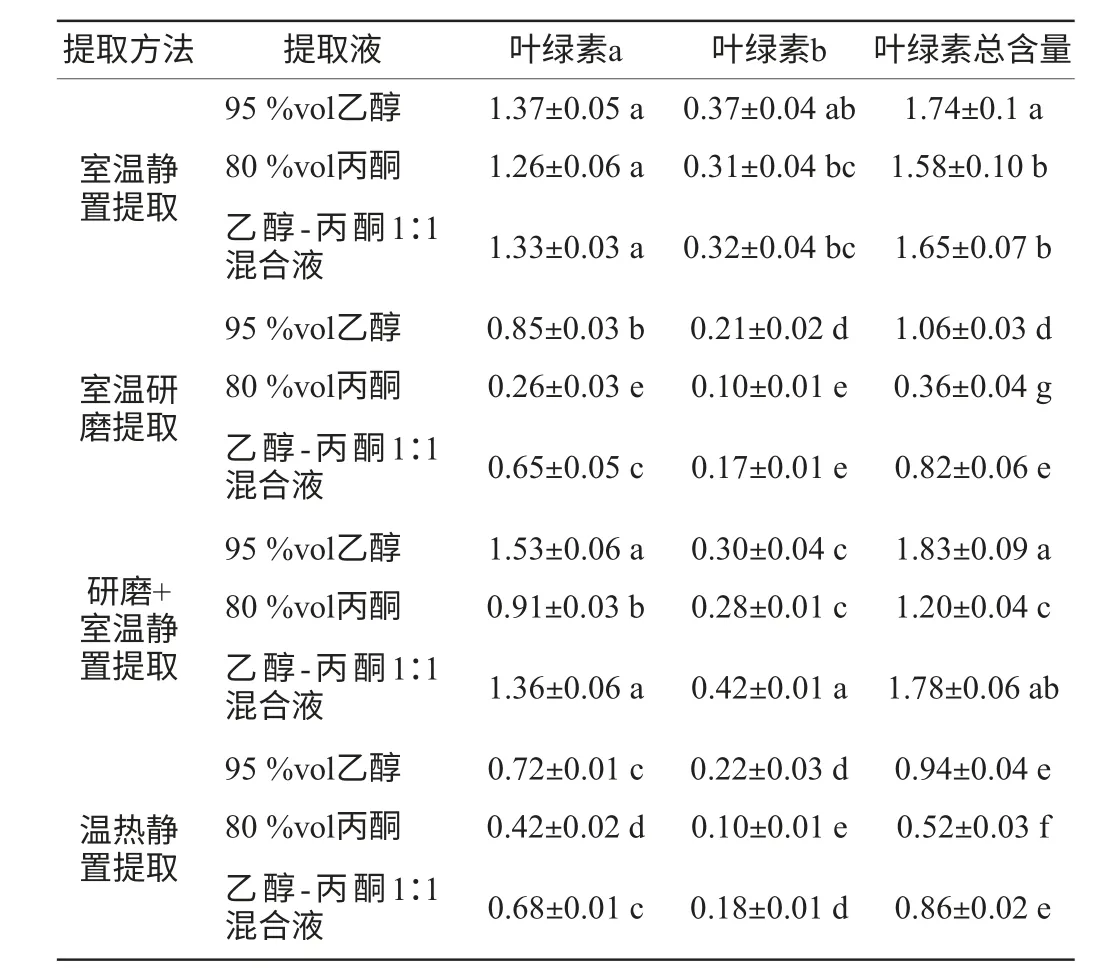
表1 处理方法与浸提液的交互作用Table 1 Processing method and interaction of the extraction solution
3 结论
4种不同的提取方法中,单种提取液体积分数95%乙醇对骏枣叶片总叶绿素的提取效果均较好,显著高于单种提取液丙酮,与李志丹等[16]研究结果一致。在研磨法和浸提法3种浸提液浸提效果中,体积分数95%乙醇作为研磨剂研磨后黑暗中放置2 h浸提效果较好,体积分数80%丙酮研磨后立即离心比色效果较差,乙醇提取液室温下浸提24 h、乙醇-丙酮1∶1混合液研磨+静置室温提取效果虽与乙醇研磨后黑暗中放置2 h的叶绿素提取量无显著性差异,但乙醇室温24 h耗费时间,混合液中的丙酮为有毒气体,因此选用体积分数95%乙醇研磨后黑暗中放置2 h(其间不停搅拌)进行红枣叶绿素的提取。
[1]张 亮,曹丛华,任荣珠,等.大叶黄杨叶绿素的提取及稳定性研究[J].安徽农业科学,2010,38(17):8923-8925.
[2]刘西军,陈 静,徐小牛,等.桂花叶片SPAD、叶绿素含量和比叶重特征[J].安徽农业大学学报,2013,40(1):51-54.
[3]王 瑞,陈永忠,陈隆升,等.油茶叶片SPAD 值与叶绿素含量的相关分析[J].中南林业科技大学学报,2013,33(2):77-80.
[4]刘 静,张爱民,李湘利,等.红香椿叶绿素的提取工艺与稳定性的研究[J].中国酿造,2012,31(3):82-86.
[5]邓祥元,高 坤,张丽娟.不同溶剂萃取桑叶叶绿素效率的初步研究[J].中国农学通报,2011,27(2):389-394.
[6]赵先明,汪艳霞,杜 晓,等.茶叶叶绿素混合液浸提法提取条件优化[J].西南农业学报,2011,24(4):1303-1308.
[7]孙俊宝,王建新.樱桃叶绿素含量测定方法研究[J].山西农业科学,2010,38(3):18-19.
[8]刘 璇,林 辉,藏 卓,等.杉木叶绿素a 含量与高光谱数据相关性分析[J].中南林业科技大学学报,2010,30(5):72-76.
[9]徐国瑞,刘济明,闫国华,等.罗甸小米核桃叶绿素含量测定方法研究[J].山地农业生物学,2010,29(5):419-423.
[10]张宇斌,张永兰,蹇 毅,等.不同提取液对蓝莓叶绿素提取效果的影响[J].贵州农业科学,2013,41(2):45-46.
[11]张素霞.菠菜叶中叶绿素提取工艺研究[J].中国食物与营养,2008(5):41-43.
[12]彭运生,刘 恩.关于提取叶绿素方法的比较研究[J].北京农业大学学报,1992,18(3):247-249.
[13]李得孝,郭月霞,员海燕,等.玉米叶绿素含量测定方法研究[J].中国农学通报,2005(6):153-155.
[14]王 冬,李建华,祝锡键,等.仙人掌叶绿素提取工艺研究[J].安徽农业通报,2006,12(5):67-68.
[15]徐芬芬,叶利民,徐卫红,等.小白菜叶绿素含量的测定方法比较[J].北方园艺,2010(23):32-34.
[16]李志丹,韩瑞宏,廖桂兰,等.植物叶片中叶绿素提取方法的比较研究[J].广东第二师范学院学报,2011(6):80-83.

