食品中大肠杆菌O157∶H7疑似菌株的分离和鉴定研究
杨一群,陈 洋,杜文芳,侯斌斌,毕旺来,李 睿,2*
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.农产品加工湖北省协同创新中心,湖北 武汉 430023)
很多肠出血性大肠杆菌都能引起人出现出血性腹泻。美国俄勒冈和密执安州在1982年发生了一些出血性肠炎的爆发流行病例,并从其中一个患者粪便中分离出肠出血性大肠杆菌O157∶H7[1]。O157菌株致病机理非常复杂,stx基因、LEE毒力岛编码intimin的eae基因和大质粒上编码溶血素的hly基因等都是其重要毒力因子[2]。O157主要毒力因子是位于噬菌体基因上的stx1、stx2基因,这两种基因分别编码志贺毒素Stx1、Stx2[3]。目前肠出血性大肠杆菌包括了多种血清型大肠杆菌,如O157、O26、O111等,但O157∶H7血清型仍是引起人类出血性结肠炎的主要致病菌,其还可以引起人患溶血性尿毒综合征等食物中毒并发症,严重者发生急性肾衰竭而死亡[4]。肠出血性大肠杆菌O157∶H7可以通过3种方式进行传播:食源性传播、水源性传播及接触传播。其中食源性传播最为普遍,主要是以牛肉、猪肉等动物性食物为主要载体进行传播[5]。美国、加拿大、日本、英国等国曾多次爆发O157∶H7感染疫情[6]。因此肠出血性O157∶H7的检验检疫一直是世界各地食品安全的重要研究内容[7]。
目前国标法检测O157∶H7有常规平板培养法、免疫磁珠捕获法、聚合酶链反应(polymerase chain reaction,PCR)法[8]。平板培养法经过逐级选择性平板培养,阳性菌落做血清学实验和生化实验验证,步骤较多较费时;免疫磁珠捕获法与常规平板培养法步骤类似,操作复杂,费时;PCR虽然快速灵敏,但是假阳性高,只能作为检测O157∶H7的初级手段使用,不能从样本中分离筛选出O157∶H7菌株,阳性样本往往还需要进一步实验验证。
采用以上3种方法,并优化技术路线,对武汉市售食品样品进行O157∶H7快速检测和分离筛选,并鉴定筛选出的O157∶H7疑似菌株,以评估采用的筛选方法的可靠性。本研究结果对今后进行食品中O157∶H7快速检测和筛选鉴定,提高检测准确性,具有积极意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
O157∶H7阳性对照菌株(EC150):日本九州大学赠送;5株O157∶H7疑似菌株:分别从武汉市售牛肉和猪肉样品中分离得到。
1.1.2 试剂
DNA 分子量标准物、TaqPCR 试剂盒(DR001B)、VT1/VT2检测试剂盒(RR105A):日本Takara公司;Gold-View核酸染料:赛百盛基因技术有限公司;大肠杆菌O157免疫磁珠分离试剂盒:天津生物芯片技术有限责任公司;O157、H7诊断血清:宁波天润生物药业有限公司;改良山梨糖醇麦康凯琼脂(modified sorbitol macconkey agar,CT-SMAC)、改良O157显色培养基、新生霉素、脑心浸液培养基(brian heart infusion,BHI)培养基:武汉法斯特生物检验技术有限公司;TIANGEN 细菌基因组提取试剂盒:武汉华顺生物技术有限公司;引物委托武汉鼎国生物技术有限公司合成。
1.2 仪器与设备
HMB-400B拍击式均质器:天津市恒奥科技发展有限公司;GBox-HR-E-M凝胶图像系统:英国Syngene公司;台式高速冷冻离心机:德国eppendorf公司;DYY-10C电泳仪:北京六一仪器厂;Tgradient PCR仪:德国Biometra公司。
1.3 方法
1.3.1 样品处理
在2013年5~9月期间,在武汉市22个菜市场、大型超市分批采集样品117份。食品样品采集后放入无菌均质袋,冰袋冷藏运回。当天即进行富集培养。无菌操作,称取12.5 g样品,同112.5 mL灭菌TSB培养液一起放入均质袋中,在拍击式均质器中均质90 s,将均质后的培养液转入三角瓶中,37 ℃培养22 h。取菌液1 mL于EP管中,加入甘油冻存。
1.3.2 食品中O157∶H7快速检测和分离筛选流程图
食品中样品O157∶H7快速检测及分离筛选工艺流程见图1。
1.3.3 混合菌液DNA提取
取培养后的菌液1 mL于EP管中,12 000 r/min离心3 min并去掉上清液。按TIANGEN 细菌基因组DNA提取试剂盒说明操作,提取细菌基因组DNA。提取后的DNA溶解在50 μL TE缓冲液中。取5 μL DNA于1%的琼脂糖凝胶电泳,检测细菌DNA是否提取完好。将提取完好的细菌DNA于-20 ℃冰箱中保存。

图1 食品样品大肠杆菌O157:H7快速检测和分离筛选技术流程图Fig.1 Flow chart of screening and separation of E.coli O157∶H7 in food samples
1.3.4 PCR扩增rfbO157、stx基因
VT1/VT2检测试剂盒用来扩增stx1和stx2基因。stx1预期产物大小为349 bp;stx2预期产物大小为404 bp。rfbO157引物及预期产物大小见表1。
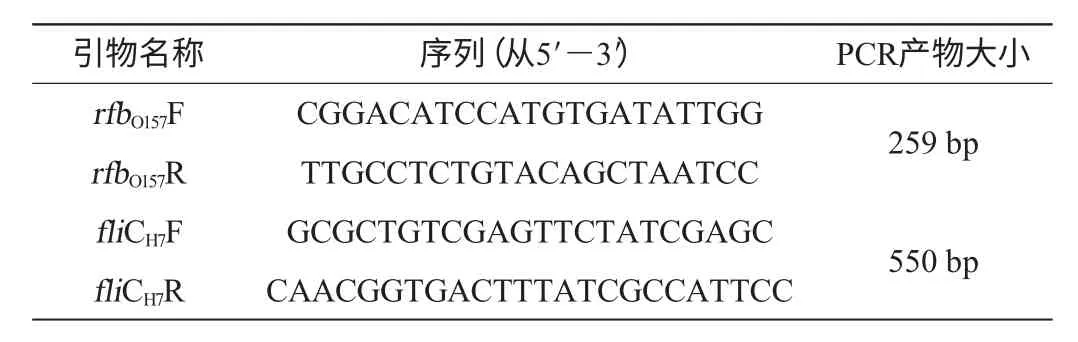
表1 PCR引物序列及产物大小Table 1 PCR primer sequence and length of the PCR amplification products
stx基因扩增体系及条件如下:
检测体系:10×buffer 2.5 μL;2.5 mmol/L dNTP 2 μL;10 μmol/L引物 各0.5 μL;TaqDNA 聚合酶0.15 μL;模板1 μL DNA;dddH2O 18.85 μL。反应条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。阴性对照用无菌水。
rfbO157基因扩增体系及条件如下:
检测体系:10×buffer 2.5 μL;2.5 mmol/L dNTP 2 μL;10 μmol/L引物 各0.5 μL;TaqDNA 聚合酶0.15 μL;模板1 μL DNA;dddH2O 18.35 μL。反应条件:94 ℃预变性3 min;94 ℃变性1 min,59 ℃退火1 min,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。阴性对照用无菌水。
1.3.5 分离O157菌株
将stx以及rfbO157PCR检测结果均为阳性的菌液,复苏。用添加有新生霉素的EC增菌培养液,41 ℃下重新富集培养22 h。取20 μL O157免疫磁珠加入离心管,并加入1 mL增菌液混合,按免疫磁珠试剂盒说明书操作,将离心管放在磁珠分选仪上进行免疫磁珠捕获。吸取所有含免疫磁珠的洗脱液在O157改良显色平板上,涂布一半平板,另一半平板做划线培养。于37 ℃培养20 h。挑取红色阳性单菌落转接CT-SMAC平板,37 ℃培养12 h。将无色阳性菌落用O157诊断血清进行玻片血清凝集实验。同时挑取该无色菌落于PCR管中做菌落PCR。
1.3.6 O157抗原血清学鉴定
分别取1滴O157诊断血清和1滴生理盐水滴在载玻片左右两边,分别用灭菌牙签挑取适量菌泥在O157诊断血清和生理盐水中涂布开,晃动载玻片,在1 min内观察菌体是否出现凝集现象。若生理盐水未出现菌体凝集反应而诊断血清出现凝集反应,则检测的样品为阳性。阳性对照组采用参考菌株EC150。
1.3.7 菌落PCR鉴定stx基因
VT1/VT2检测试剂盒用来扩增stx1和stx2基因。用灭菌牙签在CT-SMAC平板上沾取适量菌体于PCR管中,加入PCR反应液。菌落PCR反应体系为:10×buffer 1 μL;2.5 mmol/L dNTP 0.8 μL;10 μmol/L引物 各0.2 μL;TaqDNA 聚合酶0.08 μL;无菌双蒸水7.72 μL。PCR扩增程序:94 ℃预变性8 min;94 ℃变性30 s,55 ℃30 s,72 ℃30 s,共30个循环;72 ℃延伸10 min。阴性对照为无菌水。
1.3.8 H7鞭毛抗原血清学鉴定
方法参考文献[9]。将待鉴定的O157∶H7疑似菌株,采用穿刺接种法接种于4%强营养软琼脂中,37 ℃培养过夜后再转接于4%强营养软琼脂,重复穿刺接种培养4次。将鞭毛诱导好的细菌转接于BHI液体培养基中,37 ℃培养过夜,等量加入含1%甲醛的生理盐水,制成待检样。取2支干净小试管,分别加入0.5 mL待检样品和生理盐水,滴加3滴H7诊断血清,50 ℃水浴加热1 h。如生理盐水无凝集,而血清出现絮状沉淀,则待检样品为阳性。
1.3.9 纯菌DNA模板的制备
将待检菌株接种于5 mL LB液体培养基中,37 ℃,培养16 h。取1 mL菌液于离心管中,按1.3.2方法制备DNA。
1.3.10 PCR检测fliCH7基因
PCR反应体系为:10×buffer 2.5 μL;2.5 mmol/L dNTP 2 μL;0.2 μmol/L引物 各0.5 μL;TaqDNA 聚合酶0.15 μL;模板1 μL DNA;dddH2O:18.35 μL。PCR扩增程序:94 ℃预变性3 min;94 ℃变性1 min,59 ℃退火1 min,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min。阴性对照用无菌水。引物参考文献[10]合成。
2 结果与分析
2.1 食品中O157∶H7疑似菌株的检测、分离和筛选
采用图1所示流程,对117份食品样品进行了PCR扩增,经检验,117份样品中有55份样品rfbO157基因PCR检测结果显示阳性,但其中有20份样品stx基因检测结果为阴性,stx和rfbO157基因同时检出为阳性的样品有35份。
从这35份样品中挑选部分样品,经过免疫磁珠分离、显色培养基培养、O157诊断血清玻片凝集反应鉴定等步骤,分离筛选出4株O157∶H7疑似菌株,但有一份样品经过免疫磁珠捕获后在O157显色培养基上培养时,菌落为红色,在CT-SMAC平板上菌落为无色,呈现出典型的O157阳性菌落特征。但用O157单价血清做玻片凝集实验时,挑选的单菌落均无法与O157诊断血清产生凝集反应,始终无法从该阳性样品中分离到阳性单菌落。该份样品改用菌落PCR法筛选单菌,筛出1株O157∶H7疑似菌株,命名为EC5.11。EC5.11菌落PCR检测结果电泳图样如图2所示。

图2 stx基因菌落PCR扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of colony PCR amplification products of stx gene
由图2可知,5种O157∶H7疑似菌株均携带stx基因。
2.2 O157∶H7疑似菌株的鉴定
将5株O157∶H7疑似菌株重新分离纯化后,按1.3.8方法进行H7鞭毛诱导恢复。然后进行H7抗原血清学鉴定。5株菌中仅有1株菌EC9.101有较明显的凝集反应。5株菌都能与O157抗原发生凝集反应,但凝集反应程度不同,EC5.11仅能与O157诊断血清产生微弱凝集反应。用PCR方法对5株菌的rfbO157及fliCH7基因进行检测。PCR检测结果电泳图分别如图3、图4所示。

图3 rfbO157基因PCR扩增产物琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of PCR amplification products of rfbO157gene
由图3可知,5株菌rfbO157检测结果均为阳性,表明5株菌O抗原为O157血清型。

图4 fliCH7基因PCR扩增产物琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of PCR amplificatio products of fliCH7gene
由图4可知,4株菌fliCH7为阳性。经过PCR和血清学实验最终确定出,5株疑似菌株有4株为O157∶H7型,菌株EC9.102为O157血清型,H抗原血清型待定。
3 结论
本研究发现,EC5.11在O157改良平板和CT-SMAC平板上生长时,均呈现典型的O157阳性菌落特征,但无法与O157诊断血清发生良好凝集反应。反之,很多细菌如赫氏埃希菌因与O157具有类似抗原,也能与O157诊断血清产生强凝集反应[11-12]。因此血清学方法是一种可靠性比较差的筛选方法,单一采用血清学鉴定的方法分离和鉴定O157:H7非常不可靠。
很多O157菌株不携带stx基因,这些菌株不能产生志贺毒素,对人类健康影响较少[13]。本次研究有20份样品检出rfbO157基因阳性,但stx基因检测结果为阴性。我国公布的行业标准致病菌PCR检测法仅单一扩增O157标志基因rfbO157,并不能说明食品中污染的O157是否具有致病力[14]。因此对食品中O157污染状况进行检测评估时,建议采用三重PCR先进行初筛,同时检测O157抗原标志基因比如rfbO157、志贺毒素编码基因stx1和stx2。此方法较之行业标准方法,可以对食品中O157的毒力状况进行较全面的判定。
国标法在O157∶H7分离筛选流程中,先后采用了CT-SMAC、O157改良显色培养基、TSI培养基、MUG-LST肉汤等进行选择性培养和初步生化鉴定,阳性菌落再进行血清学实验。在实际筛选工作中发现,TSI、MUG-LST针对O157∶H7特异性并不强,因此筛选流程中去除了这两种培养基。经过免疫磁珠捕获、O157改良显色培养基和CT-SMAC选择性培养后,将阳性菌落同时做血清学鉴定和菌落PCR,可以在减少工作量同时提高PCR阳性样本中O157菌株的分离率,避免漏筛。
在进行H7鞭毛抗原血清学鉴定时,有4株菌表现为阴性,但在PCR鉴定fliCH7时,这4株菌中有3株都为H7鞭毛抗原阳性。很可能是在进行菌体鞭毛诱导时,鞭毛生长不充分或根本没有长出鞭毛。很多类似研究也证实O157∶H7疑似菌株采用血清学鉴定和PCR鉴定时,结果差异较大[15]。因此血清学鉴定的结果不可以作为实验最终结果,只能作为参考。PCR鉴定更灵敏,特异性更强,适合在菌株筛选和鉴定中作为主要方法使用。
[1]RILEY L W,REMIS R S,HELGERSON S D,et al.Hemorrhagic colitis associated with a rareEscherichia coliserotype[J].New Engl J Med,1983,308(12):681-685.
[2]LAW D.Virulence factors ofEscherichia coliO157 and other Shiga toxin-producingE.coli[J].J Appl Microbiol,2000,88(5):729-745.
[3]MANNING S D,MOTIWALA A S,SPRINGMAN A C,et al.Variation in virulence among clades ofEscherichia coliO157:H7 associated with disease outbreaks[J].P Natl Acad Sci USA,2008,105(12):4868-4873.
[4]MARTIN B.Treatment options for HUS secondary toEscherichia coliO157:H7 HUS treatment options[J].Kidney Int,2009,75(112):62-66.
[5]BAYLIS C.Raw milk and raw milk cheeses as vehicles for infection by verocytotoxin-producingEscherichia coli[J].Int J Dairy Technol,2009,62(3):293-307.
[6]王培育,周 梅.肠出血性大肠杆菌O157∶H7 检测技术进展[J].国际检测医学杂志,2013,34(19):2570-2572.
[7]宋宏新,李 宏.肠出血性大肠杆菌O157∶H7 的检测方法进展[J].食品科学,2008,28(11):607-610.
[8]刘秀梅,廖兴广,张秀丽,等.GB/T 4789.36—2008 食品卫生微生物学检验[S].北京:中国标准出版社,2008.
[9]王志强,许龙岩,李志勇,等.出血性大肠杆菌H7 鞭毛抗原的诱导恢复及鉴定[J].食品科学,2004,25(9):144-146.
[10]PATON A W,PATON J C.Detection and characterization of shiga toxin genie Escherichia coli by using multiplex PCR assays forstxl,stx2 enterhemorrhagicE.coli hlyA,rfbO111andrfbO157[J].J Clin Microbiol,1998,36(2):598-602.
[11]赵 晋,薛 晴,杨晓蓉.与O157 诊断血清产生交叉凝集反应的9株赫氏埃希菌的分离鉴定[J].预防医学情报杂志,2005,21(6):757-758.
[12]张宗辉,奚弟荣.与志贺菌和大肠埃希菌O157 诊断血清交叉凝集反应细菌的分离和鉴定[J].预防医学情报杂志,2013,29(7):612-614.
[13]LI R,HARADA T,HONJOH K,et al.Phylogenetic analysis and Shiga toxin production profiling of Shiga toxin-producing enterohemorrhagicEscherichia coliclinical isolates[J].Microb Pathogenesis,2010,49(5):246-251.
[14]中国质量监督检验检疫总局,SN/T 1869—2007 食品中多种致病菌快速检测方法PCR 法[S].北京:中国标准出版社,2007.
[15]陈道利,许彦梅,罗 霞,等.PCR 方法检测EHEC O157∶H7 的rfb_(O157)、fliC_(H7)、hlyA、eaeA、stx2及其变种基因[J].中国卫生检验杂志,2005,15(10):1197-1200.

