栀子苷的精制纯化研究
蒋 威,徐 旭,景艳艳,杨 赞,方尚玲*
(湖北工业大学 生物工程学院 工业发酵湖北省协同创新中心 发酵工程教育部重点实验室,湖北 武汉 430068)
栀子是茜草科(Rubiaceae)栀子属(Gardenia)植物,具有泻火除烦、清热利尿、凉血解毒的作用,外治扭挫伤[1-2]。近年来对栀子苷的研究表明,其在消化系统、心血管系统、中枢神经系统及抗炎、抗肿瘤、降血糖方面具有广泛的药理作用[3-6]。
大孔吸附树脂是一类不带离子交换基团的多孔性交联聚合物吸附剂,具有良好的大孔网状结构和较大的比面积,对化学物质的分离作用主要由其吸附选择性产生,对单味中药提取物中苷类成分、黄酮、生物碱的分离效果良好,有的已经实现工业化生产[7-9]。
目前,栀子中栀子苷的提取和纯化方法多为水提醇沉法。本实验以提取栀子黄之后的废液为原料,利用大孔吸附树脂富集,以较简便的方法得到较高纯度的栀子苷产品,有利于工业化大规模生产。
1 材料与方法
1.1 材料与试剂
栀子:市售;栀子苷废液:利用栀子果提取栀子黄时产生的废液;栀子苷对照品:中国生物制品检定所,批号20 140122;大孔树脂X-5、AB-8、HPD-400、D3520、D1300、NKA:郑州勤实科技有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
UV-2201PC型紫外-可见分光扫描仪:日本岛津公司;EV-201旋转蒸发仪:上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 树脂静态吸附实验
(1)树脂的预处理
树脂预处理方法见参考文献[10]。
(2)静态吸附实验
静态吸附实验见参考文献[11]。
静态吸附实验吸附率及解吸率的计算公式为:
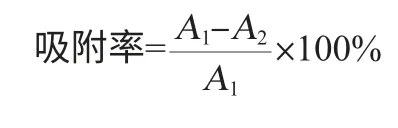
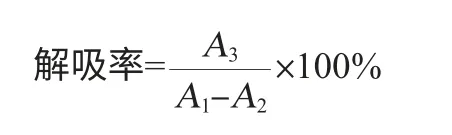
式中:A1为吸附前栀子苷粗提液在238 nm处的吸光度值,A2为吸附平衡后栀子苷粗提液在238 nm处的吸光度值,A3为解吸后体积分数30%乙醇中栀子苷粗提液在238 nm处的吸光度值。
1.3.2 树脂动态吸附实验
(1)树脂的预处理
树脂预处理方法同上。
(2)动态吸附流速确定研究
分别以1.0 mL/min、1.5 mL/min、2.0mL/min、2.5mL/min、3.0 mL/min的流速进行动态吸附。当达到吸附平衡时,流出液的吸光度值不再变化,记录上样液和流出液体积,测定总流出液和样液的吸光度值,吸附量计算公式如下:
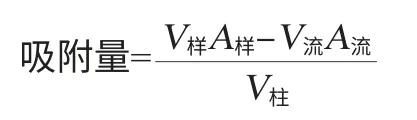
式中:V样为上样液体积,mL;V流流出液体积为,mL;A流为总流出液的吸光度值;A样为样液的吸光度值;V柱为树脂床体积,mL。
(3)不同浓度栀子废液对树脂吸附率的研究
各取120 mL(3BV)不同浓度栀子苷废液(稀释5、10、15、20、25倍)上柱,确定流速动态吸附,分别收集流出液,在238 nm波长处测定吸光度值A238nm,确定最佳栀子苷废液浓度,吸附率计算公式如下:
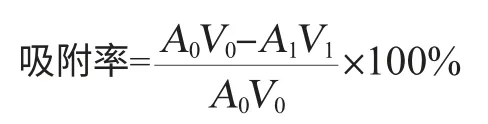
式中:A0为栀子苷上样液238 nm处吸光度值,V0为上样体积,mL;A1为流出液在238 nm处吸光度值,V1为流出液体积;mL。
(4)泄漏曲线的绘制
上述条件下将栀子废液上柱吸附,每20 mL流出液收集一份,以每份流出液在238 nm波长处的吸光度值为纵坐标,以流出液编号为横坐标,绘制泄漏曲线。
1.3.3 动态洗脱实验
(1)不同体积分数乙醇对树脂的影响
分别用不同体积分数的乙醇对吸附饱和的树脂进行洗脱,每20 mL流出液收集一份,分别测定其在238 nm波长处的吸光度值A238nm,以流出液的编号为横坐标,以每份流出液在238 nm波长处的吸光度值为纵坐标,绘制不同体积分数乙醇洗脱曲线。
(2)不同流速对树脂洗脱的影响
以确定乙醇体积分数作为洗脱剂,分别采用不同的流速对栀子苷洗脱,实验步骤同上,绘制不同流速洗脱曲线。
(3)动态洗脱曲线的绘制
以确定上样液浓度,流速,吸附量条件下得到已经饱和树脂,再以上述确定洗脱流速,用2BV去离子水除去水溶性杂质,用确定乙醇体积分数进行洗脱,实验步骤同上,绘制动态洗脱曲线。收集同一吸收峰吸光度值高的各管洗脱液,分别合并,减压浓缩、真空干燥,测定栀子苷的含量。
1.3.4 栀子苷的浓缩与干燥
文言文教学固然存在或多或少的问题。如何认清问题的存在,很好地解决问题是当下急需重视的内容。只有解决好这些问题,才能更好地指导文言文教学实践。
(1)真空蒸发浓缩
使用旋转蒸发仪将精制后的栀子苷减压浓缩除去大量乙醇和部分水分。
(2)低温干燥
将浓缩后的栀子苷置于50 ℃干燥箱内24 h,得淡黄色粉末栀子苷。
1.3.5 栀子苷含量的测定
(1)标准曲线的制作
采用紫外分光光度法,精密称取栀子苷对照品5.1 mg,溶解于体积分数为95%乙醇中,定容于25 mL容量瓶中,精密移取0、0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL于10 mL容量瓶中,分别加体积分数为95%乙醇稀释定容至刻度,以体积分数为95%乙醇为空白,于238 nm波长处测定吸光度值A238nm,绘制标准曲线,得线性回归方程[12]。
(2)样品测定
2 结果与讨论
2.1 静态吸附树脂筛选实验
以不同树脂对栀子苷不同的吸附率和解吸率为标准,筛选对其吸附能力及解吸能力强的树脂,选择6种树脂进行实验,结果如表1所示。

表1 不同型号大孔吸附树脂对栀子苷的吸附解吸性能比较Table 1 Absorption and desorption performance of different types of macroporous resin for gardenoside
由表1可知,D1300树脂吸附率和解吸率均大于其他树脂,因此,在后续研究中确定D1300型大孔吸附树脂对栀子苷进行精制纯化。
2.2 动态吸附最佳条件的确定
2.2.1 不同流速对树脂吸附量的影响
分别以1.0 mL/min、1.5 mL/min、2.0 mL/min、2.5 mL/min、3.0 mL/min的流速进行动态吸附,流速对树脂吸附量的影响结果见图1。
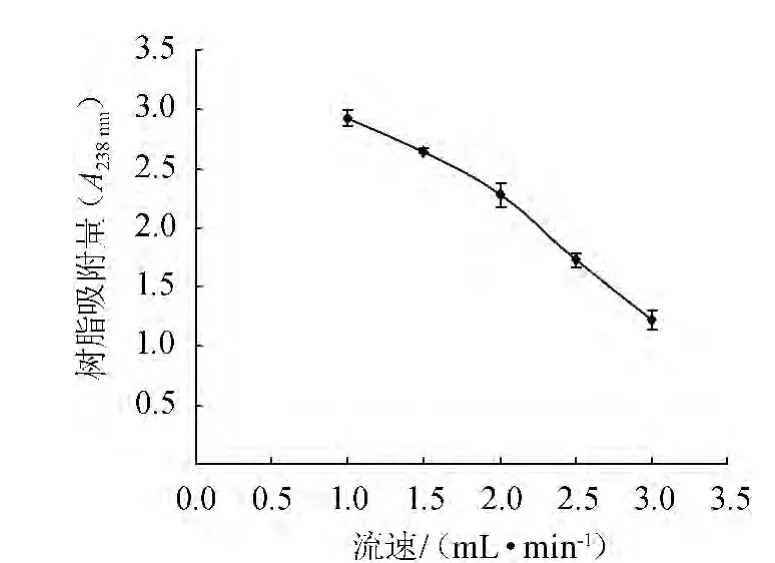
图1 流速对树脂吸附量的影响Fig.1 Effects of sample velocity on adsorption capacity
由图1可知,随着流速的增加,树脂吸附量逐渐降低,不利于树脂的吸附。虽然流速为1.0 mL/min时,树脂的吸附量最大,但是低流速会延长吸附时间,同时滞留在树脂中的杂质也会增多;而高流速下树脂吸附量下降太快,综合考虑,确定1.5 mL/min为最佳吸附流速。
2.2.2 上样液浓度对树脂吸附率的影响
以1.5mL/min为吸附流速,各取120 mL(3BV)不同浓度栀子苷废液(在238 nm处吸光度值分别为1.372 9、1.683 0、2.293 0、3.150 3上柱,上样液浓度对树脂吸附量的影响结果见图2。
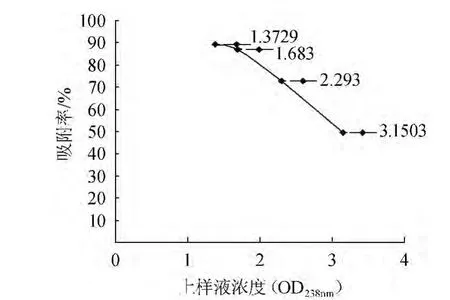
图2 上样液浓度对树脂吸附率的影响Fig.2 Effects of sample concentration on adsorption rate
由图2可知,栀子苷浓度越低越利于吸附,但是浓度过低,树脂吸附杂质越多,增加了分离难度。当栀子苷废液吸光度值A238nm=1.683时,树脂吸附率降低幅度不大,故选择栀子苷废液吸光度值A238nm=1.683作为最佳上样液浓度。
2.2.3 吸附泄漏曲线的制作
以1.5 mL/min为吸附流速,以栀子苷废液吸光度值A238nm=1.683为样液浓度上柱吸附,每20 mL流出液收集一份,以每份流出液在238 nm波长处的吸光度值为纵坐标,以流出液编号为横坐标,吸附泄漏曲线见图3。

图3 栀子苷的吸附泄露曲线Fig.3 Leakage adsorption curve of geniposide
由图3可知,当收集到第12份时,栀子苷开始泄露,所以栀子苷废液(A238nm=1.683)的饱和吸附容量为12×20 mL,即12 BV(树脂柱体积为20 mL)。
2.3 最佳洗脱条件的确定
2.3.1 不同体积分数乙醇对树脂洗脱的影响
不同体积分数乙醇对树脂洗脱的影响结果见图4。
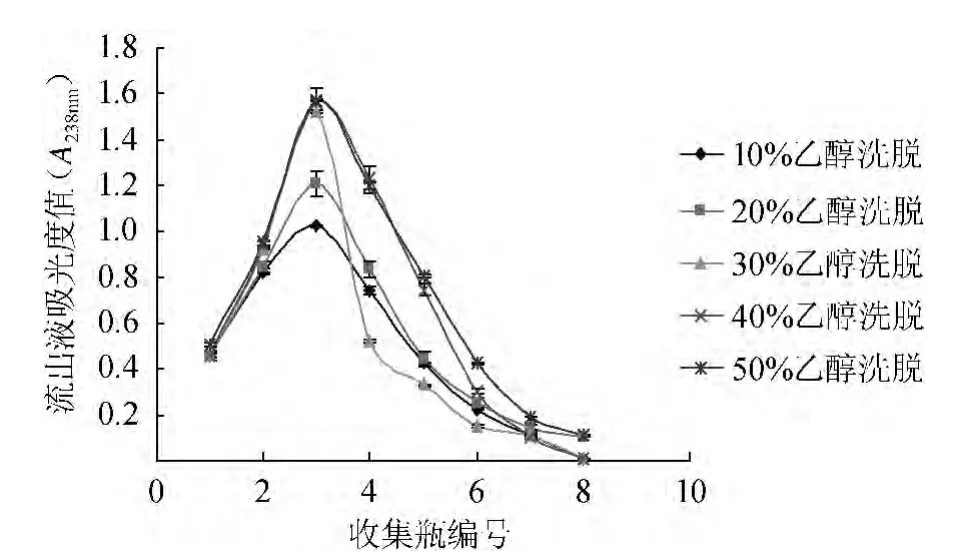
图4 洗脱剂乙醇体积分数对洗脱率的影响Fig.4 Effect of ethanol concentration on elution rate
由图4可知,体积分数为40%、50%乙醇洗脱效果最好,体积分数为30%乙醇其次,体积分数为10%、20%乙醇洗脱效果最差。但是乙醇体积分数过高,会将栀子废液中的栀子色素洗脱下来[13-15],且体积分数为40%,50%乙醇洗脱时存在拖尾现象,而体积分数为30%乙醇洗脱曲线窄,不存在拖尾现象,故选择体积分数为30%乙醇作为洗脱剂。
2.3.2 不同流速对树脂洗脱的影响
以体积分数30%的乙醇作洗脱剂,分别以1.0 mL/min、1.5 mL/min、2.0 mL/min、2.5 mL/min、3.0 mL/min的流速进行动态洗脱实验。流速对树脂洗脱的影响结果见图5。
由图5可知,低流速有利于栀子苷的洗脱,但低流速洗脱时所花时间也越长,同时增加了洗脱液中的杂质;流速过高,洗脱剂与树脂接触不完全,洗脱效果差,综合考虑,选择2 mL/min为最适洗脱速率。
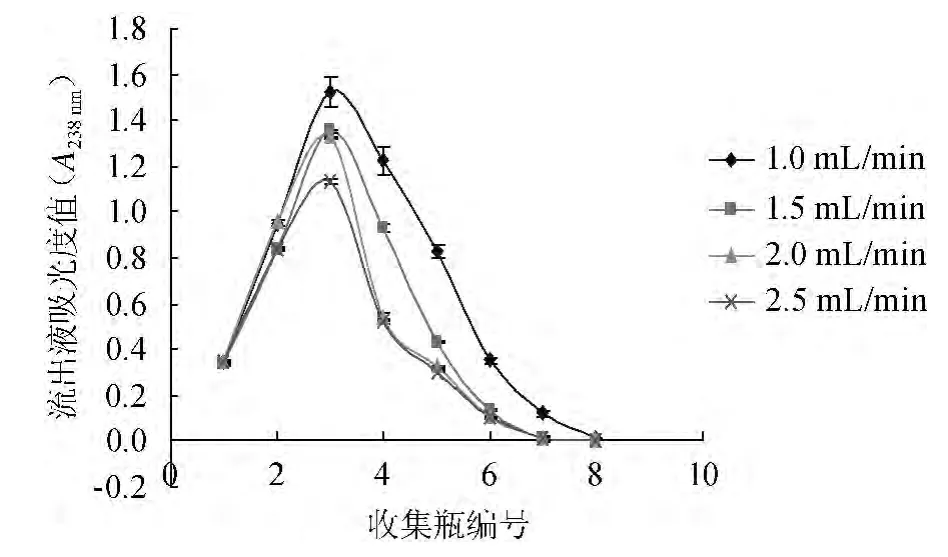
图5 洗脱流速对洗脱率的影响Fig.5 Effect of elution rate on elution rate
2.3.3 动态洗脱曲线的绘制
以1.5 mL/min为吸附流速,以栀子苷废液吸光度值A238nm=1.683为样液浓度上柱吸附,得到饱和树脂;再以2 mL/min洗脱流速,用2BV去离子水除去水溶性杂质,用体积分数30%乙醇进行洗脱,动态洗脱曲线见图6。
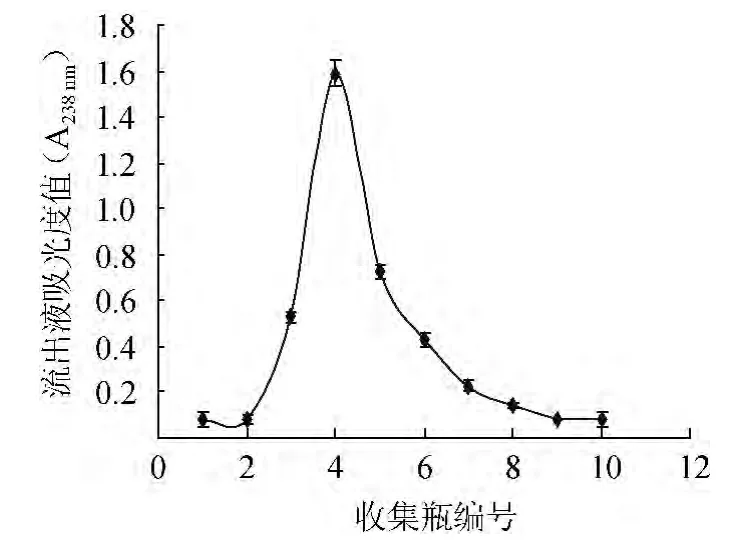
图6 动态洗脱曲线Fig.6 Dynamic elution curve
由图6可知,栀子苷洗脱高峰相对集中,体积分数为30%乙醇2.5~6.5 BV时,栀子苷含量最高,当洗脱液>7.0 BV时,栀子苷含量明显减少。收集体积分数为30%乙醇2.5~6.5 BV洗脱液,减压浓缩,真空干燥,得到精制栀子苷。
2.4 栀子苷含量的测定
2.4.1 标准曲线的制作
采用紫外分光光度法,于238 nm 波长处测定吸光度值绘制标准曲线,得线性回归方程y=9.670 4x+0.038 9,相关系数R2=0.990 6,表明线性关系良好。
2.4.2 样品测定
精密称取5.1 mg干燥的样品(经大孔树脂吸附、洗脱、浓缩、干燥后的栀子苷粉末),置于25 mL量瓶中,用体积分数为95%乙醇溶解,并定容到25 mL容量瓶中,精确吸取1 mL于10 mL容量瓶中,加体积分数为95%乙醇定容至刻度,以体积分数为95%乙醇作为空白,于238 nm波长处测吸光度值为0.436 5,计算得到栀子苷粉末中栀子苷含量为82.23%。
3 结论
根据以上研究和分析,确定栀子苷精制树脂的最佳条件:大孔吸附树脂选择D1300,上样液栀子苷废液的吸光度值A238nm为1.683 0,吸附流速为1.5 mL/min,吸附饱和量为12BV,洗脱流速为2 mL/min,梯度洗脱,2BV水洗,4BV体积分数为30%乙醇洗脱。收集体积分数为30%乙醇洗脱液,浓缩干燥后得到纯度为82.23%的固态栀子苷产品。该实验方法简单,材料便宜,产品纯度比较高,适合工业化生产。大孔树脂吸附纯化的工艺参数较多,如样液上柱前的净化方法、树脂径高比等有待进一步研究。
[1]杨 宇,杨 光,曾完阳.栀子苷镇痛作用及其机制初步研究[J].武警医学,2013,24(3):218-223.
[2]郭曙军,赵志英.栀子苷的药理作用及其作用机制研究进展[J].包头医学院学报,2013,29(2):111-113.
[3]张立明,何开泽,任治军,等.栀子中京尼平苷对Cc14 急性小鼠肝损伤保护作用的生化机理研究[J].应用与环境微生物学报,2005,11(6):669-672.
[4]朱文佩,刘丽华,李克和,等.栀子果实成熟度对栀子苷含量积累的影响[J].中国野生植物资源,2012,31(4):23-24.
[5]谢学建.中药栀子研究进展[J].时珍国医国药,2000,11(10):93-94.
[6]沈荣光,陈正行.栀子中栀子苷的分离纯化[J].食品工业科技,2006,27(4):123-127.
[7]涂盛辉,邱俊明,邱祖民,等.大孔吸附树脂精制中药栀子中栀子苷的研究[J].南昌大学学报:工科版,2007,29(4):307-310.
[8]董 磊,刘帅英,陈 波.大孔吸附树脂对栀子苷精制纯化的研究[J].河南大学学报:医学版,2006,25(4):27-29.
[9]金日显,郭春燕,刘淑芝,等.大孔吸附树脂法富集栀子中栀子苷的工艺研究[J].中国实验方剂学杂志,2005,11(3):1-2.
[10]王志超,杨小龙,张 珂,等.栀子苷药理作用的研究进展[J].河南科技大学学报,2012,30(2):159-160.
[11]李文琪,赵新民.栀子苷的精制工艺研究[J].安徽医药,2005,9(9):647-648.
[12]刘 钢,张 平,夏 泉,等.正交试验法优选栀子苷的提取工艺研究[J].海峡药学,2013,25(11):21-23.
[13]景艳艳,李世杰,蒋 威,等.栀子黄色素的精制及栀子蓝色素的转化[J].化学与生物工程,2012,29(12):68-71.
[14]林 璐,钮旭升,田立权.栀子中栀子苷提取纯化工艺研究[J].中医药学报,2009,37(6):74-76.
[15]钟振声,潘锦秀,陈砚楷.高色价栀子黄色素的精制[J].精细化工,2007,24(6):581-583.

