桦黄多糖提取工艺及抗氧化性研究
张丽华,刘 盼,赵 鹏 *,杜永鹏
(1.陕西中医学院 药学院,陕西 咸阳 712046;2.陕西丽彩集团咸阳丽彩医药有限公司,陕西 咸阳 712000)
桦黄是多孔菌科滴孔菌属植物桦滴孔菌Piptoporus betulinus(Bull.ex.fr)Karst的子实体[1],具有消积、化疲、抗癌的功效,主要用于治疗小儿食积、食管癌、胃癌、子宫癌、等。桦黄主要生长在海拔2 300 m以上病害的桦树上,在秦岭南北坡上均有发现,系陕西民间习用药材。外观为不规则块状物或呈瘤状,无柄,表面有不规则的沟痕及深裂,断面黄色。桦黄中主要含游离糖、糖醇、有机酸、甾醇等,药理研究其具有一定的抗肿瘤活性[2-3]。多糖是中药材中普遍存在的活性成分,具有免疫调节、抗肿瘤、降血糖血脂、抗衰老等药理作用[4-6],在保健食品和医药应用等方面具有很广的开发应用价值。该试验优化桦黄多糖的提取工艺,以便更好地开发和利用这一药用资源,并初步研究了桦黄多糖的抗氧化性质。
1 材料与方法
1.1 材料与试剂
无水乙醇、乙醚、丙酮、浓硫酸、苯酚均为分析纯:天津科密欧化学试剂开发中心。
桦黄采自陕西省秦岭山,经陕西中医学院药学院宋逍副教授鉴定为桦黄中药材。
1.2 仪器与设备
4K15台式离心机:美国Sigma公司;UV-2501PC紫外可见分光光度仪:日本岛津公司;RE-6000旋转蒸发仪:上海亚荣仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市予华仪器有限责任公司。
1.3 方法
1.3.1 桦黄多糖的提取工艺流程
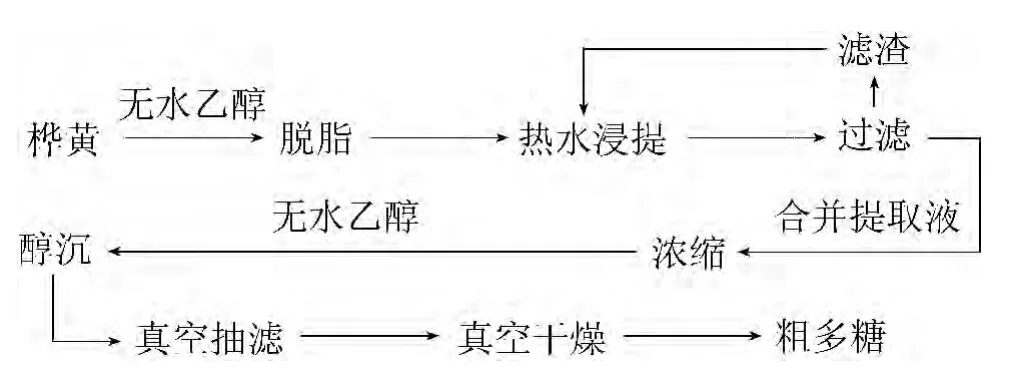
图1 桦黄多糖提取工艺流程Fig.1 Polysaccharide extraction process from P.betulinus
将桦黄药材干燥至质量恒定,粉碎,过60目筛。准确称取桦黄粉5 g,然后将其用无水乙醇进行脱脂处理,按一定料液比加入水加热提取,提取多次,合并提取液,抽滤、离心分离。滤液按生药体积比1∶1浓缩后,加无水乙醇醇沉,静置过夜,真空抽滤,真空干燥,可得桦黄粗多糖[7]。
1.3.2 提取工艺条件的选择
采用单因素试验法优化最佳提取工艺[8]。在提取桦黄多糖试验中,影响产品收率的因素很多,通过前期试验考察得出温度、时间、液料比、提取次数等对多糖提取率的影响较大。
(1)提取温度的选择
准确称量粉碎好的桦黄,平行称取5份,在液料比为10∶1(mL∶g),时间1 h,重复提取2次,在50 ℃、60 ℃、70 ℃、80 ℃、90 ℃不同温度条件下进行桦黄多糖提取试验,提取液合并后浓缩,浓缩液再用5倍体积无水乙醇醇沉,研究不同的提取温度对多糖提取率的影响。
(2)提取时间的选择
准确称量粉碎好的桦黄,平行称取5份,在液料比为10∶1(mL∶g),温度为80 ℃,重复提取2次,在60 min、75 min、90 min、105 min、120 min不同时间条件下进行桦黄多糖提取试验,提取液合并后浓缩,浓缩液再用5倍体积无水乙醇醇沉,研究不同的提取时间对多糖提取率的影响。
(3)液料比的选择
准确称量粉碎好的桦黄,平行称取5份,在温度为80 ℃,提取时间105 min,重复提取2次,在9∶1、10∶1、11∶1、12∶1、13∶1(mL∶g)不同液料比条件下进行桦黄多糖提取试验,提取液合并后浓缩,浓缩液再用5倍体积无水乙醇醇沉,研究不同的液料比对多糖提取率的影响。
(4)提取次数的选择
准确称量粉碎好的桦黄,平行称取5份,在温度为80 ℃,提取时间105 min,液料比16∶1(mL∶g),在1、2、3、4、5不同提取次数条件下进行桦黄多糖提取试验,提取液浓缩,浓缩液再用5倍体积无水乙醇醇沉,研究不同的提取次数对多糖提取率的影响。
1.3.3 桦黄多糖含量及提取率计算
(1)多糖含量的测定
按照文献[9-11]报道,多糖含量的测定应用苯酚-硫酸法,以葡萄糖为标准品,绘制标准曲线为:A=1.033 8C+0.020 5,R2=0.999 2。质量浓度范围在0.08~1.00 mg/mL范围内,线性关系良好。
(2)多糖提取率计算
准确称量粗多糖,配制溶液,依照苯酚硫酸显色方法显色,测量吸光度值,计算多糖提取率。

1.3.4 桦黄多糖对DPPH·的清除作用[12]
DPPH·是一种稳定的自由基,其乙醇溶液呈紫色,在可见光区最大吸收峰为517 nm,当DPPH·溶液中加入自由基清除剂后,DPPH·溶液颜色变浅,可以用于评价自由基清除剂清除自由基的能力,DPPH·清除率计算公式:

式中:A空白为1.0 mL DPPH·溶液+1.0 mL 无水乙醇吸光度值;A样品为1.0 mL多糖溶液+1.0 mL DPPH·溶液吸光度值;A对照为1.0 mL多糖溶液+1.0 mL无水乙醇溶液吸光度值。
配制1×10-4mol/L的DPPH溶液,配制不同质量浓度多糖溶液,分别吸取待测多糖溶液1.0 mL,加入DPPH·溶液1.0 mL,混合均匀,在暗处放置30 min。以无水乙醇为空白,测定波长517 nm处的吸光度值,得到A样品。按上述要求再分别测得A空白和A对照,带入式(2)中,计算不同质量浓度条件下桦黄多糖对DPPH·的清除率。
2 结果分析
2.1 单因素试验结果
2.1.1 温度对多糖提取率的影响
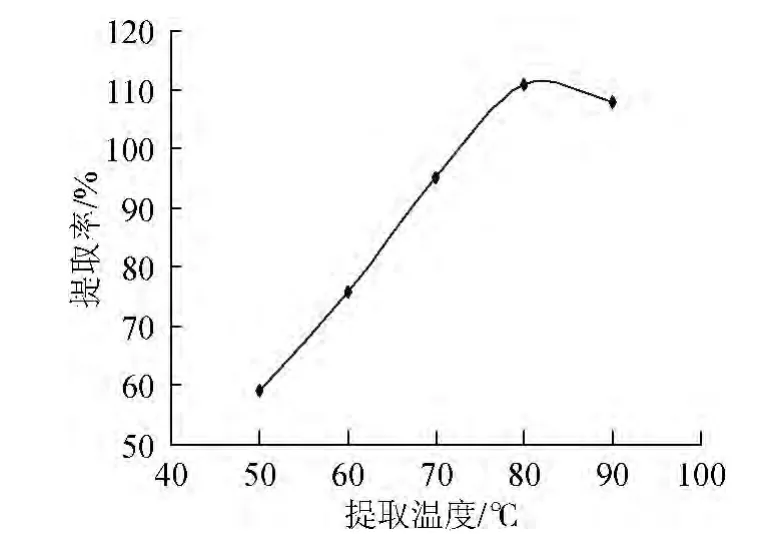
图2 温度对桦黄多糖提取率的影响Fig.2 Effect of temperature on P.betulinus polysaccharide extraction rate
图2表明,当操作温度<80 ℃时,多糖的提取率快速增加,当提取温度>80 ℃时,提取率逐渐呈下降趋势,因此确定最佳提取温度为80 ℃。
2.1.2 提取时间对多糖提取率的影响
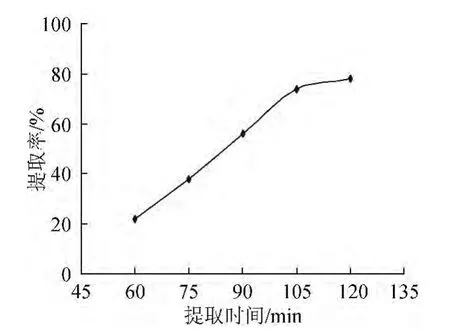
图3 时间对桦黄多糖提取率的影响Fig.3 Effect of time on P.betulinus polysaccharide extraction rate
图3表明,当提取时间在60~105 min之间时,多糖的提取率快速增大,>105 min则改变不大,此时多糖的提取率随着时间的增加变化很小,因此选择提取时间为105 min。
2.1.3 液料比对多糖提取率的影响
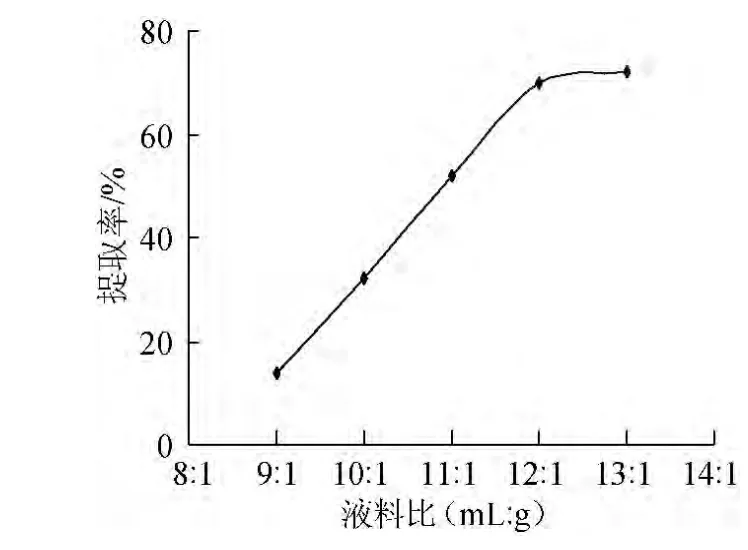
图4 液料比对桦黄多糖提取率的影响Fig.4 Effect of liquid solid ratio on P.betulinus polysaccharide extraction rate
图4表明,液料比在达到12∶1(mL∶g)之前,多糖提取率增幅较大,超过12∶1(mL∶g)之后则变化不大,此时绝大部分多糖已经被溶出,因此选择液料比为12∶1(mL∶g)左右。
2.1.4 提取次数对多糖提取率的影响
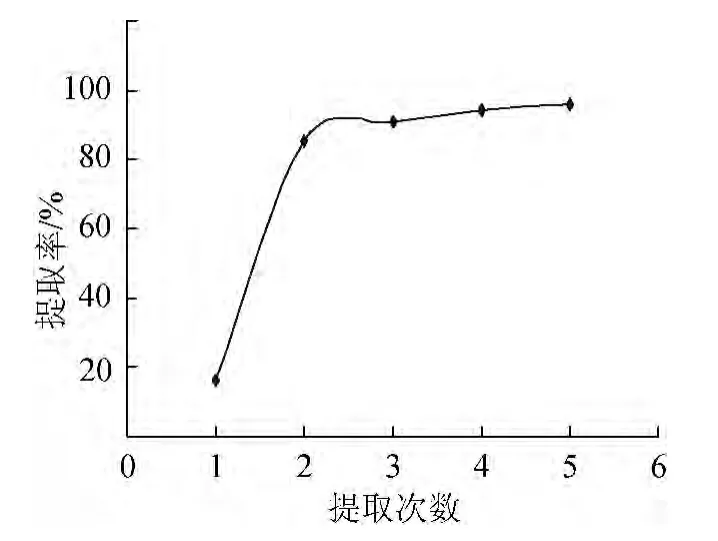
图5 提取次数对桦黄多糖提取率的影响Fig.5 Effect of extraction times on P.betulinus polysaccharide extraction rate
图5表明,提取次数>2次时,多糖提取率曲线变化趋势已趋于平缓,为了减少后期浓缩的困难以及从节约能源的角度考虑,选择提取次数2次较为理想。
2.2 最优提取工艺条件
单因素优化试验确定水提法提取桦黄多糖的最优提取工艺为水液比12∶1,温度80 ℃,时间105 min,提取2次。按照此工艺重复操作3次,提取的桦黄多糖的平均含量为65 mg/g。
2.3 桦黄多糖的抗氧化性研究
如图6所示,桦黄多糖对DPPH·的清除率随着质量浓度的增加,清除率呈上升趋势,在4.5 mg/mL时达到最大,为92.02%。多糖质量浓度继续增大对DPPH·的清除率基本变化不大,说明桦黄多糖对DPPH·具有一定的清除性,并且随着多糖质量浓度增加,抗氧化性增强。桦黄多糖具有一定的抗氧化性,需要进一步深入研究。
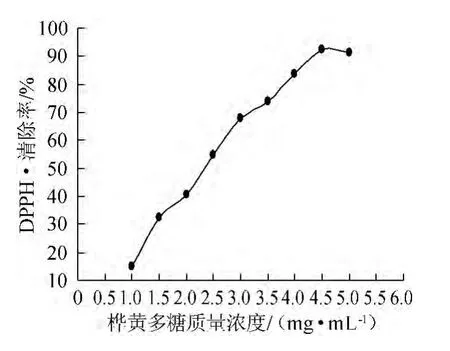
图6 不同质量浓度的桦黄多糖对清除DPPH影响Fig.6 Effect of different concentration of P.betulinus polysaccharide on DPPH scavenging activity
3 结论
对桦黄多糖的提取工艺进行了优化研究,最终得到了桦黄多糖提取最佳工艺为提取温度80 ℃,提取时间105 min,液料比12∶1(mL∶g),提取2次。在此工艺条件下,重复操作,桦黄多糖的平均含量为65 mg/g;对桦黄多糖进行了抗氧化性研究,结果表明,桦黄多糖对自由基DPPH·具有一定的清除作用。本研究结果对桦黄多糖分离纯化以及结构解析、药理活性等进一步研究具有一定的参考价值。
[1]赵继鼎,徐连旺,张小青.中国多孔菌科分类系统的研究[J].微生物学报,1982,22(3):218-232.
[2]乔蓉霞,张国跃,郭耀武,等.桦黄质量标准研究[J].中国医药导刊,2011,13(8):1450-1451.
[3]国家药典委员会.中华人民共和国药典(2010 年版.一部)[M].北京:化学工业出版社,2010.
[4]丁宝金,金丽琴,吕建新.多糖的生物活性研究进展[J].中国药学杂志,2004,39(8):561-569.
[5]郭天力,严晓娟,胡先望,等.真菌多糖研究进展[J].现代生物医学进展,2013,13(18):3578-3583.
[6]翁 梁,温 鲁.药用真菌多糖研究进展[J].食品科学,2008,29(12):748-751.
[7]林 晓,潘文嘉.灵芝多糖抗皮肤衰老作用研究[J].辽宁中医药大学学报,2009,11(9):174-175.
[8]苗元振,张红燕,薛宏伟,等.食药用真菌多糖抗氧化作用研究进展[J].生物技术通报(增刊),2008(S1):30-33.
[9]贾亮亮,袁 丁,何毓敏,等.多糖提取分离及含量测定的研究进展[J].食品研究与开发,2011,32(3):189-192.
[10]王永斌,王允祥.雷蘑胞外多糖分离提取工艺优化研究[J].中国酿造,2007,26(5):32-37.
[11]马 莺,王 静,牛天骄.功能性食品活性成分测定[M].北京:化学工业出版社,2005.
[12]刘源才,孙细珍,许 银.枸杞多糖组成及含量测定方法的改进[J].食品科学,2013,34(12):292-295.
[13]赵丰丽,张云鸽,宁良丹,等.红菇多糖的提取分离及其抗氧化活性的研究[J].中国酿造,2009,28(11):98-101.
[14]侯秀娟,沈勇根,徐明生,等.化橘红多糖的提取纯化及抗氧化活性研究[J].中国酿造,2012,31(9):135-138.
[15]俞慧红,竺巧玲,戴 飞,等.多糖抗氧化作用的研究现状[J].食品研究与开发,2008,29(3):172-176.

