紫草素诱导人肝癌肝细胞程序性死亡及其分子机制的研究
刘仁同,魏春佩,刘素侠
(1.滨州医学院附属医院血液内科,山东滨州256600;2.滨州医学院附属医院检验科,山东滨州256600;3.山东大学医学系,山东济南250100)
紫草素诱导人肝癌肝细胞程序性死亡及其分子机制的研究
刘仁同1,魏春佩2,刘素侠3
(1.滨州医学院附属医院血液内科,山东滨州256600;2.滨州医学院附属医院检验科,山东滨州256600;3.山东大学医学系,山东济南250100)
目的探讨紫草素在体内、体外的抗肝癌活性及其可能机制。方法采用Annexin-V FITC/PI双染法检测3种肝癌细胞的细胞凋亡情况,LC3转换法(LC3 Conversion)检测细胞自噬数量,Western blot检测相关凋亡蛋白和自噬标志蛋白的表达,激光共聚焦观察线粒体自噬情况。结果紫草素对3种肝癌细胞均具有杀伤作用,且呈浓度依赖性和时间依赖性,Western blot检测细胞凋亡标志蛋白以及Annexin-V FITC/PI双染检测结果表明,较高浓度紫草素(6~8μM)处理24 h可有效诱导肝癌细胞凋亡。Caspase广谱抑制剂z-VAD预处理细胞可阻止紫草素诱导的肝癌细胞凋亡,紫草素诱导的细胞凋亡依赖于Caspase蛋白的剪切。另一方面,较低浓度紫草素(≤2.5μM)处理肝癌细胞12 h能诱导细胞自噬产生。LC3转换检测、GFP-LC3荧光点聚集和吖啶橙染色自噬泡证明了紫草素能促进细胞自噬的产生;细胞自噬早期抑制剂3-MA能有效阻断紫草素诱导的细胞自噬;LC3周转和p62降解则从动态上证明了自噬潮的产生,激光共聚焦结果紫草素诱导的细胞自噬有线粒体自噬的成分,说明紫草素对线粒体有损伤。结论紫草素能在体外能诱导肝癌细胞发生细胞凋亡和细胞自噬。
紫草素;人肝癌;分子机制;细胞凋亡;细胞自噬
癌症是人类健康的重大杀手,中国是肝癌的高发区。然而肝癌的治疗手段并不乐观,手术切除限制条件很多,肿瘤过大或已转移均不能通过切除治愈。化疗成为肝癌治疗重要手法,但目前已批准的化疗药物很少,只有索拉芬尼一种。寻找新型肝癌治疗药物意义重大。近年的研究报道表明,紫草素具有明显的抗肿瘤活性,能够抑制多种肿瘤细胞的生长并诱导死亡。紫草素能通过激活Caspase途径诱导一系列肿瘤细胞系凋亡性细胞死亡,如恶性黑素瘤细胞A375-S2,宫颈癌细胞Hela,结肠癌细胞COLO205,膀胱癌细胞T24,舌鳞癌细胞Tca-8113,慢性髓系白血病细胞K562及U937等[1-4],紫草素的作用机制还包括在U937细胞中抑制抗细胞凋亡的BCL-2蛋白表达进而触发细胞凋亡,在Tca-8113细胞中通过失活NF-κB与BCL-2抑制细胞增殖[5-6]。此外,还有报道表明紫草素能激活K562细胞的ROSJNK途径以诱导细胞凋亡、抑制前列腺癌PC3细胞蛋白酶体活性以及拓扑异构酶活性而抑制肿瘤[7-8]。本论文拟解决以下几个方面的问题,首先确认紫草素诱导肝癌细胞凋亡的能力,而后对其分子机制进行了深入研究,以期确认部分信号通路的调控过程,最后对其可能存在的其他死亡方式进行研究,尤其Ⅱ型细胞程序性死亡,即细胞自噬,并探索机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞系和菌株:人肝细胞肝癌细胞系:BEL7402,Huh7,HepG2;人永生化肝细胞系:L02;人胚肾细胞系:HEK293T;小鼠腹水型肝癌细胞系:H22;小鼠成纤维细胞系MEF,MEF ATG7-/-(ATG7基因双敲除)。
1.1.2 实验动物:BALB/c小鼠购自湖北省疾病预防与控制中心,合格证号SCXK(鄂)2010-0001;细胞凋亡实验部分的BALB/c-nude裸鼠购自南京大学模式动物研究,合格证号UVM(苏)2012-0035;细胞自噬实验部分的BALB/c-nude裸鼠购自湖南斯莱克景达实验动物有限公司,合格证号SSBK(湘)2010-0001。所有实验动物均为SPF级。
1.1.3 试剂与仪器:细胞试验用紫草素购自Enzo公司,纯度≥98%,动物实验用紫草素购自上海融禾公司,纯度≥98%;PBS缓冲液、青链霉素双抗、0.05%胰酶、胎牛血清(FBS)购自Hyclone公司;DMEM培养基干粉、RPMI-1640培养基干粉购自Gibco公司;瓶顶滤器购自Millipo公司或Nalgen公司;细胞冻存管购自Corning公司,DMSO购自Sigma公司;二氧化碳购自武汉翔云气体厂;刻度移液管购自天津玻璃厂;60 mm、100 mm细胞培养皿,6、12、24、48、96孔细胞培养微孔板购自无锡NEST公司、Corning公司;96孔酶标板、黑色荧光酶标板购自Corning公司。质粒小提试剂盒购自Omega公司;限制性内切酶及酶切缓冲液、6×核酸电泳上样缓冲液购自Takara公司;T4连接酶及其缓冲液购自Invitrogen公司;胶回收试剂盒购自天津天根公司;转染试剂Fugene、TUNEL试剂盒、蛋白酶抑制剂cocktail购自罗氏公司;转染试剂速尔是武汉敏行公司产品;AnnexinV-PI双染试剂盒购自Bipec公司;双荧光素酶报告基因试剂盒购自Promega公司;MitoTracker Red线粒体探针、C-400活性氧自由基探针购自Invitrogen公司;谷丙转氨酶活性检测试剂盒购自南京建成公司。
-80℃超低温冰箱、低温超速离心机,Thermo;4℃/-20℃冰箱,海尔、美的;水平电泳槽、电泳电源,君意;凝胶成像系统,SYNGENE;紫外透射仪、微量掌上型离心机,鹏鑫;垂直电泳槽,天能;半干转膜仪,Bio-Rad;洗片机,苏星;灭菌锅,TOMY;荧光倒置光学显微镜、荧光正置光学显微镜、激光共聚焦显微镜,Olympus;透射电子显微镜,Hitachi;离心机,Thermo、Eppendorf。
1.2 实验方法
1.2.1 细胞培养:将细胞冻存管从液氮罐中取出,迅速置于37℃水浴锅中,同时不断摇动冻存罐使受热均匀,3min内快速解冻。75%医用酒精消毒冻存管表面,在生物安全柜中打开管盖,用移液器将含细胞的冻存液轻轻吹打混匀并转移到细胞培养皿中,补充10 mL与该细胞培养对应的DMEM或RPMI-1640培养基。将培养皿置于37℃,含5%的CO2细胞培养箱中。约6h后,光学显微镜下观察细胞。若细胞大部分贴壁,则更换新鲜培养基以避免冻存液中的DMSO对细胞的伤害;若贴壁细胞不多,则继续培养,至观察到多数细胞贴壁时更换新鲜培养基。细胞用含有10%胎牛血清(FBS)及1%青链霉素(P/S)的液体培养基培养,BEL7402、Huh7、HepG2、HEK293T、MEF细胞系的液体培养基选用DMEM;L02、H22细胞系的液体培养基选用RPMI-1640。100 mm培养皿中通常液体培养基体积为10m L。
1.2.2 细胞凋亡检测:Annexin-V FITC/PI双染法检测:①胰酶消化细胞,转移到干净离心管;②1 500 r/min,5min离心,弃去上清培养基,加入1mL PBS重悬细胞,转移到EP管;③1500 r/min,5min离心,弃去PBS,加入约200μL PBS重悬细胞;④加入5μL异硫氰酸荧光素标记的膜联蛋白V(AnnexinV-FITC),室温避光染色10min;⑤加入10μL碘化丙啶(PI),转移至流式管,检测前4℃保存;⑥流式细胞仪检测,Annexin-V FITC用FL1通道检测、PI用FL2通道检测;⑦流式软件分析数据并作图。
1.2.3 细胞自噬检测:LC3转换法(LC3 Conversion)Western blot检测LC3-II的表达量,反映自噬体生成数量。
GFP-LC3荧光点聚集实验:自噬体形成时,自噬体膜上的脑磷脂(PE)将招募游离于胞质的LC3-I并与之结合形成LC-II。利用这一特性,外源转染带GFP标签的LC3融合蛋白(GFPLC3),可指示LC3的转位。BEL7402、Huh7、HepG2、HEK293T、MEF、L02、H22细胞系细胞种植于12孔板内的细胞爬片上,适量GFP-LC3质粒转染24h后,加入10μmol/L紫草素刺激。加1滴荧光封片液(抗荧光淬灭剂:DAPI染液=7:3)于载玻片上,细胞爬片的细胞面朝下覆盖液滴,正置荧光显微镜下观察。每个玻片计数至少100个转染成功的细胞,计算其中具有超过5个荧光聚集点的细胞的比例,指示细胞自噬的程度。
2 结果
2.1 紫草素诱导肝癌细胞凋亡
2.1.1 紫草素对肝癌细胞的杀伤作用:随着紫草素使用浓度的升高,肝癌细胞的存活率显著下降,并呈浓度梯度效应。3种肝癌细胞系中,Huh7对紫草素最为敏感,8μM的紫草素处理24 h后,细胞活力仅剩20%左右,BEL7402次之,存活率约为40%,而HepG2则对紫草素相对不敏感,处理后仍有超过60%的细胞存活。经过Excel软件对浓度-效应曲线进行拟合计算,紫草素处理24 h对3种肝癌细胞系的半数抑制浓度(IC50)分别为:(4.0±0.4)μM(Huh7),(5.3±0.1)μM(BEL7402),(8.3± 0.3)μM(HepG2)。随着作用时间的延长(0、4、8、12、16、24、48 h),4μM及8μM紫草素处理下的BEL7402细胞和Huh7细胞的存活率也随之逐渐下降。综合来看紫草素能有效杀伤肝癌细胞,且具有浓度和时间依赖效应(见图1)。

图1 紫草素对肝癌细胞系杀伤作用Fig.1 Shikonin killing effect on HCC cell lines
2.1.2 紫草素诱导肝癌细胞CASPASE依赖的细胞凋亡:如图2所示,3种肝癌细胞系BEL7402、HepG2和Huh7与溶剂DMSO处理组一起用Annexin-V FITC/PI染色,而后用流式细胞仪对处于细胞凋亡各时期的细胞进行归类鉴定,可以看到,随着紫草素浓度的升高和处理时间的延长,Annexin-V阳性的细胞数也随之增多。
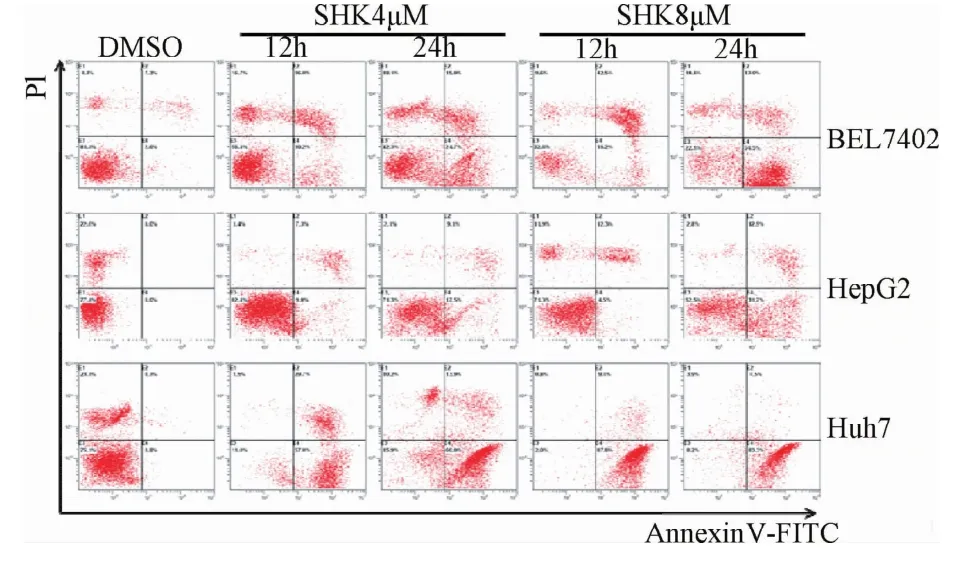
图2 紫草素诱导肝癌细胞凋亡的流式细胞术检测Fig.2 Flow cytometric detection of shikonin-induced apoptosis of hepatocellular carcinoma cells
这里将Annexin-V阳性的细胞定义为发生凋亡的细胞,紫草素处理后的肝癌细胞均发生了细胞凋亡,且Huh7细胞系最为敏感,BEL7402次之,HepG2较不敏感。利用Western blot检测了这些细胞凋亡的标志性蛋白水平。结果发现随着紫草素浓度的升高,在4~8μM的浓度范围,这些分子均发生了明显的剪切(见图3A)。紫草素诱导的细胞凋亡蛋白剪切不仅具有浓度依赖效应,而且具有时间依赖效应(图3B)。由结果可知从12 h起,这些细胞凋亡相关的蛋白就已发生剪切了。这从分子水平表明紫草素能诱导肝癌细胞发生凋亡。
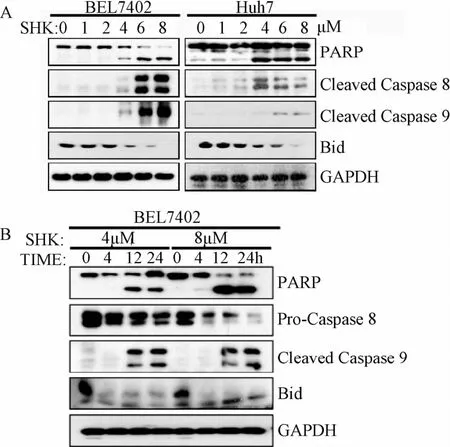
图3 Western blot分析检测凋亡相关蛋白的剪切情况Fig.3 Western blot analysis of shear the apoptosis related protein detection
为了进一步验证紫草素诱导的肝癌细胞凋亡是否依赖于CASPASE的剪切,利用Caspase的广谱抑制剂Z-VAD-fmk 50μM预处理1 h后,再用6μM紫草素刺激肝癌细胞24 h,而后测量细胞存活率。结果发现,Caspase的广谱抑制剂Z-VAD-fmk几乎能完全拯救紫草素对肝癌细胞的杀伤作用,这说明紫草素诱导的细胞凋亡是依赖于Caspase的剪切活性而完成的(见图4)。
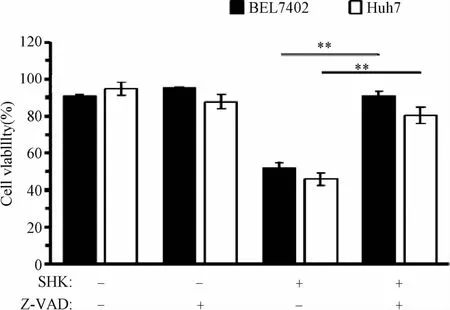
图4 Caspase广谱抑制剂Z-VAD-fmk预处理对紫草素杀伤作用的拯救Fig.4 Save grain killing effect of caspase broad-spectrum inhibitor Z-VAD-fmk pretreatment on shikonin
2.1.3 紫草素对细胞凋亡调控分子的影响:利用Western blot检测抑制外源性凋亡的c-FLIP(L)(长链型)、抑制内源性凋亡的BCL-2家族分子BCL-2、BCL-XL和MCL-1。结果发现紫草素处理能够下调c-FLIP(L)和BCL-2分子,然而BCL-XL分子表达量并未发生变化。令人意外的是,抑制内源性凋亡的MCL-1分子在紫草素诱导细胞凋亡后发生了上调(见图5)。这些结果表明,抑制细胞凋亡的c-FLIP(L)和BCL-2分子在紫草素处理后的下调可能参与了紫草素诱导的肝癌细胞凋亡,对MCL-1的上调还需要更深入的研究。
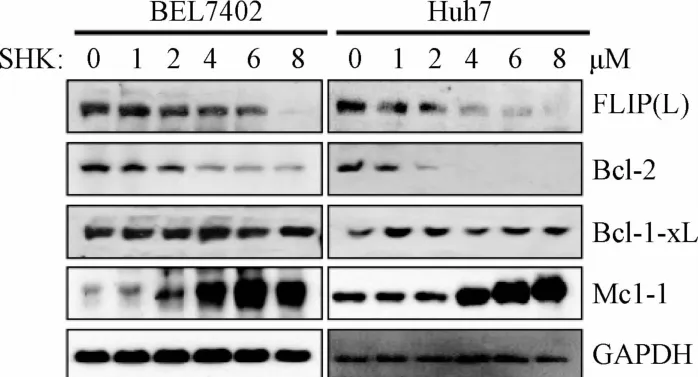
图5 紫草素刺激对细胞凋亡相关调控分子的影响Fig.5 Effect of shikonin on cell apoptosis related molecules
2.2 紫草素诱导肝癌细胞自噬
2.2.1 紫草素诱导细胞自噬的浓度、时间梯度及最佳条件:用0、1、2、3、4、5μM紫草素处理BEL7402和Huh7细胞24 h,而后用Western blot分析,如图3所示,细胞凋亡标志性蛋白PARP的剪切在3μM以下的紫草素刺激中并未触发,而细胞自噬启动的标志性蛋白LC3-II的表达水平在0~2μM的紫草素刺激中逐渐增强,2μM左右达到峰值,从3μM开始LC-II的量反而下降,而浓度高于3μM的紫草素处理细胞则导致PARP被剪切。这些实验初步说明,紫草素能够诱导肝癌细胞发生细胞自噬,其标志性蛋白LC3-II的表达量在0~5μM这个浓度范围先增强后减弱,到达自噬体形成峰值后的减弱同时伴随着细胞凋亡起始发生。
鉴于紫草素浓度太低(小于1μM)或太高(大于3μM)时,LC3-II的表达量都偏低。为研究紫草素诱导细胞自噬的最佳时间,用2μM紫草素处理肝癌细胞不同时间后,Western blot检测LC3-II的含量,如图6所示,随着处理时间的延长,LC3-II含量逐渐升高,12 h达到峰值,12 h过后LC3-II含量反而下降,这说明12 h的紫草素刺激时间是检测紫草素诱导肝癌细胞自噬的最佳时间。同时用Western blot检测PARP和CASPASE 8的剪切情况,发现在2μM紫草素刺激条件下,24 h内的任何时间点都没有观察到这些细胞凋亡蛋白发生剪切,也就是说在2μM紫草素处理12 h的细胞自噬诱导条件下,不会触发细胞凋亡。
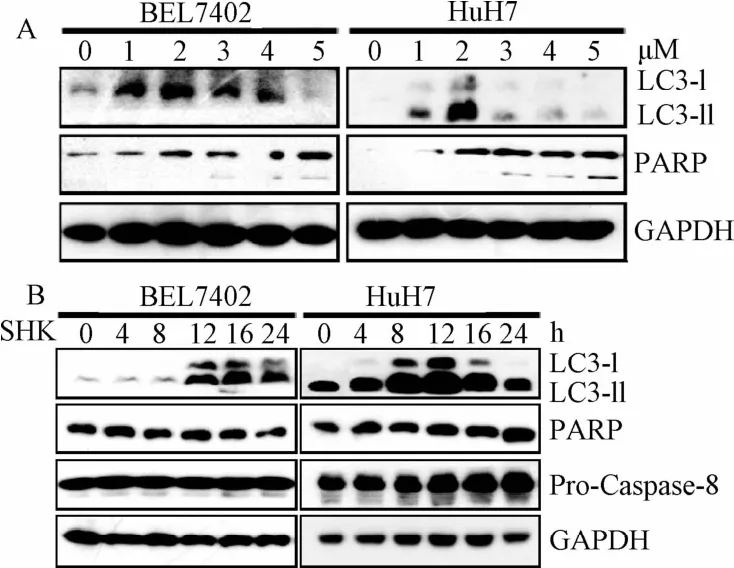
图6 紫草素诱导细胞自噬的浓度梯度(A)和时间梯度(B)Fig.6 Concentrations of shikonin induced autophagy(A)and the time gradient(B)
2.2.2 GFP-LC3荧光点聚集与吖啶橙染色实验证明细胞自噬发生:如图7A所示,阈值设定为5,经过2.5μM紫草素处理12 h以后,拥有超过5个荧光聚集点的细胞比例从20%上升到80%。如图7B所示,吖啶橙染色后,细胞质中出现酸性自噬泡的细胞发出橙色荧光。紫草素处理前,几乎没有这样的橙色细胞,经过2.5μM紫草素处理12 h后,有大约30%左右肝癌细胞的细胞质发出了橙色荧光。
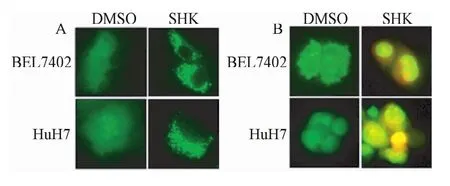
图7 GFP-LC3荧光点聚集(A)与吖啶橙染色(B)实验的细胞自噬图Fig.7 Autophagy diagram of GFP-LC3 fluorescence point aggregation and acridine orange staining experiments
2.2.3 紫草素诱导自噬潮发生:如图8所示,加入CQ预处理后,LC3-II的表达量在紫草素刺激后的上升量比紫草素单独刺激时明显增多(过量CQ存在下,自噬体一旦生成便不能降解,故单独CQ作用也可引起LC3-II增多,但是这种增多比CQ与细胞自噬诱导剂联合处理要少),说明CQ对溶酶体活性的抑制,阻止了后续自噬体的降解,这也证明了紫草素诱导的细胞自噬后期会发生自噬体降解的情况,即紫草素能指导自噬潮的发生。通过检测紫草素刺激下的p62表达量变化,发现随着紫草素刺激浓度的上升,p62水平逐渐下降,说明紫草素诱导下,肝癌细胞内发生了自噬溶酶体的降解过程。
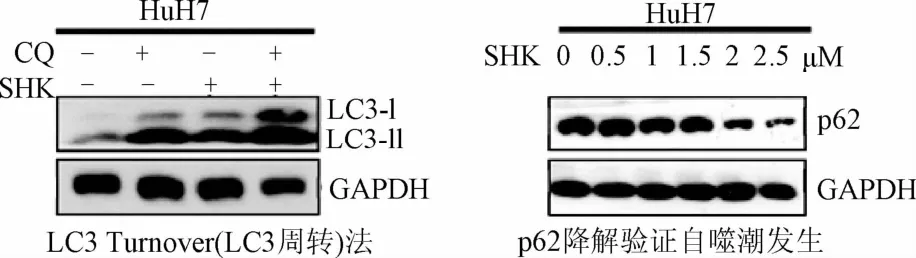
图8 自噬潮(autophagic flux)的验证Fig.8 Autophagy tide(Autophagic flux)validation
2.2.4 激光共聚焦显微镜观察线粒体自噬:如图9所示,亲线粒体的红色荧光染料Mito-Tracker Red可以特异性标记线粒体,用GFP-LC3质粒的转染标记自噬体,紫草素刺激后,在荧光显微镜下看到红色和绿色的部分荧光重合成黄色,说明紫草素诱导的细胞自噬有线粒体自噬的成分,紫草素对线粒体有损伤。
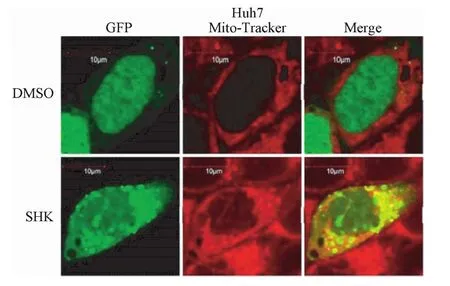
图9 激光共聚焦显微镜观察线粒体自噬Fig.9 Observation ofmitochondrial autophagy by laser confocalmicroscopy
3 讨论
本研究对紫草素的抗肝癌分子机制分为2部分进行。前一部分为紫草素在4~8μM处理24 h的条件下诱导肝癌细胞凋亡。细胞凋亡作为Ⅰ型程序性细胞死亡方式,是靶向抗肿瘤药物杀伤癌细胞的最常见机制[9-10]。然而Ⅱ型程序性细胞死亡即细胞自噬,目前在肿瘤药物治疗研究领域仍有较大争议,因此对紫草素诱导细胞凋亡以外的抗肿瘤机制研究主要关注于其诱导细胞自噬的能力。本研究发现2.5μM的紫草素刺激12 h能达到自噬体产生的最大峰值(以LC3-Ⅱ的表达量作为标准)。
许多研究细胞程序性死亡的学者认为[11],诱导癌细胞凋亡是癌症治疗中的一把利器,但肿瘤细胞能发展许多方法如细胞自噬抵抗等逃避这把利器的杀伤[12];细胞自噬则是肿瘤治疗中的一把双刃剑[13]。一方面,因为肿瘤细胞能在营养不良、化疗药物刺激等不良环境下借助激活细胞自噬得以存活。同时细胞自噬的抑制会导致细胞凋亡功能缺失的肿瘤细胞基因组不稳定、活性氧自由基的积累以及细胞坏死,说明细胞自噬对癌细胞生存有利。另一方面,许多抗癌分子,如雷帕霉素,能激活肿瘤细胞自噬性死亡从而将其清除出机体[14],虽然雷帕霉素因为其高毒性未能成为抗肿瘤临床药物,但激活肿瘤细胞自噬也被认为是癌症治疗的有效靶点[15]。本研究中,紫草素在体内体外均能激活肝癌细胞凋亡与细胞自噬,但诱导这2种死亡方式的作用浓度和时间明显不同。综合本研究的实验结果,可以认为紫草素初具这种“多”特性的化疗药物的潜能。虽然紫草素的直接亲和攻击靶点未知,而且可能也是多靶点的,但其能作用于肿瘤细胞内的多条重要的细胞信号通路,改变多个通路关键蛋白的表达,激活多种主要的细胞编程性死亡过程,都说明紫草素具有潜在的临床药用价值。
[1] Ajani JA.Optimizing docetaxel chemotherapy in patients with cancer of the gastric and gastroesophageal junction:evolution of the docetaxel,cisplatin,and 5-fluorouracil regimen[J].Cancer,2008,113(5):945-955.
[2]Arany I,Megyesi JK,Kaneto H,et al.Cisplatin-induced cell death is EGFR/src/ERK signaling dependent in mouse proximal tubule cells[J].American journal of physiology Renal physiology,2004,287(3):F543-549.
[3]Ariff B,Lloyd CR,Khan S,et al.Imaging of liver cancer[J]. World journal of gastroenterology:WJG,2009,15(11):1289-1300.
[4]Arzumanyan A,Reis HM,Feitelson MA.Pathogenic mechanisms in HBV-and HCV-associated hepatocellular carcinoma[J].Nature reviews Cancer,2013,13(2):123-135.
[5]Bekaii-Saab T,Markowitz J,Prescott N,et al.A multi-institutional phase IIstudy of the efficacy and tolerability of lapatinib in patients with advanced hepatocellular carcinomas[J].Clinical cancer research:an official journal of the American Association for Cancer Research,2009,15(18):5895-5901.
[6]Belghiti J,Cortes A,Abdalla EK,et al.Resection prior to liver transplantation for hepatocellular carcinoma[J].Annals of surgery,2003,238(6):885-892;discussion 892-883.
[7]Bosch FX,Ribes J,Diaz M,et al.Primary liver cancer:worldwide incidence and trends[J].Gastroenterology,127(5 Suppl 1):S5-S16.
[8]Boya P,Gonzalez-Polo RA,Casares N,et al.2005)Inhibition of macroautophagy triggers apoptosis[J].Molecular and cellular biology,2004,25(3):1025-1040.
[9]Breitenstein S,Apestegui C,Petrowsky H,et al.“State of the art”in liver resection and living donor liver transplantation:a worldwide survey of 100 liver centers[J].World J Surg.2009,33(4):797-803.
[10]Bruix J,Sherman M,American Association for the Study of Liver D.Management of hepatocellular carcinoma:an update[J]. Hepatology,2011,53(3):1020-1022.
[11]Hsu PC,Huang YT,Tsai ML,et al.Induction of apoptosis by shikonin through coordinativemodulation of the Bcl-2 family,p27,and p53,release of cytochrome c,and sequential activation of caspases in human colorectal carcinoma cells[J].Journal of agricultural and food chemistry,2004,52(20):6330-6337.
[12]Jacobson MD.Reactive oxygen species and programmed cell death[J].Trends Biochem Sci,1996,21(3):83-86.
[13]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J]. CA:a cancer journal for clinicians,2011,61(2):69-90.
[14]Jeong SW,Jang JY,Chung RT.Hepatitis C virus and hepatocarcinogenesis[J].Clinical and molecular hepatology,2012,18(4):347-356.
[15]Jiang C,Wang Z,Ganther H,et al.Caspases as key executors of methyl selenium-induced apoptosis(anoikis)of DU-145 prostate cancer cells[J].Cancer Res,2001,61(7):3062-3070.
(编校:吴茜)
Studies on molecular mechanisms of shikonin-induced programmed cell death in human hepatocellular carcinoma cells
LIU Ren-tong1,WEIChun-pei2,LIU Su-xia3
(1.Department of Hematology,Affiliated Hospital of Binzhou Medical College,Binzhou 256600,China;2.Department of Inspection,Affiliated Hospital of Binzhou Medical College,Binzhou 256600,China;3.Department of Medicine,Shandong University,Jinan 250100,China)
ObjectiveTo study the activity of shikonin on anti-hepatoma in vitro and in vivo and its possiblemechanism.MethodsCell apoptosis was detected by Annexin-V FITC/PI double staining assay;aggregation test was detected by LC3 conversion method in autophagy,Western blot and GFP-LC3 fluorescence point.ResultsHepatoma cells and normal liver cellswere induced autophagy by shikonin(less than or equal to 2.5μM)for 12 hours.LC3 conversion,GFP-LC3 fluorescence detection point aggregation and acridine orange staining autophagic vacuoles proved that shikonin induced autophagy.Shikonin induced autophagy could be blocked by early 3-MA autophagy inhibitors effectively;the generation of autophagy tideswas proved by LC3 turnover and p62 degradation.Resultsof apoptosis protein markers detected by Western blot and Annexin-V FITC/PI showed that the higher concentration of shikonin(6~8μM)for 24 hours treatment could induce apoptosis of hepatocellular carcinoma,but couldn't affect the survival of deteriorated liver cells.Apoptosis of hepatocellular carcinoma was prevented by pretreated with broad-spectrum inhibitor z-VAD of Caspase cells.Shikonin induced cell apoptosis depended on the shear of Caspase protein.ConclusionShikonin could induce the apoptosis and autophagy of hepatocellular carcinoma cells in vitro.
shikonin;human hepatocellular carcinoma;molecularmechanisms;apoptosis;autophagy
R966
A
1005-1678(2014)07-0001-05
山东省医药卫生科技发展计划项目(2009HD009)
刘仁同,男,硕士,主治医师,研究方向:血液恶性肿瘤研究及治疗,E-mail:ltr1821460122@163.com。

