羟基红花黄色素A肠溶微丸的研究
邹宇,李智勇,周丽,赵,潘虹,牛英才
(1.齐齐哈尔医学院药理教研室,黑龙江齐齐哈尔161006;2.齐齐哈尔市中医医院骨科,黑龙江齐齐哈尔161000)
羟基红花黄色素A肠溶微丸的研究
邹宇1,李智勇2,周丽1,赵1,潘虹1,牛英才Δ
(1.齐齐哈尔医学院药理教研室,黑龙江齐齐哈尔161006;2.齐齐哈尔市中医医院骨科,黑龙江齐齐哈尔161000)
目的制备羟基红花黄色素A(hydroxysafflor yellow A,HSY-A)微丸,对体外释药和体内动力学特性进行考察。方法采用挤出滚圆-流化床包衣技术制备HSY-A微丸,考察粉体学性质,研究影响体外释药的处方因素,通过数学原理和相关模型探讨其释放行为和机制,评价其在体内的口服吸收的药物动力学特征。结果HSY-A微丸体外释放更符合Ritger-peppas动力学方程,以扩散形式释放药物,体内吸收试验进一步说明其在胃中不释放,具有良好的肠溶特性。结论本研究获得较为满意的HSY-A微丸,达到预期的目的。
羟基红花黄色素;肠溶微丸;体外释放度;体内动力学
红花黄色素是从红花的花瓣中提取出的主要有效成分之一,其主要有效单体为羟基红花黄色素A,具有缓解心肌缺血、扩张冠状动脉、抗氧化、降血压、免疫抑制和脑保护等多种药理功能,临床应用广泛。然而,红花黄色素A经口服给药后存在吸收不完全,体内生物利用度低,半衰期较短等问题,严重限制了其口服给药制剂的开发[1-3]。微丸具有刺激性小,血药浓度重现性好,易调节释药速率,减少给药次数,维持平稳的有效浓度,提高药物生物利用度等优点,作为缓释/控释制剂受到极大的关注[4-5]。笔者开发红花黄色素A缓释微丸,对其制备工艺和体外溶出度体内动力学特征进行研究,为其进一步开发应用提供参考。
1 材料与方法
1.1 主要试剂与仪器 JBZ-300型多功能微丸包衣造粒机(中国辽宁医联新药技术研究所);mini-GLATT流化床(德国GLATT公司);LC-10AD型高效液相色谱仪,SPD-10A型紫外检测器(岛津中国有限公司);SZ-93A自动双重纯水蒸馏器(上海亚荣生化仪器厂);超高速冷冻离心机(LE-80K,美国Beckman公司);紫外分光光度计(UV-2550,日本岛津株式会社);星火牌C型玻璃仪器气流烘干器(长城科工贸有限公司);RCZ-6B3型药物溶出仪(上海黄海药检仪器有限公司)。羟基红花黄色素-A(HSY-A,自制,纯度大于90%);羟基红花黄色素A标准品(上海金穗生物科技有限公司,纯度大于95%);双蒸水(自制);微晶纤维素(MCC,山东泰安瑞泰纤维素有限公司);Eudragit L30D-55(德国Evonik公司);柠檬酸三乙酯(TEC,上海邦成化工有限公司);滑石粉(桂林滑石粉制品有限公司)。健康SD大鼠,雌雄各半,体质量180~220 g,大连实验动物中心提供,许可证号为SCXK(辽)2008-0002,实验操作遵循《实验动物保护条例》。
1.2 体外分析方法的建立
1.2.1 测定波长的选择:用pH 1.2的盐酸溶液及pH 6.8的磷酸盐缓冲液(PBS缓冲盐溶液)配成0.25 mg/mL的红花黄色素A标准品溶液。按紫外分光光度法在200~800 nm波长范围内进行紫外扫描;同时取适量空白辅料,分别溶pH 1.2的盐酸溶液、pH 6.8的PBS溶液中,超声溶解30min,过滤,采用相同方法对其进行扫描,确定药物吸收波长。
1.2.2 标准曲线的绘制:精密称取HSY-A10 20 mg置50 mL量瓶中,分别加pH 1.2的盐酸溶液、pH 6.8的PBS溶液溶解并稀释至刻度,分别制得浓度为0.51,1.02,2.04,8.16,10.20,40.80,80.1 mg/mL的系列溶液。于403 nm的波长处测定吸光度。
1.2.3 精密度测定:分别配制低、中、高,3种不同浓度的HSY-A pH 1.2的盐酸溶液、pH 6.8的PBS溶液各5份。将低、中、高三种浓度的溶液,用相应溶液定容,并分别在一天内测定5次,记下吸光度,代入标准曲线内计算日内精密度;此后每天再按相同方法再测低、中、高三种浓度溶液的吸光度,连续测5天,并计算日间精密度。
1.2.4 回收率测定:分别配制低、中、高,3种不同浓度的HSY-A pH 1.2的盐酸溶液、pH 6.8的PBS溶液各3份,分别加处方量的辅料于溶液中。用相应溶液定容。将配好的低、中、高浓度的溶液分别于403 nm处进行紫外扫描,计算回收率。
1.3 HSY-A微丸丸芯的制备 经前期处方筛选和工艺因素考察,将HSY-A同处方量的MCC过100目筛,混合均匀,加3%的HPMC作为黏合剂制备软材,以30 Hz的挤出速度经机筛板挤出(孔径0.8mm),将条状挤出物移至滚圆机,滚圆速度为50 Hz,滚圆时间为5min,制成球形;滚圆后将微丸于55℃干燥。干燥后筛分出18~30目间微丸进行评价,连续制备3批,考察粉体学性质。
1.4 HSY-A包衣微丸的制备 取载药微丸丸芯适量,取Eudragit L30D-55水分散体,加水适量,搅匀,将TEC及滑石粉加入适量水中,搅拌均匀后将其慢慢加入到Eudragit L30D-55中,磁力搅拌1 h,过滤,在包衣过程中持续搅拌,以流化床底喷的方式进行包衣。包衣条件为雾化压力35 kPa,鼓风频率30Hz,流化压力45 kPa,流化床出口温度36℃~38℃,包衣液流速0.4mL/ min,包衣后于38℃烘箱干燥2 h。
1.5 HSY-A包衣微丸的释放及影响因素测定 研究采用转蓝法,分别将不同处方组成的微丸装于转蓝中,于900 mL的溶出介质中,在pH=1.2的盐酸中释放2 h,分别于0.5、1、2 h取样5m L,并及时补充等量同温的溶出介质,经0.45μm的微孔滤膜滤过,更换溶出介质,在pH 6.8的PBS中释放10 h,温度控制在(37±0.5)℃,转速为100 r/min,继续分别于2.5、3、4、5、6 h取样5 m L,同上操作取续滤液,用紫外分光光度法测其吸光度,计算累计释放百分率。以下药物释放考查均按此法。
1.5.1 TEC用量的影响:分别将相当于包衣材料量的5%、15%、30%的TEC加入到包衣液中,制备包衣微丸,测定累积释放率,绘制释药曲线。
1.5.2 包衣增重水平的影响:取适量的HSY-A微丸丸芯进行包衣,制备包衣(Eudragit L30D-55)增重分别为5%,10%,15%的微丸,考察不同包衣增重的条件下的累积释放率。
1.5.3 滑石粉用量的影响:包衣过程中分别加入相当于Eudragit量20%,30%,40%的超细滑石粉作为抗黏剂,考察其对释放的影响。
1.6 包衣微丸重复验证试验 按“1.4”项下制备方法,以确定的最佳包衣处方,即增塑剂用量为包衣材料量的15%,滑石粉的用量为包衣材料量的30%,包衣增重为10%时,制备3批样品,考察其外观,并按“1.5”项方法测定体外释药特性。
1.7 HSY-A微丸在小鼠体内药物动力学研究
1.7.1 血样的处理[6-7]:精密吸取血浆100μL于2mL尖底离心管中,加入甲醇150μL,涡旋混合器混匀2min,离心(10000 r/min)10min。取出上清液至另一离心管中,于60℃水浴中氮气吹干,残渣加水100μL,超声溶解30 s,涡旋混合1min,上清液过滤,取20μL进样,用HPLC分析,色谱条件为:色谱柱:DIKMA Diamonsil C18(150mm×4.6mm,5μm),预柱:DIKMA C18(150 mm×4.6mm,5μm);流动相:甲醇:乙腈:0.05%磷酸水=20:2:78(用三乙胺调pH至5.96);检测波长:403 nm;流速:1 mL/ min;柱温箱:室温。
1.7.2 小鼠灌胃给药:分别取健康SD大鼠6只,给药前12 h禁食,自由饮水。口服灌胃HSY-A微丸每只按500 mg/kg的剂量灌胃,并于给药0.25、0.5、1、1.5、2、3、4、6、8、10 h后尾静脉采血0.2mL,置于用肝素钠抗凝的离心管中,离心(5000 r/ min)10min,取出上层血清置于离心管中,-20℃储存备用,按“1.7.1”项进行处理和测定,结果用DAS2.1.1药动学软件处理。
2 结果
2.1 体外分析方法的建立 红花黄色素A的最大吸收波长为403 nm,而空白辅料此处无吸收,因此选择403 nm作为测定波长。以吸光度为横坐标,HSY-A浓度为纵坐标,分别得红花黄色素A浓度和吸光度在加pH 1.2的盐酸溶液、pH 6.8的PBS溶液的回归方程:y=0.1001x-0.0076,r=0.9999和y=0.0902x-0.0068,r=0.9999,线性关系均良好。精密度试验吸光度RSD值均小于2%,表明仪器精密度良好。回收率试验吸光度RSD值均小于2%,表明均符合方法学要求。
2.2 HSY-A微丸丸芯的制备 制备3批HSY-A微丸丸芯,粉体学性质见表1。
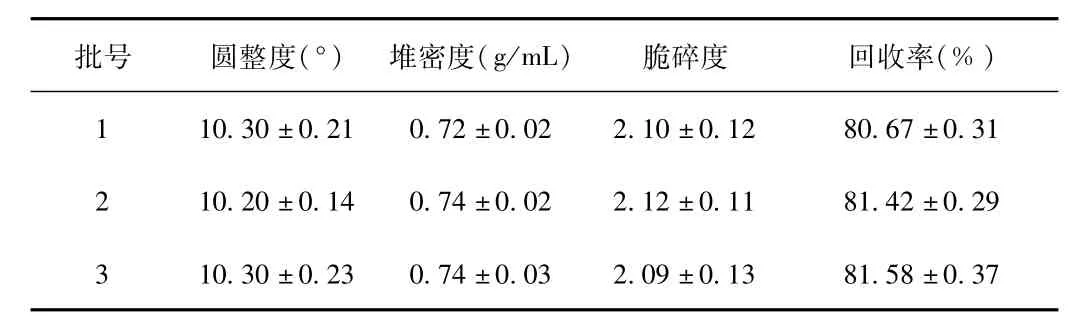
表1 HSY-A微丸丸芯的粉体学性质及回收率(n=3)Tab.1 Themicromeritic properties and yield of HSY-A pellets(n=3)
2.3 HSY-A包衣微丸的释放及影响因素测定
2.3.1 TEC用量的影响:TEC用量对药物释放有显著影响(见图1),当其用量较小时,药物的释放较快,前2 h释放较快,可能由于低含量的TEC不能完全起到增塑剂的作用,未能形成连续完整的包衣膜,HSY-A包衣微丸抗酸性下降所致;TEC用量增加时,HSY-A微丸释药速率明显减缓,提高TEC含量有利于丸芯表面铺展和融合作用,促进完整的肠溶衣的形成[8],但当用量为30%时,微丸间易粘连、聚结,收率下降;增塑剂用量为15%包衣效果理想,可有效控制药物释放的速度。
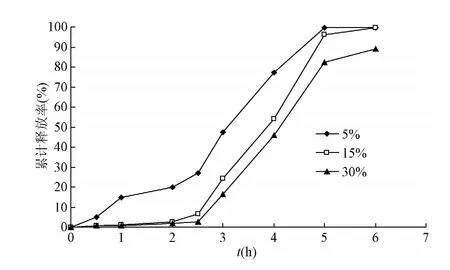
图1 TEC用量对包衣微丸释放率的影响Fig.1 Effect of the TEC amount on the release rate of coated pellets
2.3.2 包衣增重水平的影响:随包衣增重的增加,微丸的释药速率逐渐变慢,与文献一致[9],包衣增重为5%时,HSY-A在酸性环境中释放较多,达不到肠溶效果;包衣增重为15%时,抗酸性较好,但释放率明显下降,后期药物释放不完全。包衣增重为10%时,一定程度增加了包衣膜厚度,降低了介质向包衣膜内的渗透速率,而且增加了包衣膜的抗张强度,释药曲线具有较好的缓释特性(见图2)。
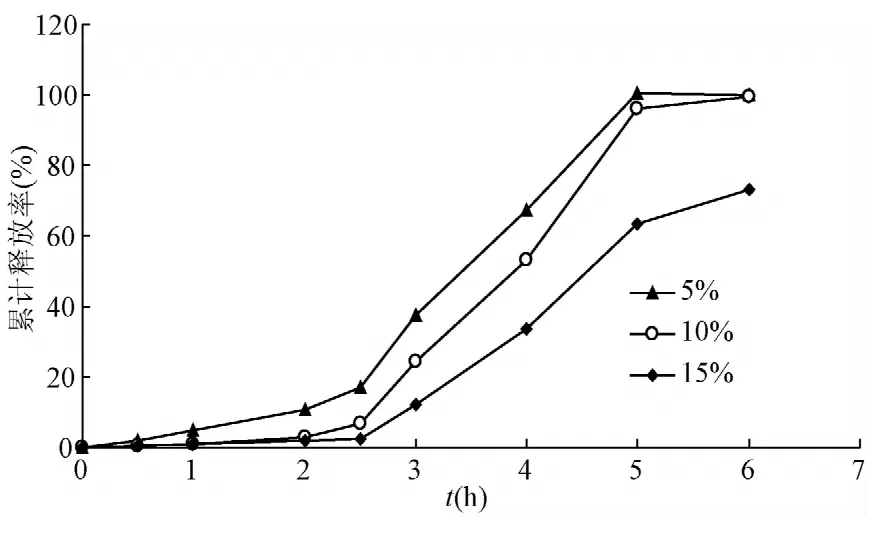
图2 包衣增重对包衣微丸释放率的影响Fig.2 Effect of the coating weight on the release rate of coated pellets
2.3.3 滑石粉用量的影响:随着滑石粉用量的增加,释放的速度和程度也同时增加,但当用量较大时,尽管起到较好的抗黏作用,但包衣液易发生沉淀,易造成药物含量降低[10],且包衣微丸的圆整度和回收率不好;当滑石粉用量为20%时,微丸之间会发生一定的聚集及粘连现象,抗粘作用不明显,故选择滑石粉的用量为30%(见图3)。

图3 滑石粉用量对包衣微丸释放率的影响Fig.3 Effect of the talcum powder amount on the release rate of coated pellets
2.4 包衣微丸重复验证试验 制备3批样品,观察微丸无裂缝、崩解或软化现象,体外释放结果见图4,将释药行为进行释药数学模型拟合,拟合优度和数学释放模型拟合结果见表2。前1.5 h累积释药百分率小于0.5%,基本不释放,5 h释放率达90%以上(见图4)。
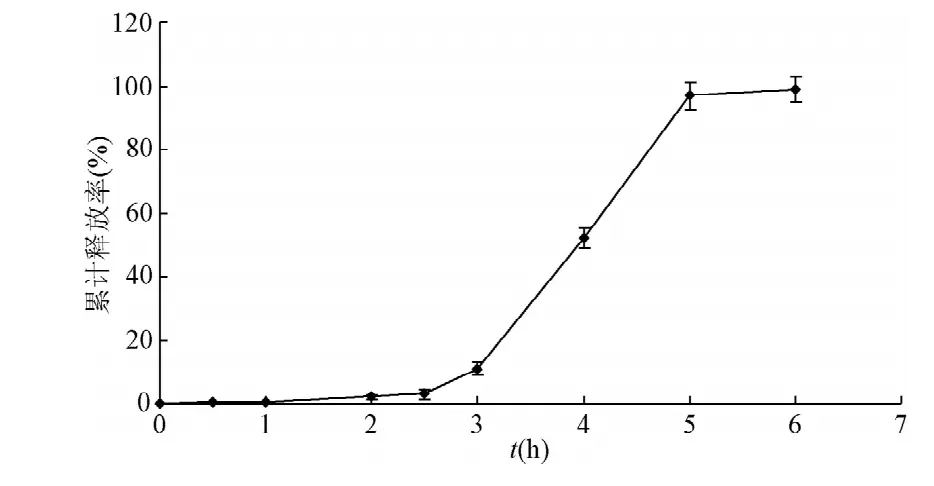
图4 HSY-A微丸的累积释放率(n=3)Fig.4 Cumulative release rate of HSY-A coated pellets(n=3)

表2 HSY-A微丸体外释药模型拟合Tab.2 The regression equation of HSY-A coated pellets in vitro
2.5 HSY-A微丸在小鼠体内药物动力学研究 大鼠口服HSY-A微丸后血浆中的药物动力学参数结果见表3,其药物动力学特征可用双室模型来拟合,权重系数w=1/c2(见图5)。

表3 大鼠口服HSY-A微丸后血浆中的药物动力学参数(n=6)Tab.3 The pharmacokinetic parameters of HSY-A after oral administration of coated pellets in rats(n=6)

图5 大鼠口服HSY-A微丸后血药浓度与时间变化的关系曲线(n=6)Fig.5 The plasma concentration-time curve after oral administration of HSY-A coated pellets in rats(n=6)
3 讨论
本实验用挤出滚圆法制备了含药丸芯,利用流化床包衣技术进行了肠溶包衣,制备了HSY-A微丸。经过前期处方和工艺研究,确定挤出滚圆法制备微丸的挤出速度为30 Hz,滚圆速度为50Hz,滚圆时间为5min。所制备的微丸的圆整度、堆密度、脆碎度和回收率均达到要求,批间重复性高,这也与筛选合适比例的TEC作为增塑剂、滑石粉作为抗黏剂有关,即确定的最佳包衣作为增塑剂,用量为包衣材料量的15%,滑石粉的用量为包衣材料量的30%,包衣增重为10%。
良好的结肠靶向制剂是在胃酸环境下(pH 1~2)不溶解,在结肠中性或弱碱性环境下溶解[11-12],HSY-A微丸在前1.5 h累积释药百分率小于3%,说明其不易受胃酸液体环境的影响,进入结肠(回肠末端)后(pH 6.8缓冲液),释放率达90%以上,较好的控制了药物的释放,具有良好的肠溶特性,达到了预期的目的。且释放更符合Ritger-peppas动力学方程(lnQ=2.4974lnt-0.1324,r=0.9775,n=0.2497),当n≤0.43时,为Fick扩散机制[13],说明药物从微丸的释放主要通过包衣膜的微孔和孔隙扩散[14-15]。
HSY-A微丸在1.5 h即达到最大血药浓度峰,2 h后血药浓度逐渐降低,药-时曲线趋于平坦。大鼠的胃排空时间平均在0.75~2 h左右[16],在2 h前,药物吸收量比较少,说明HSY-A微丸在胃中比较稳定且没有释放或释放很少,其体外溶出结果和药物体内的吸收规律较为一致,较好的控制了药物的释放,即进一步验证了其在胃中基本不释放,有一定的肠溶特性或结肠释放特点,且生产工艺稳定、简单,为其临床应用提供依据。
[1] Song HT,Zhang Q,Wang HJ,F,et al.Preparation of the traditional Chinesemedicine compound recipe Shuxiong sustained-release capsules by multiparticulate time-controlled explosion technology[J]. Pharmazie,2007,62(5):372-377.
[2]Lv LZ,Tong CQ,Yu J,etal.Mechanism of enhanced oral absorption of hydrophilic drug incorporated in hydrophobic nanoparticles[J].Int J Nanomedicine,2011,8:2709-2717.
[3]Qi J,Zhuang J,Wu W,et al.Enhanced effect and mechanism ofwaterin-oilmicroemulsion as an oral delivery system of hydroxysafflor yellow A[J].Int JNanomedicine,2011,6:985-991.
[4]赵燕敏,冯耀荣,陈锋.中药口服缓控释微丸制剂的研究进展[J].中国药师,2013,16(5):764-767.
[5]Haaser M,Karrout Y,Velghe C,et al.Application of terahertz pulsed imaging to analyse film coating characteristics of sustained-release coated pellets[J].Int JPharm,2013,457(2):521-526.
[6]刘月庆,周海涛,毕开顺.红花黄色素A在小鼠体内的分布[J].药学学报,2004,39(3):217-219.
[7]王慧娟.红花黄色素在体内的稳定性及药动学研究[D].华中科技大学,2013.
[8]Kibria G,Roni MA,Absar MS,et al.Effect of plasticizer on release kinetics of diclofenac sodium pellets coated with Eudragit RS 30 D[J].AAPSPharmSciTech,2008,9(4):1240-1246.
[9]Sauer D,Zheng W,Coots LB,et al.Influence of processing parameters and formulation factors on the drug release from tablets powder-coated with Eudragit L 100-55[J].Eur JPharm Biopharm,2007,67(2):464-475.
[10] 辛伟,邹梅娟,郑丹,等.复方盐酸伪麻黄碱缓释微丸的制备及其释放度考察[J].沈阳药科大学学报,2007,24(10):593-597.
[11]Yang L,Chu JS,Fix JA.Colon-specific drug delivery:new approaches and in vitro/in vivo evaluation[J].Int JPharm,2002,20:1-15.
[12]Van den Mooter G.Colon drug delivery[J].Expert Opin Drug Deliv,2006,3(1):111-125.
[13] 孙维彤,李旭,于新彪.双氯芬酸钠壳聚糖明胶复合微球的释药机制研究[J].中国生化药物杂志,2011,6(32):437-443.
[14]Ravi PR,Ganga S,Saha RN.Design and study of lamivudine oral controlled release tablets[J].AAPS PharmSciTech,2007,8 (4):E101.
[15]Sun W,Zhang N,Li X.Release mechanism studies on TFu nanoparticles-in-microparticles system[J].Colloids Surf B Biointerfaces,2012,15(95):115-120.
[16] 尹红,严祥,刘纯,等.不同麻醉药物对大鼠胃排空影响的初步研究[J].四川动物,2011,30(1):115-117.
(编校:谭玲)
Study on hydroxysafflor yellow A enteric pellets
ZOU Yu1,LIZhi-yong2,ZHOU Li1,ZHAO Kun1,PAN Hong1,NIU Ying-cai1Δ
(1.Department of Pharmacology,Qiqihar Medical University,Qiqihar 161006,China;2.Department of Orthopaedics,Traditional Chinese Medicine Hospital of Qiqihar,Qiqihar 161000,China)
ObjectiveTo prepare the hydroxysafflor yellow A(HSY-A)enteric coating pellets,and investigate in vitro release and in vivo pharmacokinetic characteristics.MethodsHSY-A enteric coating pellets were prepared by extrude-rounding and fluid bed technique.The micromeritic characteristics,the factorsaffecting the release properties ofenteric coating pellets the releasemechanism were explored,and the in vivo pharmacokinetic behaviorswere also evaluated.ResultsThe in vitro release behavior of HSY-A from enteric coating pellets could be described by Ritger-peppas equation,and fitdiffusionmechanism,in vivo pharmacokinetic test confirmed the argument thatpellets have good acid residence and enteric properties.ConclusionHSY-A enteric coating pellets have been successfully prepared and the expected release properties is achieved in the study.
hydroxysafflor yellow A;enteric pellets;in vitro release;in vivo pharmacokinetics
RR283.6
A
1005-1678(2014)07-0180-04
黑龙江省教育厅科学技术研究(面上)项目(12531806)
邹宇,女,在读硕士,助理研究员,研究方向:药剂学与神经精神药理学,E-mail:zouyu22311@sina.com;牛英才,通信作者,男,博士,研究员,研究方向:药剂学与神经精神药理学,E-mail:nyc1968@sohu.com。

