草酸艾司西酞普兰对大鼠脑缺血再灌注损伤的神经保护作用
张建斌,李晓慧
(1.长治医学院附属和济医院神经内科,山西长治046011;2.长治医学院附属和济医院神经康复科,山西长治046000)
草酸艾司西酞普兰对大鼠脑缺血再灌注损伤的神经保护作用
张建斌1,李晓慧2
(1.长治医学院附属和济医院神经内科,山西长治046011;2.长治医学院附属和济医院神经康复科,山西长治046000)
目的探讨草酸艾司西酞普兰对局灶性脑缺血再灌注大鼠的神经保护作用及可能的机制。方法取SD雄性大鼠160只,随机分为假手术组(Sham组)、生理盐水组(NS组)、干预组(CIT组,又分干预14 d组和21 d组)。线栓法制作大鼠局灶性脑缺血再灌注(MCAO)模型,使用改良神经功能缺损(modified neurological severity score,mNSS)量表评价各组大鼠神经功能缺损情况。分别于术后14 d和21 d按不同的实验时间点,使用激光共聚焦技术观察各组大鼠缺血区微血管直径、密度和总面积。酶联免疫吸附法检测血浆血管内皮生长因子(VEGF)浓度。免疫组化染色法和蛋白质印迹法检测VEGF表达。结果模型制作后,干预14 d组和干预21 d组内的大鼠神经功能缺损情况明显改善,各项指标检测结果如下:术后14 d mNSS评分,生理盐水组评分为(6.57±1.13)分,干预14 d组评分为(4.39±0.92)分,较生理盐水组明显降低(P<0.05);术后21 d mNSS评分,干预21 d组[(3.23±0.55)分]较干预14 d组[(4.14±0.74)分]明显降低(P<0.01)。术后14 d三维共聚焦结果显示:药物干预的效果随着时间的推移而逐步见效。术后14 d酶联免疫吸附法结果显示:相对于假手术组、生理盐水组干预14 d组和干预21 d组血浆VEGF浓度显著增加,药物干预后的实验组VEGF蛋白水平可显著增高。术后14 d免疫组化分析法显示:干预21 d组缺血脑组织VEGF表达显著性高于干预14 d组(P<0.01)。结论草酸艾司西酞普兰可以明显减轻脑缺血再灌注大鼠的神经损伤和改善神经功能,具有神经保护作用,且药物干预的效果随着时间的推移而逐步增强,其机制可能与VEGF介导的血管新生有关。
草酸艾司西酞普兰;脑缺血;神经保护;血管内皮生长因子
据国内权威专著调查统计,我国的脑血管疾病已成为严重危害人民健康的三大致死疾病之首,每年新发的近200万脑血管疾病中约80%为缺血性脑血管病(ischemic cerebralvascular diease,ICD)[1]。由于其高发病率、高死亡率和高致残率,且存活患者中3/4存在着不同程度的功能残疾和抑郁状态,给社会和患者家庭带来沉重负担[2]。目前临床上主要应用的神经保护治疗药物多为一些中成药制剂,使用时间长、不良反应多、疗效不确切[3]。为此,本课题选用缺血再灌注大鼠模型,在草酸艾司西酞普兰(escitalopram oxalate tablets,CIT)药物干预情况下,观察不同时间点各组大鼠的神经功能恢复情况,通过激光共聚焦技术检测各组大鼠缺血区脑组织的血管新生情况,同时通过检测缺血区的血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达情况来探讨其可能的分子生物学机制[4],以期为临床治疗ICD提供新的治疗方法或开辟新的方向。
1 材料与方法
1.1 实验动物 从中南大学动物实验中心购得雄性Sprague-Dawley(SD)大鼠160只,许可证号:SCXK(湘)2008~0004,SPF级,8~114日龄,体质量180~220 g。
1.2 试剂和仪器
1.2.1 仪器:MRi23型高速多功能冷冻离心机(美国JOUAN公司);SW-CJ-IF型超净工作台(苏净集团安泰公司);XDS-1B型倒置相差显微镜(重庆光学仪器厂);FLUOVIEWFV1000型激光共聚焦显微镜(日本OLYMPUS公司);MHR-02实验室用微波炉(青岛迈可威公司);CUT6062石蜡切片机(德国SLEE公司);YT-7C型生物组织烤片机(金华市益迪医疗设备厂);202-0A型电热干燥箱(杭州蓝天仪器有限公司);CX31-BIM双目生物显微镜(日本OLYMPUS公司);DELTA320 pH计(梅特勒-托利多上海有限公司);JT2002型电子天平(上海精密科学仪器有限公司);2432-50型北京沙东线栓(北京沙东生物技术有限公司)。
1.2.2 主要药品和试剂:草酸艾司西酞普兰(山东京卫制药有限公司);异硫氰酸荧光素-FITCF8070-50(美国Sigma公司);兔抗大鼠VEGF抗体(北京博奥森生物公司);SABC免疫组化试剂盒(武汉博士德生物公司);DAB试剂盒(南京凯基生物公司);其他免疫组化试剂(福州迈新生物公司)。
1.3 方法
1.3.1 动物分组处理:按体质量将所有实验大鼠随机分成3组,分别为假手术组、生理盐水组、干预组(CIT组,干预14 d和干预21 d组)。采用改良Longa-Zea线栓法[9]制作大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)再灌注模型。假手术组仅分离血管,暴露右侧颈总动脉、颈外动脉及颈内动脉,不进行手术插线和结扎操作,不做缺血再灌注。将CIT磨制成粉末,使用0.9%氯化钠溶液溶解,配制成20mg/100mL的混悬液。2个CIT药物干预组的大鼠在模型制作后按2mg/(kg·d)的标准灌胃,分别持续给药至14 d或21 d;生理盐水组大鼠在模型制作后2 h开始给予等容积生理盐水(10 mL/kg,每只大鼠按比例折算约为2mL/d)灌胃,灌胃均于每天上午8:30执行;假手术组大鼠不给药,只做常规饲养观察。
1.3.2 检测指标:激光共聚焦三维脑血管成像:于术后14 d及21 d,每组(共6组分为2个时间点进行,每个时间点3组——假手术组、生理盐水组、干预14 d或21 d组)分别取5只大鼠常规麻醉后,通过股静脉给予异硫氰酸荧光素标记物FITC-低分子右旋糖苷[相对分子质量2×106,50mg/(mL·kg),Sigma公司]标记血浆,1min后快速断头取脑,取动物脑组织置入4%的多聚甲醛外的冰盒中固定24~48 h,避光。标本采用振动切片机冠状切片,选取视交叉部位,向大脑端连续切片,片厚100μm。用激光扫描共聚焦显微镜扫100个层面。绿色荧光所占体积表示血浆灌注量,显微镜下获得的图像,分析血管直径小于8mm的血管,观察血管形态、内径、密度及单位面积荧光物质点数。
酶联免疫吸附法检测血浆VEGF浓度:于术后14 d及21 d,每组(共6组分为2个时间点进行,每个时间点3组——假手术组、生理盐水组、干预14 d及21 d组)分别取5只大鼠静脉外周血,应用酶联免疫吸附法检测血浆VEGF水平,具体操作过程依照试剂盒(武汉博士德生物工程有限公司)说明书进行。首先用EDTA抗凝管采集各组大鼠外周血约3mL,30min内离心,收集上层血浆,分装后-20℃保存。样品检测不稀释,预包被抗大鼠VEGF抗体96孔板上加样品(2份)和标准品(2份):将不同浓度的标准品按照100μL,依次加在一排7孔中,1孔仅加样品稀释液作为零孔并增1孔,作为TMB空白显色孔;将准备好的生物素抗大鼠VEGF抗体工作液,按每孔100μL依次加入,TMB空白显色孔除外;将准备好的ABC工作液按每孔100μL依次加入,TMB空白显色孔除外;按每孔90μL依次加入已在37℃平衡30 min的TMB显色液,37℃避光反应15min;按每孔100μL依次加入TMB终止液,最后应用RT-2100C型酶标仪(美国Rayto生命和分析科学有限公司),选择在450 nm波长处检测吸光度,并采用软件计算各组大鼠样品的VEGF浓度。
免疫组化染色法检测各组大鼠脑组织中VEGF表达:于术后14 d及21 d,每组(共6组分为2个时间点进行,每个时间点3组——假手术组、生理盐水组、干预14 d及21 d组)分别取5只大鼠行免疫组化染色检测,组织灌注与固定简要手术步骤如下:首先以10%水合氯醛(300mg/kg)腹腔注射麻醉,多聚甲醛持续灌注30min后,取材动物脑组织,并用4%的多聚甲醛后固定,脱水与石蜡包埋。行VEGF免疫组化。一抗为鼠抗VEGF,1:200,切片经脱蜡致水,孵育,吸干,加一抗EGF抗体4℃过夜;加生物化二抗工作液37℃下孵育约20min;加过氧化物酶标记,并用磷酸盐缓冲液冲洗3次,ABC孵育,DAB后显色。取1 mL蒸馏水,试剂盒中A,B,C试剂各1滴,混匀后滴加至切片中央,轻轻摇匀。室温下放置15min,蒸馏水洗涤→苏木素溶液轻度复染1min,用盐酸酒精分化,脱水,用二甲苯透明,后用中性树脂封片,在倒置显微镜下观察并拍照,使用Image-Pro Plus 6.0软件分析免疫组化图片,测定IOD光密度值。
1.4 统计学方法 采用SPSS 13.0统计学软件进行实验数据分析,正态计量数据用±s”表示,两样本间比较采用配对t检验,多样本均数采用采用单因素方差分析;以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠的神经功能缺损评分 模型制作前1 d,假手术、生理盐水组、干预14 d组和干预21 d组mNSS评分,4组间差异无统计学意义,说明此时4组大鼠的脑神经均无损伤,神经功能正常,术前各组大鼠的生理实验基础基本相同;术后2 d测评,假手术组大鼠仅有轻微的神经功能缺损(2.13±0.35)分,随着时间的推移,各组大鼠神经功能缺损均有不同程度恢复;术后14 d测评,假手术组大鼠mNSS评分变化不大,生理盐水组、干预14 d组和干预21 d组的mNSS评分都有不同程度下降,干预14 d组明显低于生理盐水组,2组间差异有统计学意义(P<0.05),说明干预14 d组神经功能的恢复明显优于生理盐水组;术后21 d测评,假手术组大鼠mNSS评分仍然变化不大,其它3组干预21 d组<干预14 d组<生理盐水组,在CIT药物连续21 d的作用下,干预21 d组大鼠神经功能的恢复明显优于干预14 d组(见表1)。

表1 各组大鼠改良神经功能缺损评分结果Tab.1 Results ofmNSS in each groups
2.2 激光共聚焦三维脑血管成像 术后14 d所做的大鼠脑组织激光共聚焦分析结果见图1、表2。干预14 d组、21 d组的毛细血管直径较假手术组和生理盐水组明显减少(P<0.01);干预14 d组、21 d组的血管密度较假手术组及生理盐水组均有显著增大(P<0.01);干预14 d组、21 d组大鼠缺血区微血管总面积显著增加与假手术组和生理盐水组比较差异有统计学意义(P<0.01)。干预21 d组血管直径小于干预14 d组;血管密度较干预14 d组显著增多(P<0.01);微血管总面积显著大于干预14 d组(P<0.01),说明药物干预的效果随着时间的推移而逐步见效,在CIT药物连续3周的作用下,干预21 d组大鼠脑血管的新生和恢复明显优于干预14 d组(见表2)。
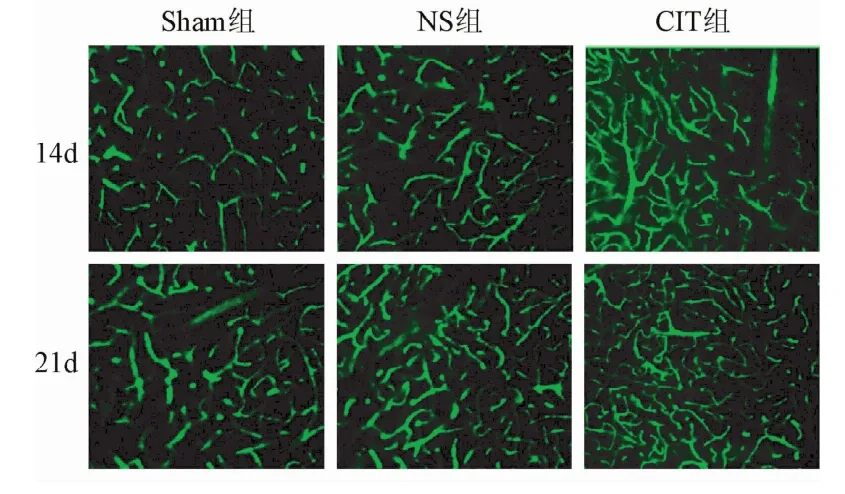
图1 脑缺血大鼠缺血区微血管激光共聚焦三维成像结果Fig.1 Confocal 3D imaging results ofmicrovascular in cerebral ischemic area of cerebral ischemia rats
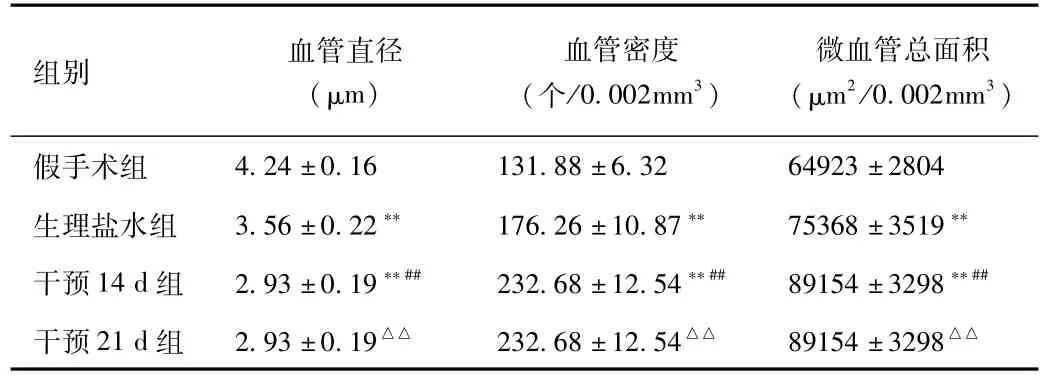
表2 脑缺血大鼠缺血区微血管激光共聚焦三维成像分析Tab.2 Confocal 3D imaging analysis ofmicrovascular in cerebral ischemic area of cerebral ischemia rats
2.3 血浆VEGF浓度 术后14 d,用酶联免疫吸附法测得假手术组、生理盐水组和干预14 d组3组间大鼠血浆VEGF浓度存在明显差异。其中,生理盐水组和干预14 d组均显著高于假手术组(P<0.01),而干预14 d组也显著高于生理盐水组(P<0.01)。术后21 d,干预21 d组大鼠血浆VEGF浓度值与干预14 d组相比较,2组间差异有统计学意义(P<0.01,见表3)。
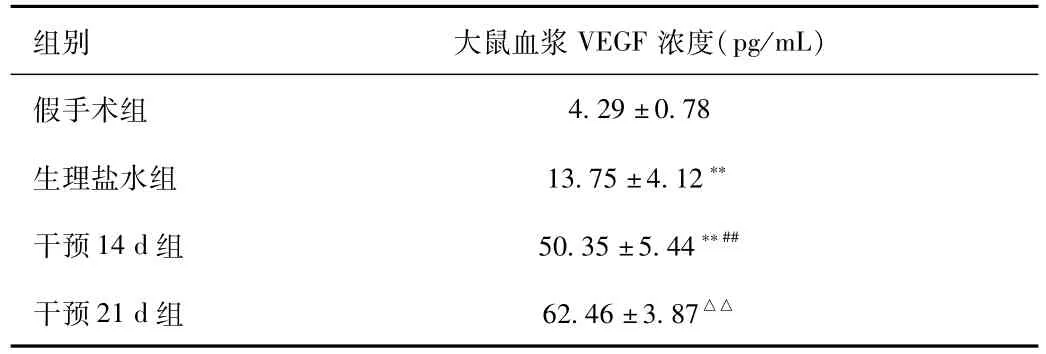
表3 血浆VEGF浓度Tab.3 The plasma concentrations of VEGF
2.4 免疫组化染色法检测各组大鼠脑组织中VEGF表达免疫组化染色结果可见:VEGF阳性细胞具有神经元的形态特征,主要分布在大脑皮质、海马和纹状体等脑区,表现为胞浆呈棕黄色深染,缺血区周围较多,而缺血中心区则很少,在神经元、胶质细胞、血管内皮细胞上均有表达(见图2)。
缺血再灌注14 d到21 d,都可以见到VEGF表达,术后14 d从上述3区域的VEGF免疫组化光密度值(IOD)分析,干预14 d组显著高于假手术组和生理盐水组的IOD值(海马区F= 1440.2,P<0.01;皮质区F=647.04,P<0.01;纹状体区F= 1549.59,P<0.01),进一步证实脑缺血后VEGF的表达水平是上调的,且经过药物干预后VEGF的表达水平明显增高(见图3)。术后21 d从上述3区域的VEGF免疫组化光密度值(IOD)可知,干预21 d组与干预14 d组存在显著的差异性:①海马区,干预21 d(391.64±11.47)与干预14 d(359.24±12.38)比较(P<0.01);②皮质区,干预21 d(689.37±41.38)与干预14 d(628.56±35.63)比较(P<0.01);③纹状体区,干预21 d(681.67±23.64)与干预14 d(616.89±11.34)比较(P<0.01),说明CIT药物干预的效果随着时间的推移呈现逐步增强的趋势。

图2 大鼠缺血侧VEGF的阳性表达Fig.2 VEGF positive expression levels of rats in ischemia side
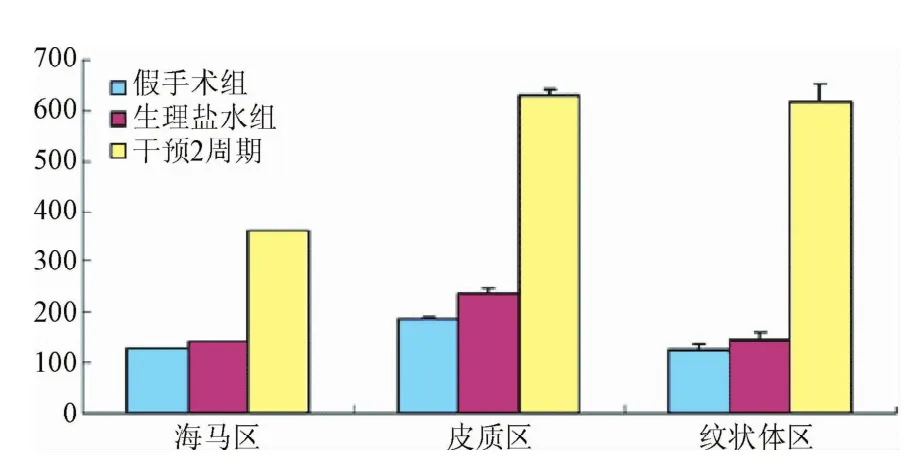
图3 脑缺血14 d大鼠VEGF免疫组化阳性IOD分析图Fig.3 IOD graph of immunohistochemical assay of VEGF in rats with cerebral ischemia for 14 d
2.5 蛋白质印迹分析法测定各组大鼠脑组织中VEGF表达 Western blot结果显示:术后14 d的大鼠假手术组、生理盐水组和干预14 d组3组间的蛋白条带灰度值存在明显差异;生理盐水组和干预14 d组显著高于假手术组(P<0.01),干预14 d组显著高于生理盐水组(P<0.01)。干预21 d组的蛋白条带灰度值与干预14 d组相比差异存在统计学意义(P<0.01,见图4)。结果表明:CIT药物对脑缺血后VEGF蛋白表达有明显上调作用,CIT药物干预后可增加大鼠缺血区的脑组织中VEGF的含量,并随着用药时间延长而增加。
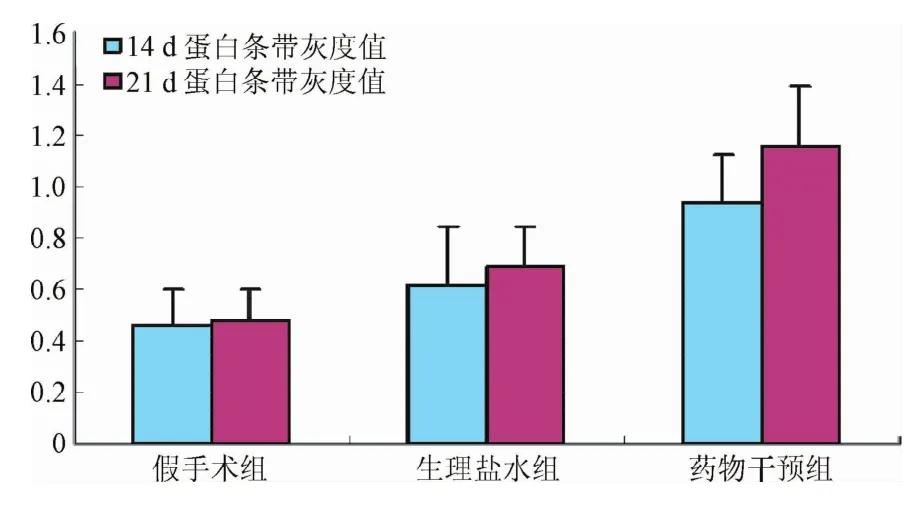
图4 蛋白印迹法检测各组大鼠缺血区脑组织VEGF蛋白表达水平分析图Fig.4 Diagram of expression levels of VEGF protein in cerebral ischemia tissues by Western blot
3 讨论
脑缺血后脑组织中的血管新生对脑神经的保护及修复,有十分重要的作用[5-6]。在脑缺血早期,病灶周边区域尚存在“缺血半暗带”,这时如果能够及时恢复血供,可在一定程度上逆转缺血半暗带内神经元的损伤,将脑缺血性损伤降低到最低点[7-8]。目前,众多研究者瞄准脑缺血后血管新生机制及有效的调控手段,力求寻找新的治疗药物和干预措施以促进脑缺血后的血管新生,尽最大可能来恢复患者神经缺失功能,提高患者生存质量[9-14]。本课题观察发现,动物造模后的14~21 d,CIT干预组大鼠脑缺血病灶边沿清晰,脑表面浅表血管分支明显增加,而且这些血管分支都向脑缺血病灶部位汇聚,并可见一部分血管分支跨越缺血病灶表面,这说明CIT对脑缺血性病灶的吸收愈合和脑缺血后重建血管网有促进作用。
本研究结果显示:CIT药物干预后通过促进血管发生,可以有效地改善急性脑缺血再灌注大鼠损伤的神经功能。在大鼠造模2 d时测评各组大鼠的mNSS分数可知,除假手术组大鼠出现轻微的神经功能缺损外,生理盐水组、干预14 d组和干预21 d组大鼠均出现明显的神经功能缺损,但伴随时间的推移,3组大鼠神经功能缺损均有不同程度恢复;大鼠造模14 d测评,干预14 d组和干预21 d组大鼠的神经功能评分分数下降较快,损伤程度相对较轻;而生理盐水组大鼠的神经功能评分分数较高,损伤程度较重。说明CIT药物干预对脑缺血再灌注大鼠神经功能的恢复十分明显,而且药物干预的效果随着时间的推移逐步增强。为进一步探索其机制,检测了血浆VEGF水平和脑缺血区三维血管成像,结果显示2个干预组大鼠的血管密度明显增加,血流恢复较快,而生理盐水组的血管密度与2个干预组相比有很大差异;同时,干预21 d组比干预14 d组恢复效果更好,2组间差异有统计学意义(P<0.01)。这表明,CIT可以促进缺血区大脑的血管新生,且药物干预的效果随着时间的推移而逐步见效,这可能与脑缺血区域的微环境能够促进血管内皮细胞的迁移和存活并分化形成新生血管有关。因此推测,CIT可以有效地减轻缺血性神经元损害,促进缺血诱导的神经-血管单元的形成,有效地分泌神经营养因子和促进血管新生的因子,促进缺血区脑组织的血管新生以及神经修复,从而改善神经功能状况。
在动物实验中,本课题研究运用mNSS测评、三维共聚焦血管成像、免疫组化染色、蛋白质印迹分析等方法观察发现:对脑缺血再灌注大鼠采取草酸艾司西酞普兰药物干预后,其脑组织VEGF表达水平明显增高,新生血管密度增加,并且通过比较造模后14 d与21 d不同时间点的药物干预效果,发现药物干预的效果随着时间的推移而逐步见效,证明CIT能够发挥脑缺血后促进血管新生和神经保护作用。
[1] Birmingham K.Future of nettro protective drugs in doubt[J].Nat Med,2002,8(1):5.
[2]Sweeney MI.Neuroprotective effects of adenosine in cerebral ischemia:window of opporttmity[J].Neurosci Biohehav Rev,1997,21(2):207-217.
[3]Lim CM,Kim SW,Park JY,et al.Fluoxetine affords robust neuroprotection in the postischemic brain via its anti-inflam-matory effect[J].neurosci Res,2009,87(4):1037-1045.
[4]Narushima K,Paradiso S,Moser DJ,et al.Effect of antidepressant therapy on executive function after stroke[J].Br JPsy-chiatry,2007,190(1):260-265.
[5]Joshua G,Mounira B,et al.Vascular endothelial growthfactorsignaling is required for the behavioral actions of antidepressant treatment:pharmacological and cellular characterization[J]. Neuropsychopharmacology,2009,34,(11):2459-2468.
[6]Nowacka MM,Obuchowicz E.Vascular endothelial growth factor (VEGF)and its role in the central nervous system:a new element in the neurotrophic hypothesis of antidepressant drug action[J]. Neuropeptides.2012,46(1):1-10.
[7]Longa EZ,Weinstein PR,Carlson S,etal.Reversiblemiddle cerebral artery occlusion without cranietomy in rats[J].Stroke,1989,20(1):84-91.
[8]Brambrink AM,Koerner IP,Dichl K,eta1.The antibiotic Erythromycin induces tolerce against transient globaloerebral ischemia in rats[J]. Anesthesiology.2006,104(6):1208-1215.
[9]Kasper S,Baldwin DS,Larsson lonn,et al.Superiority of escitalopram to paroxetine in the treatment of depression[J].European Neuropsychopharmacology2009,19(4):229-237.
[10]Megan M Burns,David A Greenberg.Antidepressants in the treatment of stroke[J].Expert Rev.Ne-urother.2010,10(8):1237-1241.
[11]Kim DH,Li H,Yoo KY,et al.Effects of fluoxetine on ischemic cells and expressions in BDNF and some antioxidants in the gerbil hippocampal CA1 region induced by transient ischemia[J]. Exp.Neurol.204(2):748-758.
[12]Lim CM,Kim SW,Park JY,et al.Fluoxetine affords robust neuroprotection in the postischemic brain via its anti-inflammatory effect[J].Neurosci.Res.2009,87(4):1037-1045.
[13]Krupinski J,Stroemer P,Slcvin M,et a1.Three-dimensional slructure and survival of newly blood vessels after focal cerebral ischemia[J]. Neuroreport,2003,14(8):1171-1176.
[14]Lu CZ,Xiao BG.G-CSF and neuroprotection:a therapeutic perspective in cerebral ischemia[J].Biochem Soc Trans,2006,34(6):1327-1333.
(编校:吴茜)
Neuroprotective effect of escitalopram oxalate on cerebral ischem ia reperfusion injury in rats
ZHANG Jian-bin1,LIXiao-hui2
(1.Department of Neurology,Heji Hospital Affiliated of Changzhi Medical College,Changzhi046011,China;2.Department of Neurological Rehabilitation,Heji Hospital Affiliated to Hospital of ChangzhiMedical College,Changzhi046000,China)
ObjectiveTo explore neuroprotective effect of escitalopram oxalate on cerebral ischemia reperfusion in injury rats and its possible mechanism,thus provide experimental evidence for the use of the drug in the clinical treatment of ischemic cerebrovascular disease.Methods160 male rats of SD were selected and randomly divided into three groups:sham operation group(Sham group),negative control group(NS group),intervention group(CIT group,for 14 days and 21 days).Focalmiddle cerebral artery occlusion model(MCAO)of ratswere constructed.Neurological deficitof rats in each group were evaluated bymodified neurological severity score(mNSS)scale.Microvessel diameter,density,and total area ofeach group angiogenesis in cerebral ischemic area were observed by Laser cofocal technology after 14 days and 21 days at different time points;the plasma concentrations of VEGF were detected by ELASA,and expression levels of VEGFwere detected by immunohistochemical assay and Western blot in each group,to explore its possiblemechanism ofmolecular biology.ResultsAftermodeling,neurological deficit of intervention group for 14 days and 21 days were improved significantly.The indicatorswere as follows:scores ofmNSS in NS group(6.57±1.13)was significantly higher than(4.39±0.92)in intervention group for 14 days(P<0.05);scores ofmNSS in intervention group(3.23±0.55)for21 dayswas significantly lower than(4.14±0.74)in intervention group for 14 days(P<0.01).Confocal3D imaging results after14 days showed:microvascular total area was significantly lager which illustrated that the effect of drug intervention for 14 days started to work over time.Plasma concentrations and expression levels of VEGF in intervention group for 14 days and 21 days were higher than those in Sham group,NSgroup.VEGF protein expression of cerebral ischemia tissues in intervention group for21 dayswere higher than that of 14 days(P<0.01).ConclusionEscitalopram oxalate could significantly reduce cerebral ischemia and reperfusion in rats nerve injury and improve neurological function,which has a neuroprotective effect,the effect of drug intervention gradually increases over time,and the possible mechanism of which is related to angiogenesismediated by VEGF.
escitalopram oxalate;cerebral ischemia;neuroprotective;vascular endothelial growth factor
张建斌,男,硕士,副教授,研究方向:脑血管病的诊断和治疗,E-mail:qch1821460113@163.com。
R743.3
A
1005-1678(2014)07-0009-05
山西省高校科技项目(200713024)

