山竹提取物有效成分测定及其多糖组成分析
杨 青 赵丽君 周大江 高瑞希 杨光忠 李 竣
1.湖北省枣阳市第一人民医院药剂科,湖北枣阳 441200;2.中南民族大学药学院,湖北武汉 430074
山竹(Garcinia mangostana L.)为藤黄科(Guttirae)山竹子属药食两用水果,广泛分布于马来西亚、缅甸、泰国等东南亚国家,现已有大量栽培。山竹果中富含黄酮、多糖、蛋白质和脂类等化合物,是我国傣族及东南亚国家常用的传统药用植物。山竹果实主要化学成分为呫吨酮化合物[1],现代药理学表明山竹果实具有抗炎、抗菌、抗氧化等多种生物活性[2],山竹果皮中存在的氧杂蒽酮类化合物具有对脂肪酸合酶 (FAS)全反应的抑制作用[3]。杨连珍[4]发现山竹果(7周成熟期)中3种含异戊二烯基均含有一种对人类癌细胞具有一定抗性的成分。有研究发现山竹能够加速豚鼠的皮肤创面愈合,重造创面上皮化[5]。山竹对烧伤的创面有一定的抑菌作用,同时减轻表面液体渗出,促进伤口愈合的作用[6-8]。研究表明山竹子根乙醇提取物对细胞分泌HBsAg、HBeAg有抑制作用[9]。通过对岭南山竹子药用的研究发现,岭南山竹子对小鼠热板致痛、辐射热甩尾反应和化学致痛有明显的抑制作用,可明显减少小鼠自主活动;对二甲苯所致小鼠耳部肿胀以及对大鼠蛋清性足肿胀和棉球肉芽肿有明显的抑制作用[10]。对山竹子根皮进行抗寄生虫活性成分研究表明,发现其具有中等抗恶性疟原虫与布氏锥虫的活性,显示较强的选择性抗寄生虫活性和细胞毒性[11]。山竹果皮提取的总黄酮对羟自由基、超氧阴离子自由基具有清除作用,并能有效地清除亚硝酸盐和阻断亚硝胺的合成,清除体内亚硝酸盐和阻断亚硝胺的合成是防治癌症的有效途径[12]。戴聪杰等[13]采用化学分析方法对山竹的水分、灰分、粗蛋白、粗脂肪、水解氨基酸和碳水化合物等成分的含量进行测定,研究显示山竹的营养非常丰富,是很有发展前途的营养食品资源。同时研究显示山竹提取物具有很好的美白、保湿、抗衰老的功效[14]。为了更好地使用和开发山竹药用价值,本研究测定了山竹新鲜果肉提取物中的多糖、蛋白质含量及果品提取物中总黄酮的含量,分析了果肉中多糖的组成成分,为山竹的产业化开发提供一定的理论依据。
1 仪器与试药
1.1 试剂
牛血清蛋白及考马斯亮蓝G-250(超级纯,广州微佳科技有限公司),D-葡萄糖 (98.0%,Aladdin industrial Corporation),芦丁(中国药品生物制品检定所,批号 10080-200707),标准单糖(Sigma 公司),三甲基氯硅烷,六甲基二硅醚烷,吡啶,三氟乙酸,硼氢化钠,氢氧化钠,95%乙醇(工业),浓硫酸、苯酚、亚硝酸钠、硝酸铝等所用试剂均为分析纯。
1.2 材料
山竹于2010年9月购于武汉沙湖水果批发市场,经中南民族大学药学院李竣副教授鉴定为Garcinia mangostana L.的果实,提取物供试品由中南民族大学药学院制备。
1.3 仪器
紫外可见分光光度计(UV-1800UV美谱达),气相色谱仪(6890N Network GC System ,美国 Agilent),旋转蒸发器RE-52(上海亚荣生化仪器),真空干燥箱(XMTD-8222型,上海精宏实验设备),恒温干燥箱(上海索谱仪器),超低温冷冻储存箱(中科美菱),低速离心机(TD25型,长沙平凡仪器仪表),冷冻干燥机(FD-1B-50型,北京博医康实验仪器),旋转蒸发仪R-1001M型(郑州长城),循环水式多用真空泵SHB-Ⅲ(郑州长城),恒温水浴锅(郑州长城),超声波清洗器KQ-500E(昆山市超声仪器),硅胶板试剂(青岛海洋化工厂),电子天平AB265-S型,电子天平AR2140型(上海奥豪斯仪器)。
2 方法与结果
2.1 提取工艺流程
取新鲜山竹果皮干燥粉碎后的6.4 kg,用95%乙醇各回流提取3次,每次2 h,合并提取液减压浓缩得到山竹果皮提取物。取新鲜的山竹果肉854 g分别依次用95%乙醇提取1次,蒸馏水回流提取3次,每次2 h,合并蒸馏水提取液,减压浓缩得到山竹果肉提取物。
2.2 山竹果肉提取物多糖含量的测定[15]
2.2.1 对照品溶液的制备 精密称取干燥至恒重的葡萄糖50 mg,加蒸馏水溶解定容至0.1 mg/mL,即得对照品溶液。
2.2.2 供试品溶液的制备 精密称取干燥的山竹果肉提取物适量,至100 mL容量瓶,加蒸馏水至刻度,摇匀即得供试品溶液。
2.2.3 苯酚溶液的制备 称取苯酚6 g至100 mL容量瓶,加蒸馏水至刻度,摇匀即得苯酚试剂。
2.2.4 最大检测波长的选择 分别取对照品溶液和供试品溶液1 mL至10 mL具塞玻璃试管中,加苯酚溶液0.5 mL,振摇,迅速加入浓硫酸5 mL,振摇后放置15 min。待冷却后,紫外分光光度计上做全波长扫描,得到最大吸收波长λmax为480 nm,确定480 nm为检测波长。
2.2.5 标准曲线的绘制 精密量取对照品溶液1、2、3、4、5 mL,分别加蒸馏水定容至10 mL容量瓶中。摇匀各取1 mL,以下操作按“2.2.4”项下方法显色。在480 nm波长下测定吸光度,求得标准曲线性方程为y=17.0888x+0.0108,r=0.9980,提示该溶液在 0.01~0.05 mg/mL范围内线性关系良好。
2.2.6 精密度试验 取0.05 mg/mL的对照品溶液按“2.2.4”项下方法显色,结果显示RSD为0.226%(n=6)。
2.2.7 重复性试验 取同一批次供试品溶液,按“2.2.4”项下方法显色,结果显示RSD为2.85%(n=6)。
2.2.8 稳定性试验 取同一批次供试品溶液,按“2.2.4”项下方法显色,分别在显色 0、5、10、20、30、40 min 后测定吸光度值,RSD为2.87%,结果表明显色后40 min内测定测定无显著性差异,为保证准确性测定的时间选择在30 min内完成。
2.2.9 回收率试验 精密吸取葡萄糖对照品溶液6份,分别加入不同量的已知多糖含量的供试品液,以下操作按“2.2.4”项下方法进行。结果见表1。
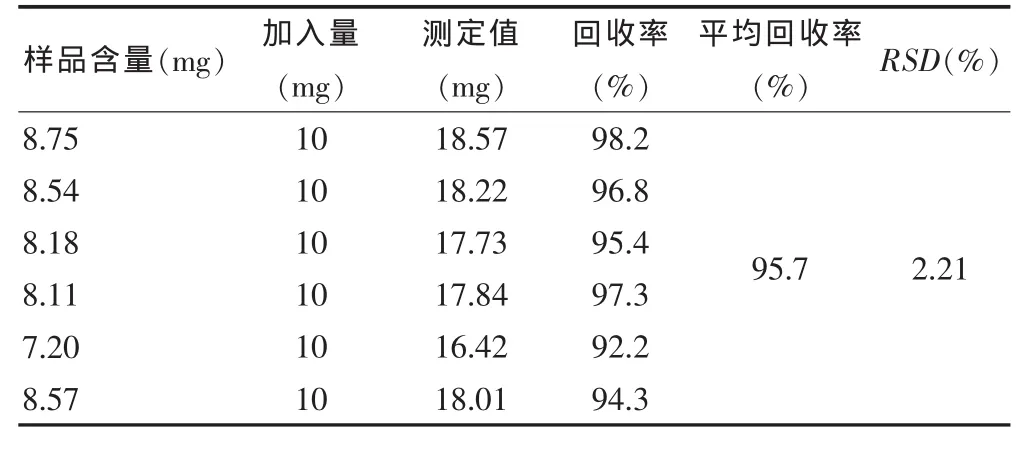
表1 山竹果肉多糖加样回收率(n=6)
2.2.10 供试品含量测定 取果肉提取物供试品溶液,按“2.2.4”项下方法进行,山竹果肉提取物中多糖含量,结果见表2。
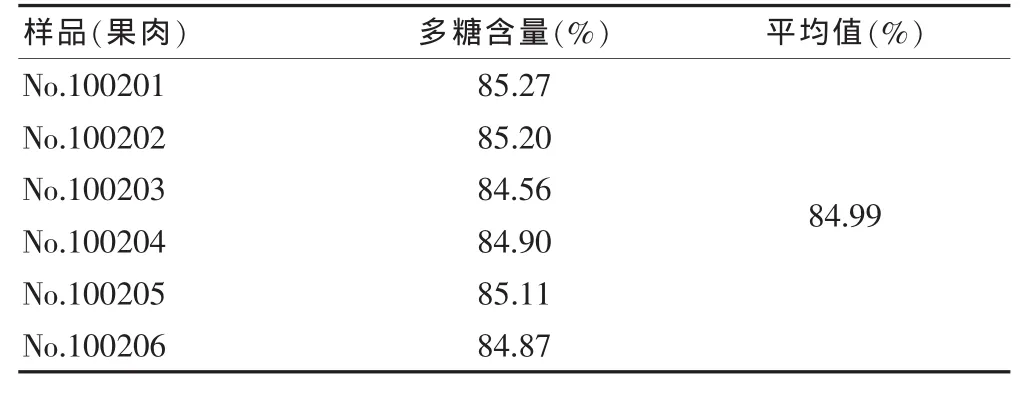
表2 山竹果肉提取物多糖含量(n=3)
2.3 山竹果肉提取物蛋白质含量的测定[16]
2.3.1 对照品溶液的制备 精密称取250 mg牛血清蛋白(BSA),加生理盐水制成浓度为0.1 mg/mL的溶液,即得对照品溶液;精密称取50 mg考马斯亮蓝G-250至500 mL容量瓶中,加入25 mL 95%乙醇﹑50 mL 85%磷酸,振摇溶解,生理盐水定容得考马斯亮蓝溶液。
2.3.2 供试品溶液的制备 精密称取干燥的山竹果肉提取物适量,至250 mL容量瓶,加蒸馏水至刻度,摇匀即得供试品溶液。
2.3.3 最大检测波长的选择 分别取对照品溶液和供试品溶液1 mL,加考马斯亮蓝溶液5 mL,摇匀,静置2 min。紫外分光光度计上做全波长扫描,得到最大吸收波长λmax为590 nm,确定590 nm为检测波长。
2.3.4 标准曲线的绘制 精密量取对照品溶液0、0.8、1.4、2.0、2.6、3.2 mL,分别加蒸馏水定容至 10 mL 容量瓶中。摇匀各取1 mL,以下操作按“2.3.3”项下方法显色。在590 nm波长下测定吸光度,求得标准曲线性方程为y=25.0039x+0.0496,r=0.9997,提示该溶液在0.008~0.032 mg/mL范围内线性关系良好。
2.3.5 精密度试验 取0.01 mg/mL的对照品溶液按“2.3.3”项下方法显色,结果显示RSD为0.29%(n=6)。
2.3.6 重复性试验 取同一批次供试品溶液,按“2.3.3”项下方法显色,结果显示RSD为2.79%(n=6)。
2.3.7 稳定性试验 取同一批次供试品溶液,按“2.3.3”项下方法显色,分别在显色 0﹑5﹑10﹑15﹑20﹑25﹑30 min后测定吸光度值,RSD为3.21%,结果表明显色后30 min内测定测定无显著性差异,为保证准确性测定的时间选择在20 min内完成。
2.3.8 回收率试验 精密吸取BSA对照品6份,分别加入不同量的已知含量的供试品液,以下操作按“2.3.3”项下方法进行,结果见表3。
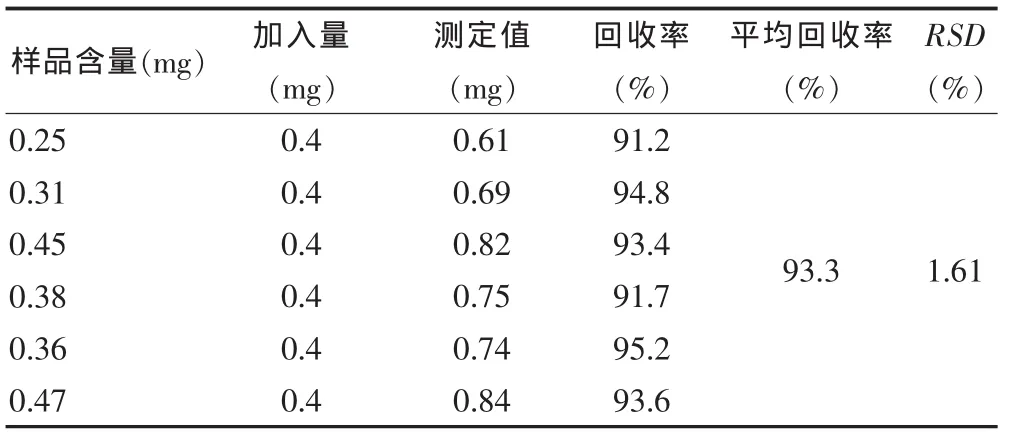
表3 山竹果肉提取物蛋白质加样回收率(n=6)
2.3.9 供试品含量测定 取山竹果肉提取物供试品溶液,按“2.2.4”项下方法进行,山竹果肉提取物中蛋白质含量,结果见表4。
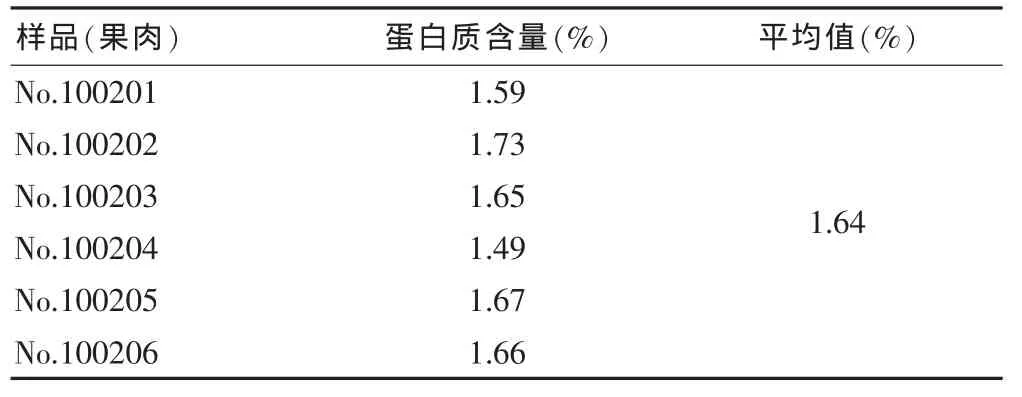
表4 山竹果肉提取物中蛋白质含量(n=3)
2.4 山竹果皮提取物总黄酮含量的测定[17]
2.4.1 对照品、供试品溶液的制备 取芦丁对照品10 mg,用95%乙醇溶解,并定容至100 mL,即得0.1 mg/mL对照品溶液,精密称取山竹果皮提取物于100 mL容量瓶中加95%乙醇溶解定容即得供试品溶液。配制5%NaNO3溶液,10%Al(NO3)3溶液,20%NaOH 溶液。
2.4.2 最大检测波长的测定 分别取对照品溶液和供试品溶液4 mL,置于25 mL容量瓶中,加5%NaNO3溶液 1 mL,摇匀放置 6 min,加 10%Al(NO3)3溶液 1 mL,摇匀放置6 min,加20%NaOH试液10 mL,再加蒸馏水定容,摇匀放置15 min,以95%乙醇为空白参比。紫外分光光度计上做全波长扫描,得到最大吸收波长λmax为500 nm,确定500 nm为检测波长。
2.4.3 校准曲线的绘制 精密量取对照品溶液0、1.0、2.0、3.0、4.0、5.0、6.0 mL,分别加蒸馏水定容至 10 mL容量瓶中。摇匀各取1 mL,以下操作按“2.4.2”项下方法显色。在500 nm波长下测定吸光度,求得标准曲线性方程为y=9.3890x+0.0307,r=0.9971,提示该溶液在0.02~0.06 mg/mL范围内线性关系良好。
2.4.4 精密度试验 取对照品溶液按“2.4.2”项下方法显色,测定吸收度值连续测定6次,RSD=0.328%(n=6)。
2.4.5 重复性试验 取同一批号的供试品(批号100105)制备6份供试品溶液,按“2.4.2”项下方法操作显色,测定吸收度值RSD=3.14%(n=6)。
2.4.6 稳定性试验 取对照品试液按“2.4.2”项下方法操作显色,在显色10、20、30 min后测定吸收度值,结果表明显色后30 min内测定测定无显著性差异,为保证准确性测定的时间选择在20 min内完成。
2.4.7 回收率试验 精密吸取芦丁对照品6份,分别加入不同量的已知含量的供试品液,以下操作按“2.4.2”项下方法进行,结果见表5。
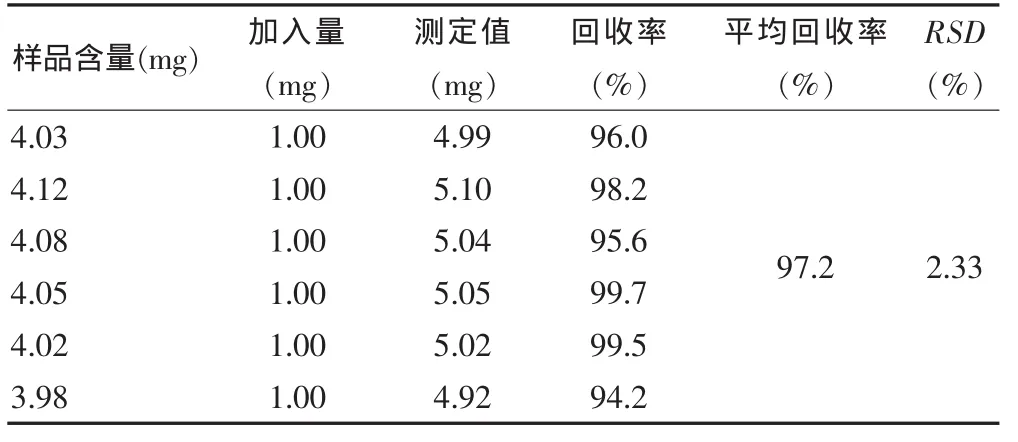
表5 山竹果皮提取物总黄酮加样回收率(n=6)
2.4.8 供试品含量的测定 取山竹果皮提取物供试品溶液,按“2.4.2”项下方法进行,山竹果皮提取物中总黄酮含量,结果见表6。
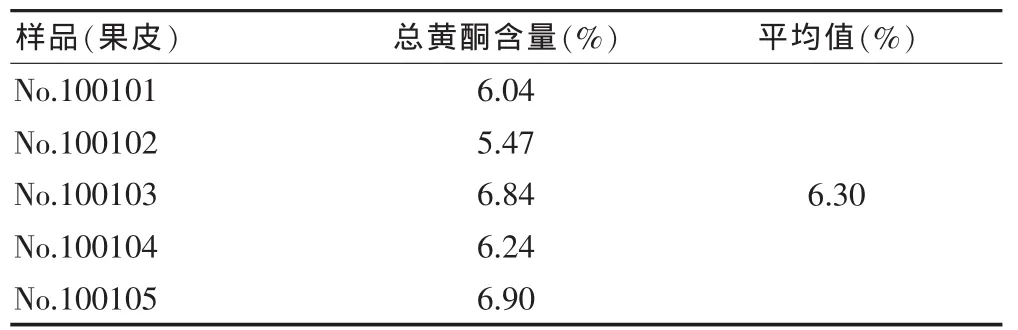
表6 山竹果皮提取物总黄酮含量(n=3)
2.5 山竹果肉提取物多糖成分分析
2.5.1 多糖提取 称取15 g山竹果肉提取物,加蒸馏水150 mL,于90℃水浴加热2.5 h,离心过滤。滤液用Sevage 试液(氯仿∶正丁醇=4∶1,体积比)按 1∶5 充分混匀,振荡25 min,4000 r/min离心15 min,收集上清液,重复处理至氯仿与水层间无胶状物产生。加入无水乙醇至醇浓度为70%,4℃静置12 h,过滤,冷冻干燥得较纯多糖[18-19]。
2.5.2 多糖水解,单糖还原 取0.5~1.0 mg多糖溶解在1 mL 4 mol/L的三氟乙酸(TFA)中,充氮气加盖密封,100℃水解4 h,用氮气除水。水解糖样溶于0.5 mL 0.05 mol/L氢氧化钠溶液,加5~10 mg硼氢化钠,在60℃还原1 h,加乙酸至无气泡逸出。将产物冷冻干燥,加1 mL甲醇并振荡溶解,用氮气除甲醇,反复5次除去硼酸根。产物在含有五氧化二磷的真空干燥箱中干燥5 h。
2.5.3 单糖甲基化,气相色谱分析 干燥产物加1 mL 4A分子筛干燥的吡啶,振荡溶解,再依次加入0.5 mL六甲基二硅醚烷,0.2 mL三甲基氯硅烷,振荡,混合均匀,置4℃冰箱反应12 h,产物用离心机离心8 min(4000 r/min),取上清液进行气相分析。气相色谱条件为:HP-5 石英毛细管色谱柱(30 m×0.32 mm,0.25 μm),程序升温范围130~290℃,每分钟升高10℃,进样口温度 295℃,载气氮气流速 1.0 mL/min,分流比 50∶1,检测器温度300℃。在此方法下对各单糖(图1)和提取物多糖(图2)进行检测并得到相关气相色谱图。各单糖、提取物多糖气相色谱图分别见图1、2。
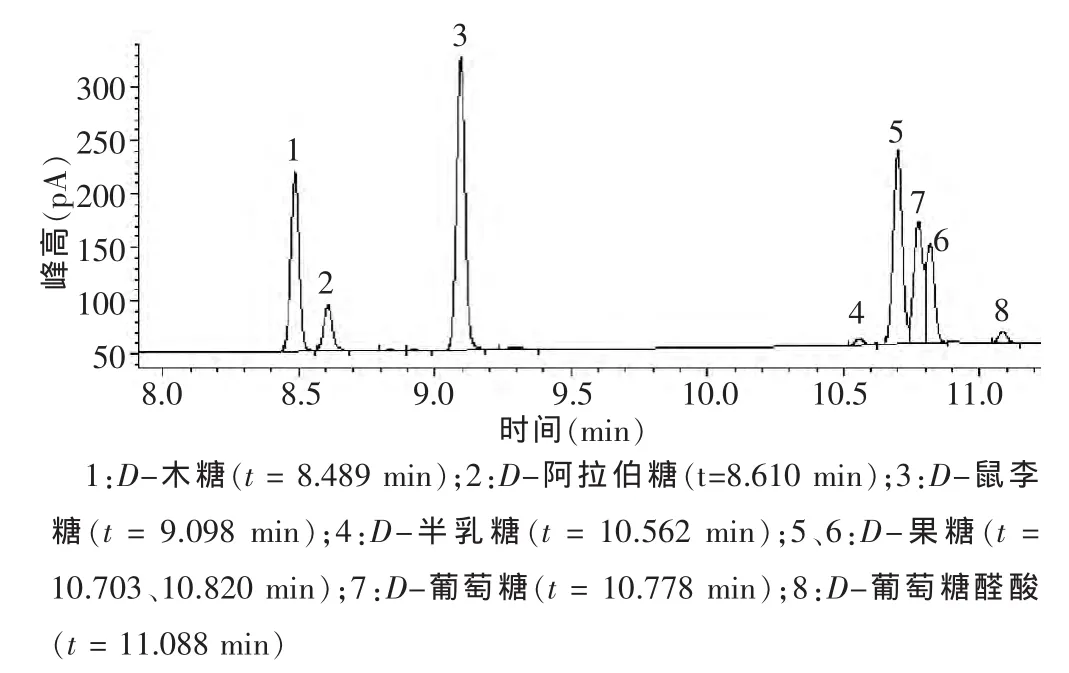
图1 单糖混合液气相色谱测定结果
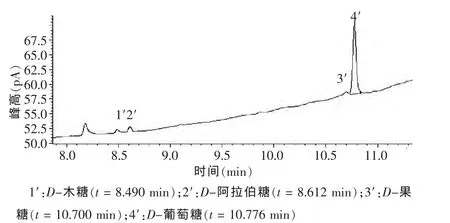
图2 山竹多糖气相色谱测定结果
2.5.4 标准单糖和提取物多糖气相色谱 将标准单糖和多糖分别进样进行气相分析,结果见表7、8。其中气相色谱的保留时间可以确定单糖种类,色谱峰面积可以估算单糖含量。从表7显示的结果说明,7种单糖保留时间主要集中在8~11 min,部分色谱峰还未达到基线的分离,果糖因其结构的变化产生两个信号,其他单糖均为一个信号。

表7 各单糖气相色谱分析结果
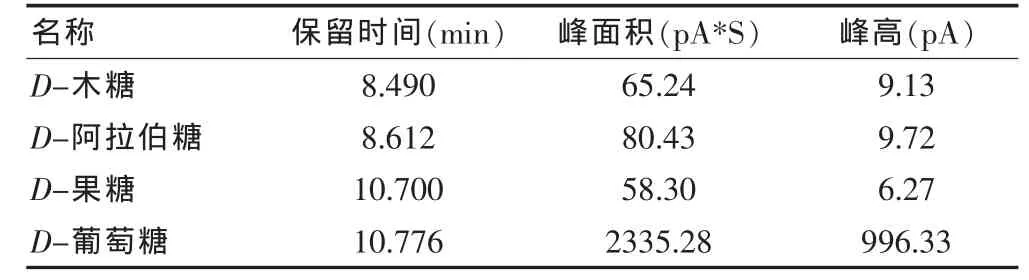
表8 山竹果肉提取物多糖气相色谱结果
从图1、2可明确看出山竹果肉提取物多糖结果中的D-木糖、D-阿拉伯糖、D-果糖、D-葡萄糖与各单糖相对应,结合表7和表8保留时间表明山竹果肉提取物多糖由D-木糖、D-阿拉伯糖、D-果糖、D-葡萄糖组分,摩尔比为 1.34∶1.66∶1.00∶40.06。
3 讨论
通过文献的调研发现,对山竹提取物质量的研究,总黄酮含量的测定主要集中在果皮,多糖和蛋白质等的含量测定集中在果肉,笔者前期分别对山竹果皮提取物中多糖和蛋白质含量以及果肉中总黄酮含量进行测定,测定结果表明山竹果皮提取物中多糖含量为27.12%,蛋白质含量为4.84%,山竹果肉提取物中总黄酮含量为0.39%。与本研究中含量测定结果相比较,果肉提取物中多糖含量远大于果皮提取物,而果皮中富含有黄酮类成分。
本实验用苯酚-硫酸法测定山竹果肉提取物的含糖量,该法反应迅速完全,产生的有色物质稳定准确率较高,并且显色反应与多糖浓度存在定量关系,简便快速,灵敏易行,可以用于多糖的含量测定。实验过程中,854 g新鲜的山竹果肉可以得到多糖提取物131 g,测定多糖含量为84.99%,换算新鲜山竹果肉中含糖量为13%。用NaNO3-Al(NO3)3的方法测定总黄酮的含量,并且精密度良好在30 min内稳定,在20 min内完成测定,此法方便可行可以用于山竹总黄酮含量的测定。
实验采用气相色谱法将山竹果肉提取物多糖进行了分析,山竹果肉提取物多糖由D-葡萄糖、D-木糖、D-阿拉伯糖和D-果糖组组成,摩尔比为1.34∶1.66∶1.00∶40.06。有一种单糖因单糖对照品有限未有确定,从各种单糖摩尔比例可以看出山竹果肉提取物多糖是由葡萄糖为主的葡聚糖组成的杂多糖,具体的链接方式还需要更多的实验数据予以证实。
[1]赵骁宇,徐增,蓝文健,等.山竹的化学成分及其呫吨酮类化合物的药理作用研究进展[J].中草药,2013,44(8):1052-1061.
[2]吴海强.山竹果皮化学成分及其生物活性的研究[D].厦门:厦门大学,2013.
[3]权小芳,马晓丰.氧杂蒽酮对脂肪酸合酶的抑制作用及构效分析[J].中国科学院研究生院学报,2012,29(6):841-846.
[4]杨连珍.从山竹子幼果中提取含异戊二烯基原料[J].世界热带农业信息,2006,(12):47.
[5]廖红,陈纡,黄双红,等.山竹子对表皮作用的实验研究[J].实用中西医结合杂志,1997,10(5):415-416.
[6]林源,黄安林,廖红,等.山竹子粉治疗烧伤36例临床观察[J].广西医科大学学报,1996,13(3):71-72.
[7]廖红,杨永瑾,陈纡,等.山竹子烧伤散抑菌作用分析[J].广西医学院学报,1992,9(2):39-40.
[8]罗建设.山竹子粉治疗烧伤及表浅创面56例报告[J].右江民族医学院学报,2003,(6):845-846.
[9]余宙耀,陈文吟,郑业华.山竹子根乙醇提取物的体外抗HBV 作用[J].中药材,1999,22(3):142-143.
[10]郑作文,林启云,方虹.岭南山竹子的镇痛消炎作用[J].广西中医药,1994,17(5):45-47.
[11]王瀛惠摘,孙铁民校.李氏山竹子根皮中的吨酮及双黄酮类化合物的抗寄生虫活性[J].国外医药:植物药分册,2007,22(3):117.
[12]王晓波,李金芳,王梅,等.山竹壳总黄酮抗氧化及抑制亚硝化作用研究[J].食品研究与开发,2013,34(6):9-13.
[13]戴聪杰,黄雅琼.榴莲和山竹果肉的营养分析[J].食品与机械,2012,28(1):65-67.
[14]金家宏,陈明华,夏增华.一种含有水果提取物混合物的皮肤外用剂组合物[P].中国,CN103393577A.
[15]辛敏,刘轩,詹欣,等.硫酸一紫外法与苯酚一硫酸法测定千两茶中总多糖的比较[J].中国实验方剂学杂志,2014,20(3):62-65.
[16]张波,刘红燕,李佳,等.基于植株性别差异的天花粉多糖、蛋白质含量比较[J].中国药师,2014,17(4):617-619.
[17]张明,陈华国,赵超,等.杠板归中总黄酮的含量测定研究[J].中国实验方剂学杂志,2012,18(18):70-73.
[18]高瑞希,李竣,柴万鹏,等.松茸多糖成分分析[J].华中师范大学学报:自然科学版,2013,47(5):658-660.
[19]熊慧薇,戴书浩,闵华,等.GC分析大豆和麦麸膳食纤维中的单糖成分[J].食品研究与开发,2014,35(2):84-86.

