小鼠角膜上皮祖细胞系TKE2的表型研究
瞿杨洛娃 林辉 耿志鑫 何卉 刘祖国 李炜
角膜上皮干细胞位于角膜缘上皮基底细胞层,是角膜上皮细胞再生的唯一来源,对维持正常眼表状态具有重要作用。眼表化学伤、热烧伤、Stevens-Johnson综合征等疾病常导致角膜上皮干细胞缺乏,严重影响视力[1]。研究角膜上皮干细胞增殖与分化的机制对认识角膜上皮干细胞生理以及角膜上皮干细胞缺乏的病理生理过程具有重要意义。Kawakita等[2]从CD-1小鼠中成功分离培养出小鼠角膜上皮祖细胞系TKE2,并采用此细胞系成功构建了组织工程角膜上皮,但该研究组没有对TKE2细胞分化前后的细胞表型进行深入观察。本研究拟采用不同条件培养TKE2细胞,观察TKE2增殖与分化状态下的细胞表型变化,为研究角膜上皮干细胞生理与病理生理奠定基础。
材料与方法
一、实验材料
小鼠角膜上皮祖细胞系TKE2由日本Keio大学Tetsuya Kawakita教授提供。主要试剂TrypLETMExpress Stable Trypsin Replacement Enzyme、KSFM无血清培养基、DMEM培养基、胎牛血清(FBS)、鼠源性上皮生长因子、鸡抗兔Alexa Fluor 488抗体、鸡抗羊Alexa Fluor 488抗体购自Invitrogen公司;DAB试剂盒、小鼠单克隆抗Ki67,P63,K10抗体购自DAKO公司;小鼠单克隆抗K14,K15,K16,PCNA抗体、羊多克隆抗K12、抗Connexin 43抗体购自Santa Cruze公司;ABC Kit、小鼠IgG购自Vectastain公司。
二、实验方法
(一)细胞培养
利用低钙无血清培养基KSFM培养TKE2细胞,待细胞融合70﹪~80﹪时,将TKE2细胞用1ml TrypLE Express酶37℃消化8min,观察到细胞变圆后,加入2ml KSFM培养基,轻轻吹打细胞,并将细胞悬液以1500 r/min离心5min,吸出上清液,用KSFM培养基重悬细胞,记数,以500/cm2密度接种于8孔培养板里,在5﹪CO2及37℃条件下培养,每3 d换液1次,并进行相差显微镜观察,待细胞达到50﹪融合时,部分换用高钙含血清培养基DMEM +10﹪FBS继续培养2 d后终止培养,进行免疫荧光和免疫组化实验。
(二)细胞鉴定
1.形态学观察:应用倒置相差显微镜观察TKE2细胞的大小,形态变化。
2.免疫细胞化学染色:将TKE2细胞用磷酸缓冲盐溶液(PBS)漂洗5min,4﹪多聚甲醛室温下固定20min,PBS漂洗。利用0.6﹪ H2O2处理10min,PBS漂洗。0.2﹪Triton X100透膜20min,PBS漂洗,2﹪牛血清白蛋白封闭1h,然后加PCNA和Ki67抗体,4℃过夜。PBS漂洗后加二抗,利用DAB试剂进行显色。用PBS终止显色反应并漂洗,若无阳性反应,则用苏木素染细胞核,然后进行梯度酒精脱水,中性树胶封片。
3.免疫细胞荧光染色:将TKE2细胞用PBS漂洗5min,4﹪多聚甲醛室温下固定20min,PBS漂洗后加入0.2﹪TritonX100透膜20min,PBS漂洗后加入2﹪牛血清白蛋白封闭1h,加入ABCG2,P63,K14,K15,K16,K10,K12,Connexin43抗体,4℃过夜。漂洗后加1﹪牛血清白蛋白配制的二抗,孵育1h,PBS漂洗后加入DAPI封片,荧光显微镜观察结果。
结 果
一、不同培养条件对TKE2细胞形态的影响
TKE2细胞在KSFM培养基中呈克隆样生长,细胞体积小,形态均一(图1a)。而当细胞在含血清培养基DMEM+10﹪ FBS中培养2 d,细胞明显增大,并且有梭形细胞出现(图1b)。
二、不同培养条件对TKE2细胞干细胞标识物表达的影响
角膜上皮干细胞表达P63,PCNA,ABCG2,Ki67等蛋白[1,3]。在无血清培养基KSFM中培养的TKE2克隆内所有细胞均呈P63,PCNA,Ki67,ABCG2的阳性染色,其中P63,PCNA和Ki67为胞核染色,ABCG2为胞浆染色(图2a-d)。在含血清培养基中培养的TKE2所有克隆内细胞P63,PCNA,Ki67,ABCG2的染色为阴性(图2f-g)。Connexin 43是角膜上皮细胞的分化标志物,表达在角膜缘基底上层细胞中,基底细胞中没有表达[4]。染色结果显示,无血清培养基和含血清培养基中培养的TKE2细胞均无Connexin 43染色 (图 2e、j)。
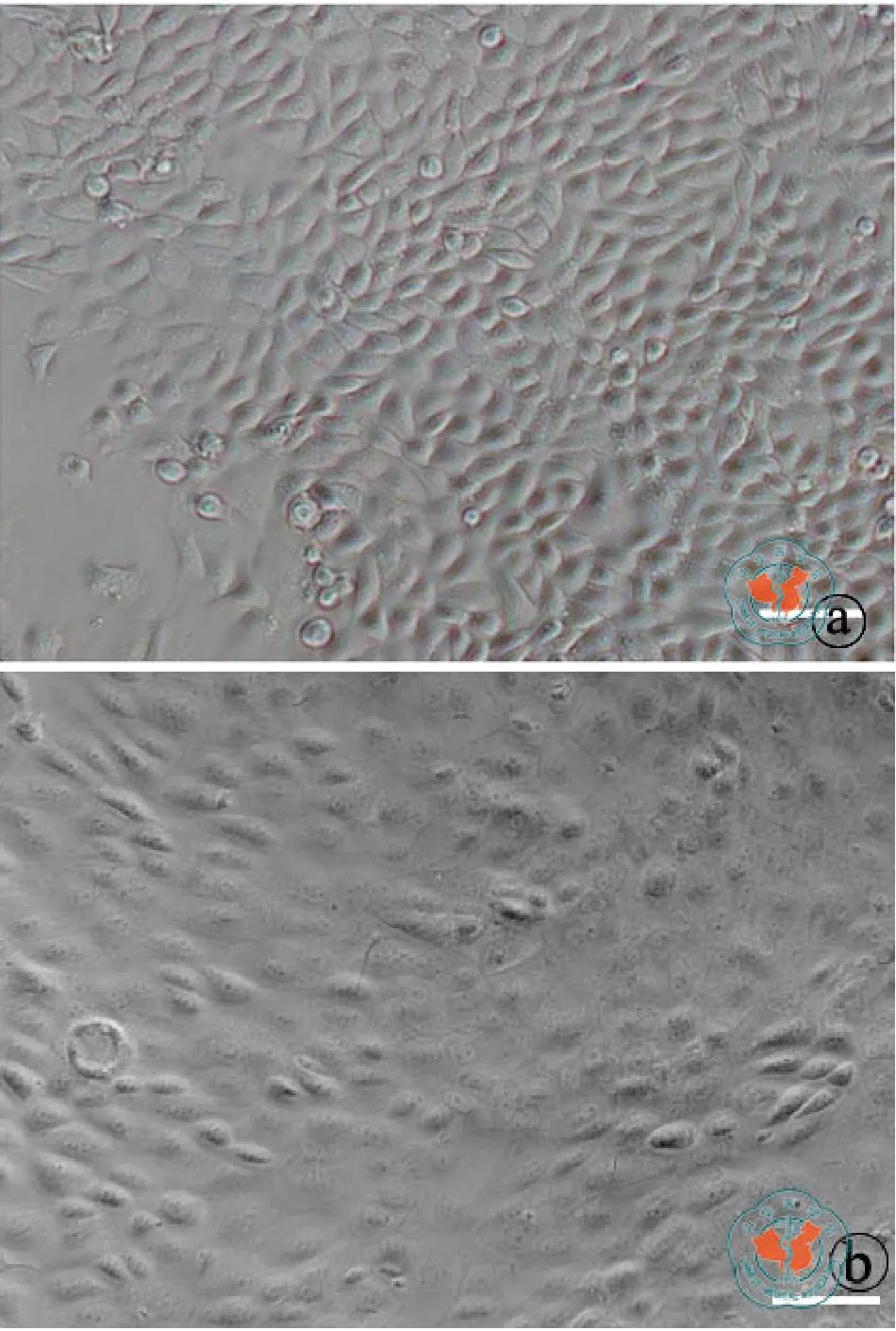
图1 不同培养条件对 TKE2 细胞形态的影响
三、不同培养条件对TKE2细胞角蛋白表达情况的影响
角蛋白14(K14)是复层上皮具有有丝分裂活性的基底细胞的标识物,表达于人、小鼠、大鼠角膜缘及中央角膜上皮的基底细胞中[5-6]。在本实验中,培养于无血清培养基KSFM中的TKE2的所有克隆内细胞均呈K14阳性染色(图3a),在小克隆中染色较强,在大克隆中周边细胞的染色要强于中央细胞的染色,而在含血清培养基中培养的TKE2克隆内仅有少量细胞阳性染色(图3f)。
角蛋白15(K15)表达在人和鼠角膜缘上皮的基底和基底上层细胞中,在鼠中央角膜上皮中K15没有表达[5]。在培养于无血清培养基KSFM中的TKE2克隆中,K15表现为散在的阳性细胞着色(图3b),在含血清培养基中培养的TKE2克隆内则没有K15阳性细胞(图3g)。
角蛋白16(K16)主要表达在复层上皮组织中有丝分裂能力的角化细胞中,标识具有高度增殖能力和非正常分化的细胞[7-8]。在KSFM培养基中,K16表达于所有克隆内,为克隆中央区片状着染(图3c),在含血清培养基中培养的TKE2克隆内,只有少量细胞呈K16阳性染色(图3h)。
角蛋白12(K12)标识终末分化的角膜上皮细胞,在正常角膜缘上皮基底细胞中没有表达,而表达于角膜缘上皮基底上层细胞以及中央角膜上皮全层细胞[7]。角蛋白10(K10)则标识分化后的表皮细胞,而在正常角膜缘及角膜上皮中没有表达。本实验结果发现,在无血清培养基和含血清培养基中培养的TKE2细胞均不表达 K12( 图 3d,i) 和K10(图 3e,j)。
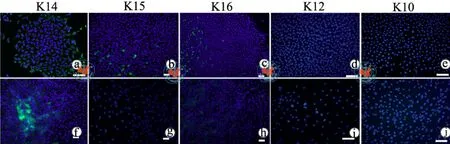
图3 不同培养条件对TKE2细胞角蛋白表达情况的影响
讨 论
Kawakita等[2]成功从CD-1小鼠的角膜缘上皮细胞中分离出小鼠角膜上皮细胞,他们发现将这些细胞低密度(500/cm2)接种于无血清低钙培养基KSFM可以形成均一的小细胞,进行传代培养,传第4代时可以形成克隆,而形成的克隆生长速度却不相同,平均倍增时间为31.3 h,他们将一个倍增时间为34.2h的克隆中的细胞定义为TKE2细胞。这个细胞系中单个的细胞如以低密度接种于低钙无血清KSFM培养基中培养,呈均一的小细胞形态,可形成克隆,克隆内的细胞表达P63,不表达K12及Connexin43。当在低钙无血清KSFM培养基中单纯加入5﹪FBS,0.9mmol/L的Ca2+,以及同时加入两者后,低密度接种的TKE2细胞出现细胞核变大,同时部分细胞失去P63阳性染色,而K12阳性细胞增多。因此,TKE2细胞在低钙无血清KSFM培养基中可以维持角膜上皮干细胞的特性,而在高钙或(和)含5﹪FBS的KSFM培养基中,TKE2可以分化成正常的角膜上皮细胞。
基于以前的报道,TKE2细胞有稳定增殖和分化成角膜上皮细胞的能力,本实验进一步观察TKE2细胞在增殖和分化状态下的角蛋白以及干细胞标志物表达情况。笔者发现培养于低钙无血清培养基中的TKE2细胞呈P63阳性染色,K12、Connexin43阴性染色,在含有10﹪胎牛血清的DMEM(含1.8mmol/L Ca2+)中培养2 d后,细胞明显增大,有梭形细胞出现,P63转为阴性,这与Kawakita在无血清培养基及高钙含血清培养基(5﹪ FBS+ 0.9mmol/L Ca2+)培养的TKE2的表型相符合。同时,本实验检测了其他细胞增殖及干细胞标识物PCNA、Ki67、ABCG2的表达情况。发现培养于低钙无血清培养基KSFM中的TKE2细胞均为PCNA、Ki67、ABCG2阳性染色,而在加入10﹪FBS的DMEM培养基中培养的 TKE2细胞的 PCNA、Ki67、ABCG2的染色均为阴性。但是在高钙含血清培养后,K12、Connexin43、K10的表达仍为阴性,可见在本实验的诱导条件下,TKE2的增殖能力虽然已经降低,但不能诱导其向角膜上皮方向或表皮方向分化。另外,TKE2细胞在反复体外传代过程中,也可能失去了分化为正常角膜上皮细胞的能力。
K14、K15和K16均为表达在复层化上皮的重要角蛋白,参与细胞的增殖和迁移过程[9]。其中K14、K15可作为鉴定上皮干细胞及角膜缘干细胞表型的蛋白[4,10-11],K16尤其表达在过度增生的上皮疾病组织中,如翼状胬肉[12]。本实验发现,KSFM中培养的TKE2细胞呈K14阳性表达,K15为克隆内散在细胞阳性著染,K16为克隆中央区片状著染,说明扩增的TKE2细胞群体中含有干细胞。诱导分化后,克隆内只有少量细胞呈K14、K16阳性染色,K15则为阴性。进一步说明了TKE2细胞在低钙无血清培养基KSFM中培养可以保持其干性,而在含血清培养基中增殖能力下降,可能失去复层化能力。
笔者得出结论,在低钙无血清培养基KSFM中培养的TKE2可以保持高度增殖能力,并表达角膜上皮干细胞常见标识物,在这种条件下培养的TKE2可作为角膜上皮干细胞研究的工具。但由于在本实验的诱导体系中不能将TKE2诱导出表达K12的角膜上皮细胞,是诱导体系的原因还是TKE2细胞自身失去了分化成正常角膜上皮细胞的功能,还有待进一步研究。后续研究也可通过改变诱导体系,比较不同体系中角膜上皮细胞相关蛋白如K12、Pax6的表达情况,这也为我们研究角膜上皮细胞定向分化的机制提供了一个新的细胞模型。
1 Secker GA,Daniels JT.Corneal epithelial stem cells:deficiency and regulation[J].Stem Cell Rev,2008,4(3):159-168.
2 Kawakita T,Shimmura S,Hornia A,et al.Stratified epithelial sheets engineered from a single adult murine corneal/limbal progenitor cell[J].J Cell Mol Med,2008,12(4):1303-1316.
3 Takács L,Tóth E,Berta A,et al.Stem cells of the adult cornea: from cytometric markers to therapeutic applications[J].Cytometry A,2009,75(1):54-66.
4 Liu S,Li J,Wang C,et al.Human limbal progenitor cell characteristics are maintained in tissue culture[J].AnnAcad Med Singapore,2006,35(2):80-86.
5 Yoshida S,Shimmura S,Kawakita T,et al.Cytokeratin 15 can be used to identify the limbal phenotype in normal and diseased ocular surfaces[J].Invest Ophthalmol Vis Sci,2006.47(11):4780-4786.
6 Schlötzer-Schrehardt U1,Kruse FE.Identification and characterization of limbal stem cells[J].Exp Eye Res,2005,81(3):247-264.
7 Pitz S,Moll R.Intermediate-filament expression in ocular tissue[J].Prog Retin Eye Res,2002,21(2):241-262.
8 Li W,Chen YT,Hayashida Y,et al.Down-regulation of Pax6 is associated with abnormal differentiation of corneal epithelial cells in severe ocular surface diseases[J].J Pathol,2008,214(1):114-122.
9 Patel GK,Wilson CH,Harding KG,et al.Numerous keratinocyte subtypes involved in wound reepithelialization[J].J Invest Dermatol,2006,126(2):497-502.
10 Liu Y,Lyle S,Yang Z,et al.Keratin 15 promoter targets putative epithelial stem cells in the hair follicle bulge[J].J Invest Dermatol,2003,121(5):963-968.
11 Chen B,Mi S,Wright B,et al.Investigation of K14/K5 as a stem cell marker in the limbal region of the bovine cornea[J].Plos One,2010,5(10):e13192.
12 Dong N,Li W,Lin H,et al.Abnormal epithelial differentiation and tear film alteration in pinguecula[J].Invest Ophthalmol Vis Sci,2009.50(6):2710-2715.

