多能成体祖细胞培养条件促进人脂肪干细胞的视网膜神经保护功能
娄慧 徐国旭
干细胞技术的迅速发展为攻克许多目前无法治疗的疾病带来新的希望。胚胎干细胞(embryonic stem cell,ESC)、诱导性多能干细胞(inducible pluripotent stem cell,iPSC)以及各种成体干细胞(adult stem cells,ASCs)各有特点,在细胞替代治疗以及组织工程材料制备中均显示出很好的应用前景[1-3]。ASCs已经开始用于血液系统疾病、心血管系统疾病以及皮肤损伤的治疗[4-6]。与ESC和iPSC相比,ASCs具有更多的优势。
首先,大多研究表明ASCs移植是安全的,而且自体ASCs移植被临床实践证明是可行的[8-10]。其次,从取材和细胞性质看,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)、脂肪干细胞(adipose-derived stem cells,ADSCs)和血液中的细胞最为可行,因为属于机体可再生或废弃的组织。第三,从疗效看,已有研究证明BMMSCs和ADSCs都能被诱导分化为不同的组织细胞,跨系、甚至跨胚层分化为其它类型组织细胞[11-14]。有研究表明,ADSCs具有向光感受器细胞和胶质样细胞分化的能力,并表现出修复血视网膜屏障(BRB)的作用[15]。目前,用于动物疾病模型干预的ASCs多为P3-P5代,因为ASCs体外培养长期传代会出现老化,这也是ASC临床研究中需要解决的关键问题。
Jiang等[16]采用一种新的培养基从骨髓间充质中分离出具有更强增殖能力和更广泛分化潜能的细胞,即骨髓来源的多能成体祖细胞(multipotent adult progenitor cell,MAPC)。与BMMSCs相比,MAPC具有相同的体外成脂、成骨和成软骨的分化效率,但具有更强的体外扩增能力[17];更为重要的是MAPC不会形成畸胎瘤[16]。因而,MAPC对于治疗退行性和遗传性疾病,如视网膜变性疾病带来巨大的希望。
以年龄相关性黄斑变性(age-related macular degeneration,AMD)和视网膜色素变性(retinitis pigmentosa,RP)为主要代表的视网膜变性疾病(degenerative retinal diseases,DRD)是眼科主要的致盲性疾病之一。其主要的病理特征是视网膜光感受器细胞(Photoreceptor)和视网膜色素上皮细胞(retinal pigment epithelium,RPE)凋亡及功能丧失而引起视功能损害[18-19]。目前还缺乏针对这种疾病的有效治疗手段。
本课题拟利用MAPC的培养基培养猴BMMSCs和人脂肪干细胞(hADSCs),检测MAPC培养条件对这两种细胞形态和生物学特征的影响,并将经MAPC培养条件培养的hADSCs移植到RCS大鼠视网膜下腔并重点检测其保护效应,验证MAPC培养条件是否能增强ADSCs的视网膜神经保护作用,为MAPC最终走向临床提供可靠的实验室数据。
材料与方法
一、材料
1.试剂:淋巴细胞分离液购自Corning,100×胰岛素-转铁蛋白-硒添加剂(ITS)、亚油酸蛋白、地塞米松、抗坏血酸-2-磷酸、MCDB-201培养液、β-磷酸甘油、胰岛素、吲哚美辛、异丁基甲基黄嘌呤、L-抗坏血酸、抗坏血酸-2-磷酸以及表皮生长因子(epidermal growth factor,EGF)购自Sigma-Aldrich公司,血小板衍生生长因子(plateletderived growth factor,PDGF)购自R&D Systems Inc公司,转化生长因子β1(transforming growth factor-β1,TGF-β1)购自 Peprotech 公司。其它细胞培养试剂购自Invitrogen公司,RNAiso Plus和逆转录试剂盒购自TakaRa公司,Sybrgreen real time premix购自天根生化,常规生化试剂购自国药集团化学试剂有限公司。
2.实验动物:皇家外科学院(royal college of durgeons,RCS)大鼠是遗传性视网膜色素变性的经典动物模型。RCS大鼠由于隐性Mertk基因突变致使视网膜色素上皮细胞丧失吞噬视细胞外节膜盘能力而导致视细胞外节膜盘堆积,最终导致光感受器细胞进行性变性和丢失。RCS大鼠饲养在同济大学动物中心,并遵循同济大学动物中心和眼科与视觉科学研究协会(the Association for Research in Vision and Ophthalmology,ARVO)关于动物使用和处理的规定。
实验用食蟹猴骨髓由昭衍苏州新药研究中心有限公司提供。
二、方法
1.食蟹猴BMMSCs的分离制备及MAPC培养条件培养:新鲜抽取的食蟹猴骨髓3ml转移到抗凝管中,800×g离心5min;弃去血浆后剩余血细胞用含抗生素的PBS清洗2遍,细胞用4ml PBS重悬,再加到8ml淋巴细胞分离液上,800×g离心0.5 h。此时细胞富集于淋巴细胞分离液和PBS之间,吸取中间层的骨髓细胞,用PBS清洗2遍,接种于培养瓶中,置细胞培养箱中培养。原代细胞长至80﹪汇合后,以1:3传代,分别用DMEM/LG-20﹪FBS培养液和MAPC培养液培养。
MAPC培养液:含60﹪DMEM/LG(低糖)培养液、40﹪ MCDB-201培养液、1 nmol/L地塞米松、10-4M L-抗坏血酸、1×ITS、4.7 μg/ml亚油酸蛋白、1﹪青霉素-链霉素、2﹪血清、10 ng/ml PDGF和10 ng/ml EGF。
2.hADSCs分离制备及MAPC培养条件培养:新鲜获取的脂肪组织用含抗生素的PBS充分冲洗,用1 g/L的胶原酶37℃条件消化60min,加入等体积含血清的培液用以中和胶原酶,300×g离心5min;将细胞沉淀物用DMEM/LG培养液重悬并接种至细胞培养瓶中,并置于细胞培养箱培养。待原代细胞长至80﹪汇合后以1:3传代,分别采用含10﹪FBS的DMEM/LG培养液和MAPC培养液培养传代[16],两种培养条件下的hADSCs分别定义为DMEM/LG-hADSC和MAPC-hADSC。
3.成骨、成脂及成软骨分化实验:取P4代的DMEM/LG-hADSC和MAPC-hADSC,均以104/cm2接种于12孔板中。待细胞长至80﹪汇合时更换脂肪细胞诱导培养基或成骨细胞诱导培养基进行培养,每3 d换液1次,连续培养3周。分化成的脂肪细胞用油红染色鉴定,成骨细胞用茜素红染色鉴定。诱导细胞向软骨细胞分化时,细胞以5×105个 /100μl悬滴培养 1d,待细胞形成悬球,将细胞球转移至细菌培养皿中,用软骨细胞分化培养基培养,每2 d换液,3周后采用4﹪多聚甲醛固定,制备冰冻切片,用甲苯胺蓝染色鉴定。
脂肪细胞分化培养基:0.5mmol/L异丁基甲基黄嘌呤、1mmol/L地塞米松、10mmol/L胰岛素、200mmol/L吲哚美辛。
成骨细胞分化培养基:0.1mmol/L地塞米松、50mmol/L抗坏血酸-2-磷酸、10mmol/L β-磷酸甘油。
软骨细胞分化培养基:6.25 mg/ml胰岛素、10 ng/ml转化生长 因 子 β1、50 nmol/L 抗坏血酸-2-磷酸。
4.MTT细胞增殖实验:分别将DMEM/LG-hADSC和MAPC-hADSC(P4)接种于96孔板(500个 /孔 /100μl),置于细胞培养箱中培养,每2 d换液1次。检测时,每孔加入10μl MTT,37℃放置4 h后加入100μl三联剂,隔天检测OD值(波长570 nm)。三联剂成分:异丙醇5ml,10 M HCl 0.1ml盐酸,再10﹪SDS定容至100ml。
5.定量PCR分析:PCR分析所使用的引物均在上海生工生物工程技术服务有限公司合成,引物序列见表1。收取DMEM/LG-hADSC和MAPC-hADSC(P4),加入1ml Total RNA 提取试剂,按照说明书进行操作。RNA定量后,取1000 ng RNA逆转录成cDNA,再稀释至10 ng/μl。定量PCR分析MSC标记分子、色素上皮衍生因子(pigment epithelium-derived factor,PEDF)、肝细胞生长因子(hepatocyte growth factor,HGF)和白细胞介素-6(interleukin-6,IL-6)的基因表达水平。
6.克隆形成率实验:将DMEM/LG-hADSC和MAPC-hADSC(P4)接种于10 cm细胞培养皿(100个细胞/皿),培养10d。然后弃除培养液,4﹪多聚甲醛固定10min,用吉姆萨染色鉴定。
7.细胞移植:选取21d日龄的RCS大鼠,分为DMEM/LG-hADSC移植组,MAPC-hADSC移植组,0.9﹪ NaCl注射组和未处理组,每组6只老大鼠。将DMEM/LG-hADSC和MAPC-hADSC(P4)消化成单细胞悬液,细胞浓度为3×104个/μl。移植时,取约3μl的细胞悬液注射到3W的RCS大鼠视网膜下腔。
8.TUNEL检测:细胞移植3周后,取下RCS大鼠眼球固定并制备成冰冻切片。PBS水化10min,0.25﹪ TritonX-100透膜30min,PBS洗3次,每次5min。用TUNEL试剂染色,37℃温育 1h,PBS洗 3次,每次 5min;DAPI染色2min,PBS洗3次,每次5min,封片并拍照。
9.ERG检测:细胞移植3周后,对RCS大鼠经暗适应后在弱红光下进行ERG检测。未进行细胞移植的RCS大鼠(出生后6周)作为对照。ERG用视觉电生理检测仪(重庆康华瑞明公司制造)检测。
三、统计学分析
采用SigmaStat 3.0统计软件进行统计学分析,ERG数据(b波值)以表示。DMEM/LG-hADSC移植组和MAPC-hADSC移植组两组间b波值采用两样本t检验;基因表达变化量用ΔΔct法计算,并用两样本t检验检测基因表达倍数的差异。以P < 0.05为差异有统计学意义。
结 果
一、MAPC培养条件对于猴BMMSCs细胞增殖的影响
猴BMMSCs在DMEM/LG培养至P4,换为MAPC培养条件继续培养。在最初MAPC培养条件传代1-2代时,这些猴BMMSCs形态变小,部分呈三角形状,细胞增殖明显增加,与BMMSCs培养条件下的猴BMMSCs相比,增加40﹪~50﹪。但这种形态、增殖性质的改变仅维持2代。传2代后,MAPC培养液培养的猴BMMSCs形态逐渐呈宽大扁平状,超过在DMEM/LG标准培养基培养的相同代数的BMMSCs的大小(图1),提示MAPC培养条件在短期(2代以内)内能提高猴BMMSCs的增殖,2代以后则加速这些BMMSCs的老化。
二、MAPC培养条件对hADSCs形态和分化潜能的影响
在常规hADSCs的培养基DMEM-LG培养条件下,随着传代次数增加,hADSCs变扁平宽大的细胞比率增加(图2);而在MAPC培养条件下,hADSCs连续传代至第10代,细胞形态仍保持不变(图2),与DMEM/LG-hADSC一样,MAPC-hADSC依然具有三系分化的潜能(图3)。同 DMEM/LG-hADSC相 比,MAPC-hADSC的增殖力在培养的第6天和第8天有显著性增加(P < 0.05,图4a),并能形成更多更大的克隆(图4b、c,第 10 代)。

表1 引物序列

图1 倒置显微镜下观察MAPC培养条件对猴BM-MSC的影响(×100)
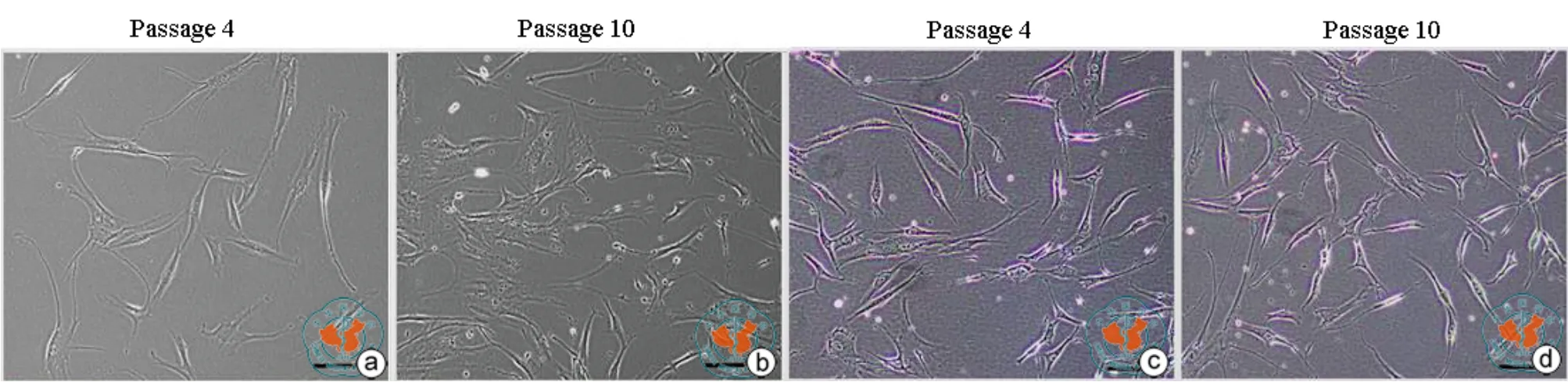
图2 倒置显微镜下观察MAPC培养条件对hADSC生物特性的影响(×100)

图3 倒置显微镜下观察DMEM/LG-hADSC和MAPC-hADSCs的三系分化能力检测
三、MAPC培养条件对hADSCs细胞表面标记物表达的影响
在MAPC培养条件下,检测了hADSCs(P4)细胞表面CD标记物的基因表达,与DMEMLG培养条件的相同代数的细胞相比,MAPC培养条件对CD44基因表达没有显著性影响,CD140b、CD90、CD47的基因表达量分别升高了 2.03±0.21 倍、2.13±0.62 倍 和1.74±0.16 倍(P < 0.05)。CD105、CD73的基因表达量分别下降了 0.13±0.01 倍和0.28±0.09 倍(P < 0.01,图5a)。同时,MAPC培养条件还影响细胞因子的基因表达。PEDF和HGF的基因表达量分别升高了 4.42±0.53 倍和8.55±2.13 倍(P < 0.01),IL-6的基因表达量下降了 0.13±0.009倍(P < 0.01)(图5b、c、d)。同时,MAPC培养条件还能显著上调PEDF和HGF的表达(P < 0.01)、显著下调IL-6的表达(P < 0.01)(图 5b、c、d)。这些作用提示,MAPC-hADSC具有更好的免疫耐受和更强的组织细胞营养作用。

图4 MAPC培养条件增强hADSC的增殖能力和克隆形成能力
四、MAPC-hADSC对RCS大鼠视网膜的保护作用
在RCS大鼠出生后3周,取MAPC-hADSC进行视网膜下腔移植。移植细胞3周后,用ERG检查视网膜功能。结果表明,未接受细胞移植的对照组RCS大鼠的ERG的b波波幅比正常野生型大鼠(数据未显示)显著降低,相比之下,接受DMEM/LG-hADSC移植大鼠的b波波幅显著高于对照组和注射氯化钠组,而移植MAPC-hADSC 的大鼠b波波幅(239.621±15μV)高于DMEM/LG-hADSC 移 植组(189.4±22μV)(图6),表明其视觉功能会明显改善。视网膜组织学检查表明,对照组RCS大鼠视网膜外核层(outer nuclear layer,ONL)的厚度明显变薄,并且外核层中TUNEL阳性细胞非常显著地增加。相比之下,在接受MAPC-hADSC和DMEM/LG-hADSC移植的RCS大鼠,视网膜ONL厚度显著大于对照RCS大鼠和氯化钠注射组,而且ONL层中TUNEL阳性的凋亡细胞显著减少(图7)。形态和功能性检查结果一致提示相比较于DMEM/LG-hADSC、MAPC-hADSC具有更强的视网膜保护作用。
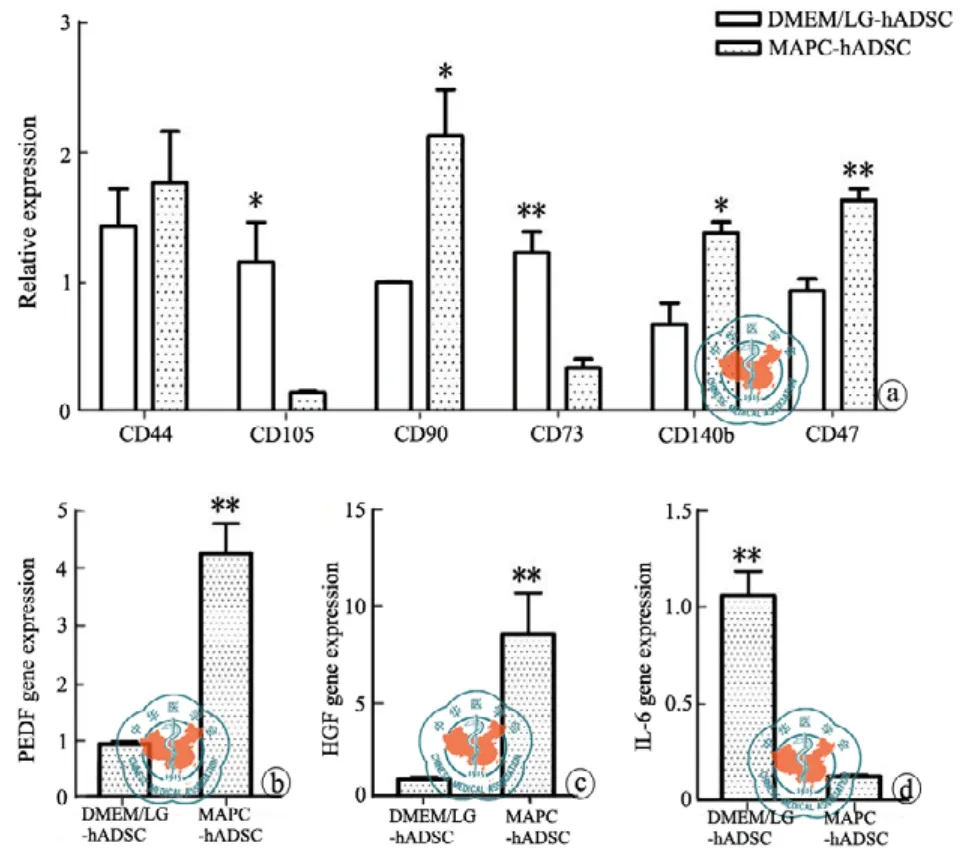
图5 MAPC培养条件对hADSC表面标记物和细胞因子基因表达的影响
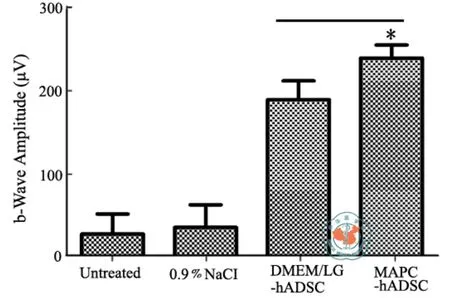
图6 MAPC-hADSC对RCS大鼠视网膜具有更强的保护作用
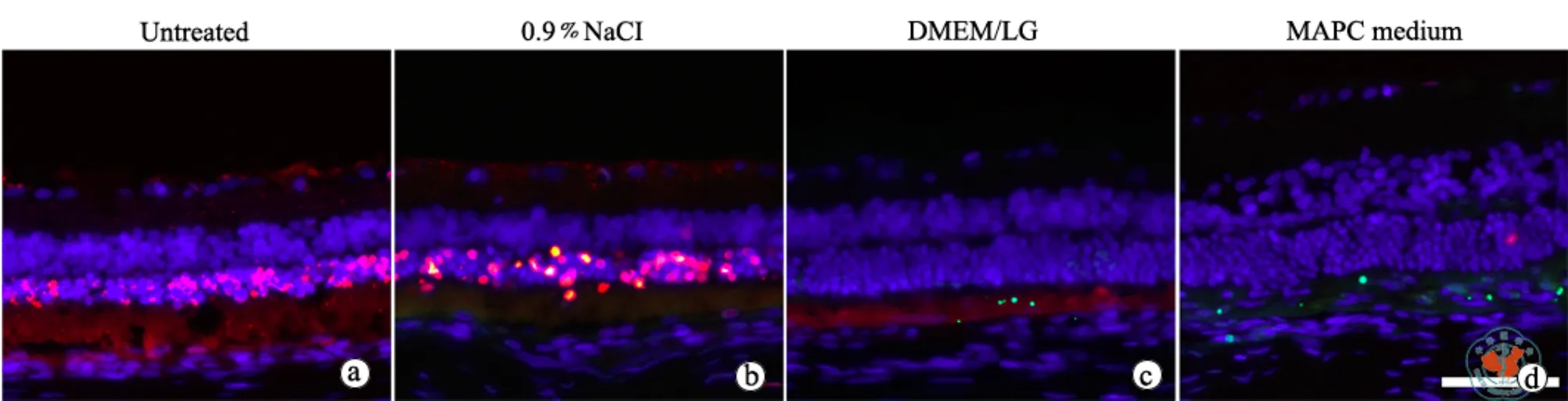
图7 蔡司正置荧光显微镜下观察hADSC移植抑制RCS大鼠视网膜细胞的凋亡(×400)
讨 论
视网膜变性疾病,如AMD、RP等,对人们视力损伤严重且目前缺乏有效治疗措施。基于干细胞的细胞移植治疗为干预这类疾病提供了新的希望。尽管干细胞研究时间尚短,但其快速进展已使这种治疗开始进入临床试验。相对治疗其他组织器官疾病的干细胞移植治疗,眼病,特别是视网膜退行性疾病是干细胞治疗的理想切入点。眼睛是一个免疫豁免器官、体积小(移植所需供体细胞数量较少)、移植可在直视下手术操作、其治疗效果可以通过ERG等功能学检测方法进行评价。已有临床研究证实,移植RPE细胞能改善视网膜功能[20]。在RCS模型中移植BMMSCs能抑制光感受器细胞的丢失,保护视网膜功能[21]。
本研究中用MAPC培养条件培养猴BMMSCs和hADSCs,希望能获得可用于临床的,如治疗视网膜变性的供体细胞。尽管BMMSCs和ADSCs都属于临床上常见的ASCs,且两者具有很多相同的生物学性质,但本研究表明,两者的细胞生物学特性还存在很多差异,包括在同样的MAPC培养液条件下两者的增殖特性及功能改变等反应的显著不同。在同样的MAPC培养条件下,猴BMMSCs短期(2代)内细胞增殖能力增强,但随后很快出现老化征象。这样的变化不仅与hADSCs的反应不同,与人BMMSCs的反应也截然不同,后者出现内皮细胞样的表型[17]。推测这种不同反应既与两种细胞的种属差异有关,也与组织差异有关。至少可以说,MAPC培养条件不适合用于猴BMMSCs的扩增。
与BMMSCs相比,体外培养的ADSCs的遗传学和形态学的稳定性可以保持更长时间[22],也具更高的增殖速率及更低的老化速率[23]。在本研究中的MAPC培养条件下,hADSCs比在常规的DMEM-LG培养条件下保持了更好的稳定性和改善的增殖能力,在连续传代至第10代时细胞形态仍保持不变,且依然具有三系分化潜能(图2D)。同时,MAPC培养条件处理的hADSCs的增殖力在第6天和第8天有显著性增加(P < 0.05,图2B),并能形成更多更大的克隆(图2C)。表明MAPC培养条件能更好地维持ADSCs的体外增殖能力,更适合ADSCs的扩增。
在免疫表型方面,研究也表明ADSCs与BMMSCs有所不同。新鲜分离的ADSCs中,有部分细胞表达CD34,而BMMSCs不表达CD34;反过来,ADSCs不表达CD106,而BMMSCs则高表达CD106[24]。更为重要的是ADSCs比BMMSCs具有更强的免疫抑制功能[25]。最近文献报道ADSCs在体内外都支持血液稳态,且活性甚至超过BMMSCs[26],使得ADSCs越来越受到关注。本研究进一步丰富了这方面的认识。与常规ADSCs培养条件相比,MAPC培养条件处理的hADSCs在形态上没有明显变化,但在分子水平,不论是细胞表面标记物还是细胞因子都发生了显著变化,主要表现为CD73和CD105显著下调、CD140b、CD90和CD47显著上调;IL-6表达显著下调、PEDF和HGF表达显著上调。在MSC的CD标记物中,CD73在低氧时对血管渗漏具有重要的作用[27],CD105也是与血管生成密切相关的低氧诱导蛋白[28]。因此,可以推测:经过MAPC培养条件的处理,hADSCs的血管生成能力可能会受到影响,但实际情形还有待于进一步的研究证实。另一组指标中,hADSCs的CD90表达增高,可能意味着这种细胞干预会改善其免疫抑制活性或改善局部免疫平衡。因为CD90表达降低已被证明与免疫抑制活性丢失有关[29]。而CD47表达增加则与细胞吞噬能力降低有关。有研究表明,在巨噬细胞通过吞噬作用清除血液中病原菌和损伤的衰老细胞过程中,细胞表面的CD47能与巨噬细胞的受体SIRPa结合[30],负调控吞噬作用,从而抑制正常细胞的吞噬功能[31]。移植的红细胞[32]、淋巴细胞和骨髓细胞[33]则因缺乏自主表达CD47而常会被吞噬,从另一方面证明了CD47可作为“不要吃我(don’t eat me)”信号以确保自体细胞不被吞噬。整合这些研究报告和在本研究中MAPC培养条件下hADSCs的CD47表达明显上调,支持这种移植细胞具有更强的对抗被吞噬的能力,从而能理解为什么移植的hADSCs能更好地存活。
作为ADSCs表达的主要细胞因子,在MAPC培养条件下,hADSCs的PEDF和HGF表达显著升高、IL-6表达显著降低。以往研究表明:PEDF具有多种功能,包括抗血管生成、抗肿瘤和神经营养性质[34]。人视网膜中PEDF的表达出现在胚胎早期,表明它在视网膜神经细胞分化中可能起重要作用[35];HGF则作为主要作用于上皮来源细胞的一种多功能的细胞因子,调节细胞生长、运动性和形态发生。其刺激有丝分裂、细胞运动性和基质侵袭的能力使其在的血管生成、肿瘤发生和组织再生等过程中发挥重要作用[36]。与PEDF和HGF不同,IL-6更像是一柄双刃剑,既是促炎性细胞因子(pro-in flammatory cytokine),又是抗炎性肌细胞因子(anti-in flammatory myokine)[37]。但由于后者主要见于运动中由肌细胞分泌,在本研究中的变性组织中更合理地理解应该是其促炎作用。结合本实验中所见,这些研究提示:MAPC培养条件可能会增加hADSCs的免疫抑制活性、抑制炎症反应、并为神经细胞提供营养和保护作用,因此,移植后,应该能在受体组织中很好地存活并保护受体组织中的神经细胞。
为在动物模型中证实MAPC培养条件能改善hADSCs的免疫抑制活性、抑制炎症反应以及保护神经细胞的推测,笔者将这些细胞移植到RCS大鼠视网膜下腔并检测其存活及对变性的视网膜神经细胞的保护作用。结果证明假设是合理的:不论是形态学观察还是视功能检测指标,均显示移植的hADSCs不仅能在视网膜中很好存活,还具有很强的视网膜保护作用,不仅ONL厚度明显增加、TUNEL阳性细胞显著减少,而且能客观反应部分视觉功能的ERG检查的b波波幅也明显高于对照组。关于MAPC-hADSC移植治疗的作用机理,笔者推测主要与MAPC-hADSC的旁分泌营养作用及抑制炎症反应有关,至少在初步实验中未见到明显的MAPC-hADSC转分化为视网膜细胞进行替代治疗的证据。
本研究结果提示,在视网膜神经退行性疾病、自身免疫性疾病等疾病的细胞治疗中,MAPC培养条件下的ADSCs有明显的体外制备和干预能力的优势,可能会有广阔的应用前景。进一步推论,本研究的结果对通过不同培养条件遴选合适的供体细胞以应对不同的临床疾病具有一定的指导意义。
1 Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue: Implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
2 Attal M,Harousseau JL,Stoppa AM,et al.A prospective,randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma[J].N Engl J Med,1996,335(2):91-97.
3 Kim JH,Auerbach JM,Rodríguez-Gómez JA,et al.Dopamine neurons derived from embryonic stem cells function in an animal model of Parkinson’s disease[J].Nature,2002,418(6893):50-56.
4 Strauer BE,Brehm M,Zeus T,et al.Repair of infarcted myocardium by autologous intracoronary mononuclear bone marrow cell transplantation in humans[J].Circulation,2002,106(15):1913-1918.
5 Deans RJ,Moseley AB.Moseley.Mesenchymal stem cells:Biology and potential clinical uses[J].Exp Hematol,2000,28(8):875-884.
6 Pittenger MF,Martin BJ.Martin.Mesenchymal stem cells and their potential as cardiac therapeutics[J].Circ Res,2004,95(1):9-20.
7 Zhao T,Zhang ZN,Rong Z,et al.Immunogenicity of induced pluripotent stem cells[J].Nature,2011,474(7350):212-215.
8 Philip T,Guglielmi C,Hagenbeek A.Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma[J].N Engl J Med,1995,333(23):1540-1545.
9 Sheridan WP,Begley CG,Juttner CA.Effect of peripheralblood progenitor cells mobilised byfilgrastim (G-CSF) on platelet recovery after high-dose chemotherapy[J].Lancet,1992,339(8794):640-644.
10 Stamm C,Westphal B,Kleine HD.Autologous bonemarrow stem-cell transplantation for myocardial regeneration[J].Lancet,2003,361(9351):45-46.
11 Grove JE,Bruscia E,Krause DS.Plasticity of bone marrow-derived stem cells[J].Stem Cells,2004,22(4):487-500.
12 Herzog EL,Chai L,Krause DS.Plasticity of marrowderived stem cells[J].Blood,2003,102(10):3483-3493.
13 Mertelsmann R.Plasticity of bone marrow-derived stem cells[J].J Hematother Stem Cell Res,2000,9(6):957-960.
14 Yu SH,Jang YJ,Lee ES,et al.Transplantation of adipose derived stromal cells into the developing mouse eye[J].Acta histochemica et cytochemica,2010,43(6):123-130.
15 Vossmerbaeumer U,Ohnesorge S,Kuehl S,et al.Retinal pigment epithelial phenotype induced in human adipose tissue-derived mesenchymal stromal cells[J].Cytotherapy,2009,11(2):177-188.
16 Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
17 Roobrouck VD,Clavel C,Jacobs SA,et al.Differentiation potential of human postnatal mesenchymal stem cells,mesoangioblasts,and multipotent adult progenitor cells re flected in their transcriptome and partially in fluenced by the culture conditions[J].Stem Cells,2011,29(5):871-82.
18 Curcio CA,Medeiros NE,Millican CL.Photoreceptor loss in age-related macular degeneration[J].Invest Ophthalmol Vis Sci,1996,37(7):1236-1249.
19 Delyfer MN,Leveillard T,Mohand-Said S,et al.Inherited retinal degenerations: therapeutic prospects[J].Biol Cell,2004,96(4):261-269.
20 Radtke ND,Aramant RB,Petry HM,et al.Vision improvement in retinal degeneration patients by implantation of retina together with retinal pigment epithelium[J].Am J Ophthalmol,2008,146(2):172-182.
21 Inoue Y,Iriyama A,Ueno S,et al.Subretinal transplantation of bone marrow mesenchymal stem cells delays retinal degeneration in the RCS rat model of retinal degeneration[J].Exp Eye Res,2007,85(2): 234-241.
22 Izadpanah R,Trygg C,Patel B,et al.Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue[J].J Cell Biochem,2006,99(5): 1285-1297.
23 Kern S,Eichler H,Stoeve J,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood,or adipose tissue[J].Stem Cells,2006,24(5):1294-1301.
24 De Ugarte DA,Morizono K,Elbarbary A,et al.Comparison of multi-lineage cells from human adipose tissue and bone marrow[J].Cells Tissues Organs,2003,174(3): 101-109.
25 Ivanova-Todorova E,Bochev I,Mourdjeva M,et al.Adipose tissue-derived mesenchymal stem cells are more potent suppressors of dendritic cells differentiation compared to bone marrow-derived mesenchymal stem cells[J].Immunol Lett,2009,126(1-2):37-42.
26 De Toni F,Poglio S,Youcef AB,et al.Human adiposederived stromal cells efficiently support hematopoiesis in vitro and in vivo: a key step for therapeutic studies[J].Stem Cells Dev,2011,20(12):2127-2138.
27 Thompson LF,Eltzschig HK,Ibla JC,et al.Crucial role for ecto-5’-nucleotidase (CD73) in vascular leakage during hypoxia[J].J Exp Med,2004,200(11):1395-1405.
28 Duff SE,Li C,Garland JM,et al.CD105 is important for angiogenesis: evidence and potential applications[J].FASEB J,2003,17(9):984-992.
29 Campioni D,Rizzo R,Stignani M,et al.A decreased positivity for CD90 on human mesenchymal stromal cells(MSCs) is associated with a loss of immunosuppressive activity by MSCs[J].Cytometry B Clin Cytom,2009,76(3):225-230.
30 Jiang P,Lagenaur CF,Narayanan V.Integrin-associated protein is a ligand for the P84 neural adhesion molecule[J].J Biol Chem,1999,274(2):559-562.
31 Brown EJ,Frazier WA.Integrin-associated protein (CD47)and its ligands[J].Trends Cell Biol,2001,11(3):130-135.
32 Oldenborg PA,Zheleznyak A,Fang YF,et al.Role of CD47 as a marker of self on red blood cells[J].Science,2000,288(5473):2051-2054.
33 Blazar BR,Lindberg FP,Ingulli E,et al.CD47 (integrinassociated protein) engagement of dendritic cell and macrophage counterreceptors is required to prevent the clearance of donor lymphohematopoietic cells[J].J Exp Med,2001,194(4):541-549.
34 Rychli K,Huber K,Wojta J.Pigment epithelium-derived factor (PEDF) as a therapeutic target in cardiovascular disease[J].Expert Opin Ther Targets,2009,13(11):1295-1302.
35 Garcia M,Fernandez-Garcia NI,Rivas V,et al.Inhibition of xenografted human melanoma growth and prevention of metastasis development by dual antiangiogenic/antitumor activities of pigment epithelium-derived factor[J].Cancer Res,2004,64 (16):5632-5642.
36 Nakamura T,Mizuno S.The discovery of hepatocyte growth factor (HGF) and its significance for cell biology,life sciences and clinical medicine[J].Proc Jpn Acad Ser BPhys Biol Sci,2010,86(6):588-610.
37 Muñoz-Cánoves P,Scheele C,Pedersen BK,et al.Interleukin-6 myokine signaling in skeletal muscle:a double-edged sword[J].FEBS J,2013,280(17):4131-4148.

