mTOR信号通路在iPS定向分化RPE细胞中的调控机制研究
蒋超 石厚霞 丁思加 赵晨
RPE细胞是神经视网膜外侧的一层单层终末分化的细胞,当RPE细胞中表达的基因(RPE65、RLBP1、LRAT等 )存 在 先 天 突 变,引起RPE功能障碍时,会引起各种遗传性视网膜变性疾病[1-2]。诱导多功能干细胞(induced pluripotent stem cell,iPS)将成为细胞移植的一个重要来源,iPS可以无限期地自我更新和分化,使得人类胚胎干细胞成为RPE细胞移植的一个重要供体来源[3-4]。然而,iPS来源的RPE细胞和所有体外培养的细胞一样都面临着共同的问题,那就是与自然的组织细胞在属性和生化表达上存在着一定的差异。mTOR信号通路在上皮细胞的增殖和分化过程中发挥着重要调节作用。研究表明[5],RPE细胞受到损伤时,AKT/mTOR(mammalian target of rapamycin,mTOR)细胞信号通路的激活是最早发生的分子事件。这一信号通路的激活延长了RPE细胞的寿命,但同时导致了RPE的异常增殖、发生去分化的现象。
人们对iPS细胞向RPE细胞分化过程中的mTOR信号调控机制知之甚少。因此,本文将建立获得高等分化、功能高效的iPS-RPE细胞的方法,并研究iPS-RPE细胞分化过程中mTOR信号通路的调控机制,通过添加雷帕霉素处理iPSRPE细胞,找到促进iPS-RPE细胞成熟分化并使其更接近自然RPE细胞的方法和靶点,本研究将对采用细胞移植的方法治疗视网膜变性疾病提供优质供体细胞。
材料和方法
一、材料
1.细胞:iPS细胞系(由上海同济大学范国平课题组提供),MEF细胞购自上海斯丹赛生物技术有限公司,
2.试剂:DMEM/F12培养基、Knockout血清替代物、非必需氨基酸、L-谷氨酰胺、β-巯基乙醇、胶原酶Ⅳ、Trizol、以及引物合成均来自Invitrogen;碱性成纤维生长因子bFGF(RD)、0.1﹪明胶 (Millipore)、Matrigel胶(BD)、化合物 CKI-7和SB-431542(sigma)、反转录试剂盒(TAKARA)、Q-PCR 试剂(Roche)、雷帕霉素(sigma)。
二、方法
(一)小鼠胚胎成纤维细胞(MEF)细胞培养
使用含10﹪胎牛血清的DMEM/F12作为MEF的培养基,培养板用0.1﹪的明胶预处理1h,铺板生长后的MEF细胞需要在10d内使用。
(二)iPS细胞的培养
待iPS克隆长到一定程度后,用1 mg/ml的胶原酶Ⅳ进行消化,按1:4进行传代,后培养在预先铺好的MEF细胞上生长。
(三)体外分化拟胚体(EB)[6]
1.悬浮培养:iPS细胞长至密度为80﹪的时候,消化细胞克隆,用移液枪轻轻吹打贴壁的iPS,室温静置,吸掉上清培养基,得到细胞团块(不能将团块吹散)后,将其转移至没有粘附性的培养皿中悬浮培养。待细胞团块培养3 d后,更换新鲜的培养基(不含bFGF),同时加入终浓度为5 μmol/L的CKI-7和SB-431542的小分子化合物进行诱导分化。每隔2 d换液1次,iPS细胞团块逐步形成球状体EB。
2.贴壁培养:iPS细胞悬浮培养7 d后,EB向RPE细胞分化:待EB生长15 d后,收集EB团块,将其按适当的密度铺板在martrigel胶预处理过的培养皿中进行贴壁培养。培养基换成iPS分化培养液,隔2 d换液1次,贴壁培养30d后,观察细胞形态。EB贴壁培养分化1个月、2个月、3个月。
(四)免疫荧光观察iPS-RPE细胞(分化1个月)中特异性蛋白的表达情况
将iPS-RPE细胞培养在玻片上,用预冷的PBS冲洗5min,4﹪多聚甲醛固定10min,PBS漂洗后,0.5﹪Triton 通透15min,1﹪BSA封闭30min,漂洗后加稀释好的一抗(RPE651:100 millipore ;ZO-11:100 invitrogen ;LRAT 1:100 santa),于4℃过夜。PBS冲洗3次,每次5min,再滴加稀释后的对应的二抗,室温避光孵育1h。漂洗后加染料phalloidin对细胞骨架进行染色30min,PBS冲洗3次,每次5min,再加DAPI对细胞核进行染色,室温作用5min,漂洗后用抗淬灭剂封片,荧光显微镜下观察、拍照。
(五)Q-PCR检测不同分化时间段iPS-RPE细胞中基因表达
按TRIzol方法提取分化细胞的总RNA,取各样本2 μg总RNA,经逆转录制备cDNA。以gapdh为内参,Q-PCR分析在分化的不同时间点,RPE细胞特异性基因的表达变化。各基因的扩增引物见表 1。Q-PCR 扩增反应体系为 :10μl 2×SYBR混合物,上下游引物各 100 pmol、cDNA 1μl,ddH2O补足至20μl;PCR反应条件,95℃预变性10min,95℃变性15 s,60℃退火60 s的条件下循环30次,最后72℃延伸5min,反应于ABI7500 PCR仪上完成。基因表达的相对定量方法为:以gapdh基因mRNA的表达为内参,以2-∆∆CT法分析数据,用未分化的iPS细胞作为对照。
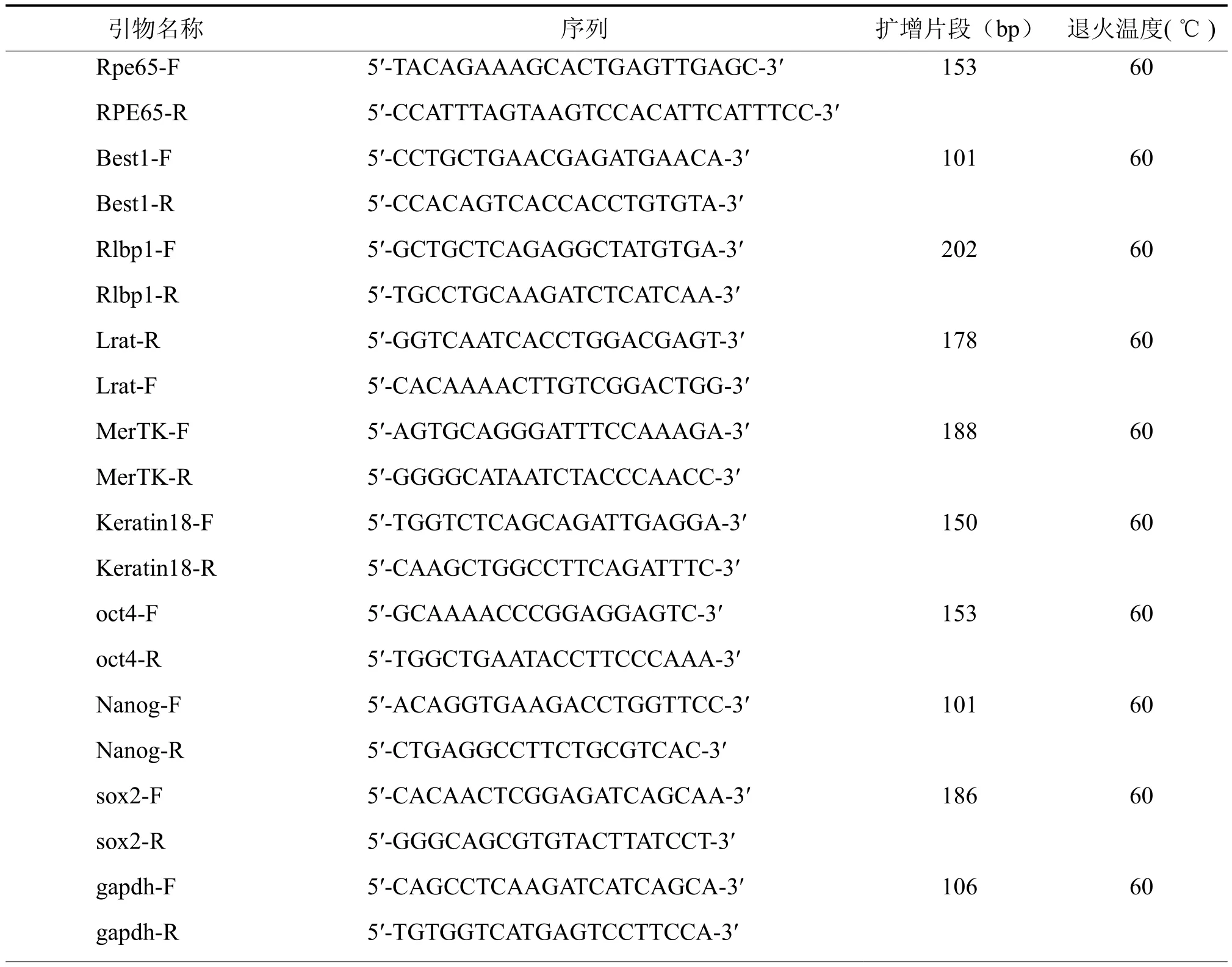
表1 Q-PCR扩增引物、片段以及退火温度
(六)Western Blotting检测iPS-RPE在不同分化阶段蛋白表达以及mTOR信号通路上相关蛋白的表达
收集各个分化时间点上的蛋白样品,裂解提取细胞总蛋白,采用BCA方法进行蛋白定量。每孔上样30 μg,10﹪SDS-PAGE胶分离,电转移至PVDF膜上,5﹪脱脂奶粉孵育60min后,加入相应一抗4℃孵育过夜,TBST洗膜后加入相对应的二抗(均为1:5000),室温孵育2h后洗膜,ECL显色,拍照。
(七)雷帕霉素处理分化一个月的iPS-RPE细胞,Western Blotting检测RPE细胞的去分化状态是否得到改善
将分化时间为1个月的iPS-RPE细胞作为实验组,分别加入终浓度为100 nmol/L雷帕霉素(实验组)以及100 nmol/L DMSO(对照组),培养6 d后,收集各组的蛋白样品,Western Blotting检测各组的iPS-RPE细胞的特异性蛋白表达,方法同前。
三、统计学分析方法
采用SPSS 11.0统计学软件分析,Q-PCR检测iPS-RPE细胞不同分化时间点上基因mRNA水平表达结果比较采用单因素方差分析(One-Way ANOVA),以P≤0.05为差异有统计学意义。
结 果
一、iPS细胞克隆以及EB形成,并向RPE细胞分化的形态变化
iPS在MEF细胞上培养3 d后生长成为卵圆形或者圆形克隆,克隆边界明显(图1a)。后悬浮培养7 d后,形成拟胚体EB,EB团块出现黑色色素(图1b),后将EB贴壁培养,使iPS诱导分化为iPS-RPE细胞(图1c)。
二、IF检测iPS-RPE细胞定向分化1个月时细胞内特异性蛋白的表达
本研究通过细胞免疫荧光技术,检测了在分化1个月时,iPS-RPE细胞内RPE65、ZO-1、Lrat蛋白的表达情况,这些蛋白是RPE细胞分化到一定阶段才表达出现的。通过荧光显微镜观察,发现在分化1个月的iPS-RPE细胞中,RPE65、ZO-1、Lrat蛋白都有了一定量的表达,说明了细胞已经具有了RPE的特性(图2)。
三、Q-PCR检测iPS-RPE细胞不同分化时间点上基因mRNA水平表达情况
发现随着分化时间的延长(1个月、2个月、3个月),以未分化的iPS细胞作为对照,iPS细胞特异性基因(oct4、nanog、sox2)表达显著下降,oct4在分化1个月、2个月、3个月时的表达量分别为0.02±0.006、0.08±0.01、0.28±0.06(P=0.000) ;nanog在分化1个月、2个月、3个月时的表达量分别为 0.05±0.009(P=0.000),0.23±0.035(P=0.000),0.53±0.26(P=0.002),sox2在分化 1个月、2个月、3个月时的表达量分别为0.08±0.03、0.26±0.057、0.30±0.16(P=0.000)。而 RPE 细胞的一些特异性基因RPE65在分化3个月时的表达量20.3±4.9(P=0.000),Best1在分化3个月时的表达量为 11.78±1.57(P=0.000),表达量均显著提高,同时RPE细胞的成熟性标记物MerTK、CK18基因随着分化时间的延长,表达量显著提高,MerTK在分化3个月时的表达量为15.53±1.33(P=0.000),CK18分化3个月时的表达量为9.67±1.44(P=0.000)。由此可见,iPSRPE细胞随分化时间日趋成熟(图3)。

图1 光学显微镜下观察iPS-RPE细胞分化过程(×400)

图2 荧光显微镜下观察ips-RPE细胞内特异性蛋白(RPE65、ZO-1以及LRAT)的表达情况((×400))

图3 ips-RPE细胞在不同分化时间段细胞内特异性基因表达变化
四、Western Blotting检测不同分化时间点上iPS-RPE细胞特异性蛋白的表达以及mTOR信号通路上相关蛋白表达
与iPS细胞在未分化状态比较,RPE细胞特异性的蛋白 Lrat、BEST1、ZO-1、MerTK、MITF在分化时间为2个月、3个月时,表达量显著提高,其中Lrat、BEST1、ZO-1蛋白是成熟RPE细胞中特异性表达的。C-MYC蛋白的表达一般与细胞的生长状态有关,在高度分化的细胞中其表达是下降的,本实验中,C-MYC蛋白随分化时间的延长显著降低(图4)。同时,检测mTOR信号通路上的相关蛋白磷酸化水平的变化,发现p-MTOR、p-P70S6、p-S6显著降低,在分化3个月的时候,下降得最明显(图5),这表明在分化过程中mTOR信号通路是被抑制的。同时检测终浓度为400 nmol/L雷帕霉素对分化1个月的iPS-RPE细胞的相关蛋白的表达的影响,实验组与对照组比较,catenin蛋白显著上升,而BEST1、ck18、MerTK蛋白也有提高,但没有统计学意义(图6),表明雷帕霉素通过抑制mTOR信号通路,提高了RPE细胞分化过程中部分特异性蛋白的表达,加速了RPE细胞分化的进程。

图4 iPS-RPE细胞在不同分化时间段细胞内特异性蛋白的表达变化

图5 iPS-RPE细胞在不同分化时间段mTOR信号通路相关蛋白的表达变化
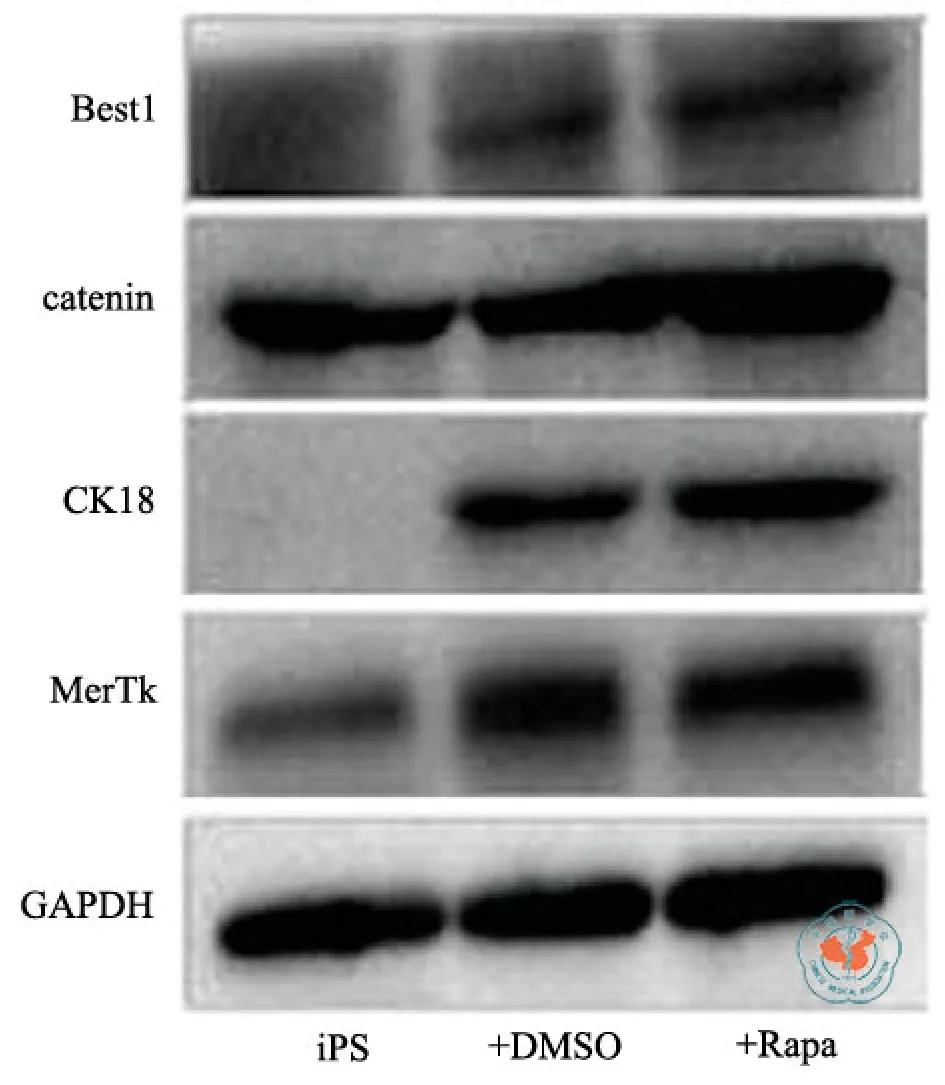
图6 雷帕霉素对分化一个月的iPS-RPE细胞内特异性蛋白的表达影响
讨 论
视网膜退行性疾病简称视网膜变性,包括遗传性视网膜疾病和多因素视网膜变性疾病,是由于视网膜色素上皮(RPE)细胞和视网膜感光细胞变性导致视功能下降的一组疾病。iPS细胞将成为细胞移植的一个重要来源。研究表明,由iPS诱导来的RPE细胞具备原代RPE细胞的重要分子标记,此外,iPS细胞来源于患者自身,iPS-RPE细胞同患者具有相同的基因型,因而可提供个性化的治疗平台[7]。然而,iPS-RPE细胞与自然RPE细胞相比,某些重要特征标记蛋白表达严重降低(如RPE65、BEST1蛋白),使得iPS-RPE细胞移植来治疗视网膜变性仍然存在着重要瓶颈[8-9]。
哺乳动物雷帕霉素靶蛋白[10-12]mTOR是一种丝氨酸与苏氨酸蛋白激酶,在细胞生长、分化、增殖、迁移和存活上扮演重要角色。上皮细胞具有快速持续更新的特点,mTOR信号通路在上皮细胞的增殖和分化过程中发挥重要调节作用。笔者先前的研究表明[5],应用雷帕霉素抑制mTOR基因在所有动物模型中显著减缓RPE去分化过程并提高了光感受器细胞的数量及功能,抑制mTOR之后,其下游的STAT3和Mitf等转录因子的表达也会下降,从而暗示了mTOR通路调控RPE细胞分化的分子途径。本研究在iPS-RPE细胞分化的不同时间点,通过Q-PCR和Western Blotting的方法检测iPS-RPE细胞中特异性基因mRNA和蛋白水平的表达变化。笔者发现随着分化时间的延长(分化3个月),RPE细胞的一些特异性基因和蛋白(BEST1、catenin、MerTK蛋白)的表达水平显著提高。MerTK是RPE细胞吞噬功能的重要调控蛋白,BEST1是成熟RPE细胞的特异性标记,在越分化成熟的RPE细胞中,其表达量呈现上升趋势[13-14]。同时检测了各分化时间点上,mTOR信号通路相关蛋白的磷酸化水平,结果发现在RPE细胞分化了3个月时,p-mtor、p-p70s6、p-s6蛋白都显著下降,这表明在分化越成熟的iPS-RPE细胞中,mTOR信号通路的活性就越低。由此可见mTOR信号通路在体外的iPS-RPE细胞分化调控过程中起着重要作用。
同时,本课题组先前通过一系列AMD的小鼠模型发现[5],应用雷帕霉素抑制mTOR基因在所有动物模型中,显著减缓了RPE去分化过程并提高了光感受器细胞的数量功能。由于雷帕霉素在上述动物模型中提高了RPE65、LRAT、RLBP1等RPE重要功能蛋白的表达,而这些蛋白的突变又是许多遗传性视网膜变性疾病的症状。因此笔者还应用雷帕霉素抑制iPS-RPE细胞中mTOR的通路来进行反证。结果发现实验组(加 rapa)与对照组(加DMSO)比较,catenin蛋白表达量显著提高,但是BEST1、ck18、MerTK蛋白没有显著性地提高。分析原因有可能是实验中的雷帕霉素的浓度以及作用时间还有待进一步地摸索。雷帕霉素的处理极有可能加速iPS细胞向RPE细胞分化的进程,并最终提高了iPS-RPE细胞的自然属性。
本研究建立了体外培养高等分化、功能高效的iPS-RPE细胞的方法,初步探索了mTOR信号通路在iPS-RPE细胞分化过程中的调控机制,为iPS-RPE细胞移植来治疗视网膜变性提供了一定的科学依据。mTOR信号通路究竟是通过哪些下游分子调控体外的iPS-RPE细胞分化过程还有待进一步的探究。
1 Fishman GA,Roberts MF,Derlacki DJ,et al.Novel mutations in the cellular retinaldehyde-binding protein gene (RLBP1) associated with retinitis punctata albescens:evidence of interfamilial genetic heterogeneity and fundus changes in heterozygotes[J].Arch Ophthalmol,2004,122(1):70-75.
2 Cideciyan AV.Leber congenital amaurosis due to RPE65 mutations and its treatment with gene therapy[J].Prog Retin Eye Res,2010,29(5):398-427.
3 Laurent LC.MicroRNAs in embryonic stem cells and early embryonic development[J].J Cell Mol Med,2008,12(6):2181-2188.
4 Liao JL,Yu J,Huang K,et al.Molecular signature of primary retinal pigment epithelium and stem-cell-derived RPE cells[J].Hum Mol Genet,2010,19(21):4229-4238.
5 Zhao C,Yasumura D,Li X,et al.mTOR-mediated dedifferentiation of the retinal pigment epithelium initiates photoreceptor degeneration in mice[J].J Clin Invest,2011,121(1):369-383.
6 Fumitaka Osakada,Zi-Bing Jin,Yasuhiko Hirami,,et al.In vitro differentiation of retinal cells from human pluripotent stem cells by small-molecule induction[J].J Cell Sci,2009,1(122):3169-3179.
7 Nishikawa S,Goldstein RA,Nierras CR.The promise of human induced pluripotent stem -cells for research and therapy[J].Mol Cell Biol,2008,9:725-729.
8 Alge CS,Suppmann S,Priglinger SG,et al.Comparative proteome analysis of native differentiated and cultured dedifferentiated human RPE cells[J].Invest Ophthalmol.Vis.Sci,2003,44(8):3629-3641.
9 Klimanskaya I,Hipp J,Rezai KA,et al.Derivation and comparative assessment of retinal pigment epithelium from human embryonic stem cells using transcriptomics[J].Cloning Stem Cells,2004,6(3):217-245.
10 Jankiewicz M ,Groner B,Desriviers S.Mammalian target of rapamycin regulates the growth of mammary epithelial cells through the inhibitor of deoxyribonucleic acid bindingId1 and their functional differentiation through Id2[J].Mol Endocrinol,2006,20(10):2369-2381.
11 Chen Y,Wang J,Cai J,et al.Altered mTOR signaling in senescent retinal pigment pithelium[J].Invest Ophthalmol Vis Sci,2010,(10):5314-5319.
12 Martin DE,Hall MN.The expanding TOR signaling network[J].Curr Opin Cell Biol,2005,17(2):158-166.
13 Gal A,Li Y,Thompson DA,et al.Mutations in MERTK,the human orthologue of the RCS rat retinal dystrophy gene cause retinitis pigmentosa[J].Nat Genet,2000,26(3):270-271.
14 Fishman GA,Roberts MF,Derlacki DJ,et al.Novel mutations in the cellular retinaldehyde-binding protein gene (RLBP1) associated with retinitis punctata albescens:evidence of interfamilial genetic heterogeneity and fundus changes in heterozygotes[J].Arch Ophthalmol,2004,122(1):70-75.
——雷帕霉素

